PD98059抑制MAPK/ERK信号通路对胃癌细胞生物学功能的影响
刘梦琪,张文文,陈晓伟,沈孝兵*
(东南大学公共卫生学院环境医学工程教育部重点实验室,江苏 南京 210009)
胃癌是全球最常见的恶性肿瘤之一,高发病率和高死亡率使人类的健康和生命受到了极大的威胁。据统计,2015年全国新增胃癌病例大约67.9万例,新增死亡病例大约49.8万例[1]。转移在胃癌患者进展和预后的过程中起关键作用[2],而目前胃癌的预后情况仍不乐观[3]。研究表明胃癌等恶性肿瘤的发生和发展与许多关键信号通路的激活有关。丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)是研究不同膜受体与细胞核之间联系最重要的信号途径,在多种恶性肿瘤的发生发展中发挥着重要作用[4]。MAPK信号通路分为4类,包括细胞外信号调节激酶(extracellular regulated protein kinases, ERK)、 P38、JNK和细胞外信号调节激酶5。ERK是MAPK家族中备受关注的中心成员,MAPK/ERK信号通路是细胞因子调控细胞途径的重要通路[5],其上游分子MEK可通过磷酸化Tyr和Th2两个位点而激活ERK[6]。磷酸化后的ERK成为有活性的蛋白激酶,可调节细胞的多种功能,包括细胞增殖、分化、凋亡和衰老,同时参与炎症因子的产生和分泌[7-8]。研究报道,MAPK/ERK信号通路的激活出现在许多恶性肿瘤细胞中(包括肺癌、胰腺癌、结肠癌等)[9]。本研究验证了MAPK/ERK信号通路在胃癌中的激活情况,并进一步探讨了PD98059对胃癌细胞生长的影响,为通路抑制剂在临床中的应用积累更多的实验依据。
1 材料与方法
1.1 实验材料
人低分化胃癌细胞株SGC-7901购于南京凯基生物公司,正常胃黏膜上皮细胞GES-1由本实验室传代培养。抑制剂PD98059购自Selleck公司,FITC/PI细胞凋亡检测试剂盒及细胞周期检测试剂盒购于南京凯基生物公司,引物由南京金斯瑞公司合成,逆转录试剂盒购自日本TaKaRa公司,Western blot试剂盒购于美国Bio-Rad公司,抗体(一抗actin、ERK1/2、p-ERK1/2、MEK1/2、p-MEK1/2和HRP标记山羊抗兔二抗、HRP标记山羊抗鼠二抗)购自美国CST公司。
Quant-Studio 7实时荧光定量PCR(qPCR)仪购于美国ABI公司,SDS-PAGE电泳仪及湿转仪购于美国Bio-Rad公司,流式细胞仪来自美国BD公司,Multiskan MK3型酶标仪来自美国Thermo公司。
1.2 方法
1.2.1 细胞培养 将人胃癌细胞SGC-7901和正常胃黏膜上皮细胞GES-1分别置于含有10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素的RPMI-1640和DMEM培养基中,置于CO2体积分数为5%、37℃恒温培养箱内培养。当细胞生长至近融合状态时,用含0.25%EDTA的胰蛋白酶消化传代,取对数生长期的细胞进行后续实验。
1.2.2 qPCR检测胃癌细胞和正常胃黏膜细胞关键基因表达 当SGC-7901和GES-1细胞生长至对数生长期时,Trizol法提取总RNA,按照逆转录试剂盒配制溶液后放入PCR仪中反应,反应条件为37℃、15 min,85℃、5 s,将RNA逆转录为cDNA。登陆NCBI网站查找人类基因序列,登陆IDT引物设计网站设计引物。逆转录反应体系为20μL,其中PrimeScript RT酶1 μL,RT Primer Mix 1 μL,5×PrimeScript缓冲液4μL,无RNA酶水4μL,去除基因组DNA反应液10μL。MEK、ERK、β-actin基因引物序列见表1。用无RNA酶水将引物稀释至10μmol/L,-20℃保存。采用Quant StudioTMReal-Time PCR进行数据采集分析。qPCR扩增条件为95℃、2 min预变性,40个循环扩增(95℃、15 s,60℃、30 s),每个样品设置3个复孔。采用2-ΔΔCT值(ΔCT=CT,目的基因-CT,actin;ΔΔCT=ΔCT,实验组-ΔCT,对照组)表示目的基因mRNA相对表达量。

表1 实时荧光定量PCR引物序列
1.2.3 Western blot检测胃癌细胞SGC-7901和正常胃黏膜细胞GES-1关键蛋白的表达 当胃癌细胞SGC-7901和GES-1细胞生长至对数生长期时,PBS收集细胞,离心后加入120μL裂解液,充分混匀后置于冰上裂解20 min。12 000 r/min离心10 min,取上清。BCA法测定蛋白浓度。加入缓冲液煮沸蛋白后-20℃保存。用10%SDS-PAGE凝胶电泳,电泳结束后转至PVDF膜上,5%脱脂牛奶在室温封闭1 h,1∶1 000 稀 释 的 一 抗 (β-actin、 ERK1/2、 p-ERK1/2、MEK1/2、p-MEK1/2)在4℃孵育过夜,次日1∶5 000稀释的二抗(HRP标记的山羊抗兔和山羊抗鼠)室温孵育1 h,TBST洗涤5次,用显色液曝光并观察结果。
1.2.4 CCK-8检测PD98059处理后的细胞活力 SGC-7901细胞长至对数生长期时,0.25%胰酶消化细胞,制成单细胞悬液,配成每孔为5×104个细胞的悬液后,以每孔100 mL将细胞接种于96孔板,置于CO2体积分数为5%、37℃培养箱内培养。培养24 h后弃去原培养液,每孔加入100μL无血清培养基,培养箱内饥饿处理24 h。
饥饿处理结束后,设置空白组(只加培养基不加细胞),对照组(只加细胞和培养基,不加药物)和实验组(分别加入浓度为25、50、100、200、300和400 mmol/L的抑制剂PD98059),每组6个复孔。恒温培养箱培养24 h后,吸去培养基,每孔加入CCK-8溶液10 mL,继续培养1~4 h。酶标仪检测吸光度D(450)值,按下式计算细胞增殖率。
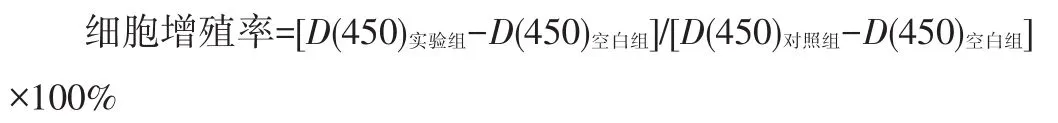
1.2.5 qPCR检测PD98059处理后的胃癌细胞关键 基因表达 于6孔板中接种1×105个对数生长期的SGC-7901细胞。根据CCK-8结果筛选出PD98059的处理剂量,抑制剂配制终浓度为0、25、50和100 μmol/L。饥饿处理24 h后开始加药。药物处理24 h后qPCR检测MEK、ERK基因表达。
1.2.6 Western blot检测PD98059处理后胃癌细胞关键蛋白的表达 设置3个不同浓度的实验组分别加入浓度为25、50和100μmol/L的PD98059,培养24 h后利用Western blot检测细胞中MEK、ERK等关键蛋白表达。
1.2.7 流式细胞术检测细胞周期 设置对照组(不加抑制剂PD98059)和实验组(分别加入浓度为25、50、100μmol/L的抑制剂PD98059),收集各组加药24 h后的SGC-7901细胞,吸去培养基,用PBS洗涤细胞两次(2 000 r/min离心5 min)并调整细胞浓度至1×106个/mL,离心弃上清,加入100μL RNase溶液吹打混匀,37℃水浴30 min,利用500μL碘化丙啶(PI)染液重悬细胞,4℃避光30 min,200目筛网过滤,上机检测。
1.2.8 Annexin V/PI染色检测细胞凋亡 设置对照组(不加PD98059抑制剂)和实验组(分别加入浓度为25、50、100 μmol/L的PD98059)处理24 h后收集细胞,离心弃上清。按照试剂盒说明书进行操作,轻轻混匀后室温避光放置10 min。1 h内用流式细胞仪检测。
1.3 统计学分析
采用SPSS 17.0和Excel 2007进行数据统计分析,不同剂量组间采用单因素方差分析,以α=0.05为检验水准。
2 结果
2.1 胃癌细胞SGC-7901和正常胃黏膜上皮细胞GES-1中MEK和ERK mRNA的表达
利用qPCR技术测定MEK和ERK mRNA的表达,扩增曲线较好,熔解曲线表明特异性良好。MEK和ERK mRNA在胃癌细胞SGC-7901中的表达显著高于正常细胞GES-1,差异具有统计学意义(P<0.05)。如图1。

图1 SGC-7901和GES-1细胞中MEK和ERK mRNA的表达
2.2 MEK和ERK及其磷酸化蛋白在胃癌细胞SGC-7901和GES-1细胞中的表达
Western blot检测结果显示总MEK和ERK蛋白在胃癌细胞SGC-7901的表达与对照组GES-1细胞相比,差异无统计学意义(P>0.05)。但SGC-7901细胞中的磷酸化蛋白p-MEK、p-ERK的表达均显著高于对照组,差异均具统计学意义(P<0.05)。见图2。
2.3 不同浓度PD98059对SGC-7901细胞增殖能力的影响
如图3所示,CCK-8法测定结果得出,0~200 μmol/L PD98059处理SGC-7901细胞后,PD98059对细胞具有抑制作用,且抑制作用随其浓度的增加而降低,呈现剂量依赖性。当PD98059浓度处于200~400 μmol/L时抑制作用逐渐趋于平稳,达到300μmol/L时进入平台期,300μmol/L与400μmol/L两组间细胞增殖率的差异无统计学意义(P>0.05)。
2.4 PD98059作用后MEK和ERK mRNA水平的表达
与对照组相比,各剂量组MEK和ERK的mRNA表达量降低,差异均具统计学意义(P<0.05)。如图所示随着PD98059浓度的增加,ERK mRNA的表达量逐渐降低(F=27.657,P<0.05)。而 MEK mRNA 在 25 和100μmol/L剂量组时的表达量低于50μmol/L剂量组,出现高浓度低抑制的现象。见图4。
2.5 PD98059作用后胃癌细胞关键蛋白水平表达
如图5,Western blot检测结果发现,PD98059作用SGC-7901细胞24 h后,MEK1/2在50和100μmol/L剂量组蛋白表达高于对照组(P<0.05);而p-MEK1/2在50、100 μmol/L剂量组表达低于对照组(P<0.05)。各剂量组总ERK1/2表达无显著差异(P>0.05),而随着抑制剂PD98059浓度的增加,各剂量组磷酸化蛋白p-ERK1/2的蛋白表达量逐渐降低,差异具有统计学意义(P<0.05)。

图2 MEK和ERK及其磷酸化蛋白的表达

图3 PD98059对胃癌SGC-7901细胞增殖的抑制作用

图4 PD98059处理后胃癌SGC-7901细胞的mRNA表达

图5 PD98059对胃癌SGC-7901细胞蛋白表达的影响
2.6 流式细胞术检测细胞周期结果
流式细胞术检测结果见表2。PD98059作用于胃癌细胞株SGC-7901 24 h后,与对照组(0μmol/L)相比,G0/G1期细胞比例逐渐上升,差异具有统计学意义(P<0.05);S期细胞比例随着PD98059浓度的增加逐渐降低(P<0.01);且G2/M期细胞比例逐渐下降,明显低于对照组(P<0.01)。结果提示在 PD98059 的作用下,胃癌细胞SGC-7901在G0/G1期发生阻滞。
表2 PD98059处理24 h后胃癌SGC-7901细胞的周期变化±s,%)

表2 PD98059处理24 h后胃癌SGC-7901细胞的周期变化±s,%)
分组对照组PD98059 25μmol/L 50μmol/L 100μmol/L F值P值G0/G1 72.56±1.27 85.75±1.47 90.42±1.51 92.7±2.14 91.45<0.01 S 10.10±0.06 8.26±1.28 6.21±1.12 4.45±2.41 8.32<0.01 G2/M 17.33±1.21 5.99±0.42 3.36±0.40 2.85±0.32 291.37<0.01
2.7 流式细胞术测定细胞凋亡率
见图6,25、50和100μmol/L PD9805925作用于实验组后,凋亡率分别为(11.27±0.47)%、(32.70±1.80)%、(32.87±6.54)%,当抑制剂浓度由25 μmol/L增至50μmol/L时,实验组凋亡率也随着浓度的增加而增加,呈现剂量依赖性(P<0.05),但50和100μmol/L浓度组间凋亡率无显著差异(P>0.05)。

图6 PD98059对胃癌SGC-7901细胞凋亡的影响
3 讨论
国内外研究已证实MAPK/ERK信号通路的过度激活与肿瘤的发生发展密切相关[10]。MAPK/ERK信号途径又称为Ras-Raf-MEK-ERK通路,可被炎症因子和细菌复合物等激活(活化后呈磷酸化形式),影响细胞的增殖、分化、凋亡等多种生物学过程[11-12]。ERK是MAPK家族中一条经典的信号途径,分为5个亚家族:ERK1~5。ERK1和ERK2是两种异构体,ERK1/2转导途径是当前研究最为详细最为透彻的MAPK途径。ERK信号转导途径主要由以下3种蛋白激酶组成即Raf、MEK、ERK。当胞外刺激转导至胞内或核内后,导致不同细胞因子的激活,小分子鸟苷酸SOS与蛋白Ras结合使其上的GDP解离从而结合GTP导致Ras激活,活化的Ras与Raf的N端结构域结合,将Raf转移到胞膜,在胞膜上Raf被激活,活化的Raf与MEK结合后使MEK激活,活化的MEK可使丝氨酸、苏氨酸和酪氨酸发生磷酸化,最终激活ERK实现信号的传导[13]。活化后的ERK进入核内可使相应的转录因子磷酸化,影响细胞周期进展,调控相关基因和蛋白的表达,从而介导细胞增殖和凋亡过程[14-15]。
MEK位于MAPK/ERK通路中的关键位置,因此有效的MEK抑制剂可能在癌症的治疗中非常有用。MEK抑制剂是最早开发的一些小分子细胞膜可渗透抑制剂,已被确定具有高度的抑制性,可用于各种类型的癌症以及其他疾病的临床研究[16]。MEK抑制剂PD98059是非底物依赖性竞争的蛋白激酶抑制物,对ATP无影响,具有抗肿瘤作用[17]。研究表明,在乳腺癌[18]、肝癌[19]细胞中PD98059浓度越高,对细胞的抑制作用越强。除此之外PD98059在宫颈癌和大肠癌等方面的报道也很多。
Fujimori等[20]发现61%的胃癌病人中存在ERK高表达。本研究通过体外培养胃癌细胞SGC-7901和正常胃黏膜上皮细胞GES-1,对比两者MEK和ERK mRNA和蛋白的表达,结果显示胃癌细胞SGC-7901中MEK和ERK mRNA表达显著升高(P<0.01);MEK1/2和ERK1/2总蛋白的表达无显著差异,但胃癌细胞SGC-7901中的p-MEK1/2和p-ERK1/2的表达显著高于对照组GES-1细胞(P<0.05)。表明了MAPK/ERK信号通路在胃癌中的激活状态。Liang等[21]在胃癌组织中发现MAPK信号通路的激活。本研究结果与以上研究结果一致,说明了MAPK/ERK信号通路在胃癌中呈现激活状态。
利用不同浓度PD98059处理胃癌细胞SGC-7901 24 h后。CCK-8法检测结果显示,当PD98059浓度在0~200μmol/L时,与对照组相比,PD98059抑制细胞生长的作用随其浓度的升高而呈下降趋势,当PD98059浓度到达200~400μmol/L时,抑制作用趋于平稳。这与Corona等[22]在结直肠癌中应用MEK抑制剂PD98059,抑制了肿瘤细胞的增殖结果类似。我们进一步采用流式细胞仪测定得出PD98059对胃癌SGC-7901细胞具有促凋亡作用,与相关报道一致[23]。但在浓度为50~100μmol/L时,凋亡率间的差异无统计学意义(P>0.05),趋于平稳。增殖结果与凋亡结果一致,先抑制后趋于平稳,说明抑制剂作用有上限。有学者研究发现PD98059可以使细胞发生G0/G1期阻滞,促进细胞凋亡[24]。本次细胞周期检测结果显示,经过PD98059处理后的SGC-7901细胞在DNA合成期及合成后期细胞数减少,且产生G0/G1期阻滞。表明PD98059通过抑制MAPK/ERK信号通路的活化并将细胞阻滞在G0/G1期来抑制胃癌细胞的增殖。
PD98059能够通过结合MEK1上的位点抑制其激活与磷酸化从而抑制ERK1/2的磷酸化[25]。qPCR检测结果显示,与对照组相比,PD98059可降低MEK和ERK mRNA的表达水平,但在MEK mRNA表达结果中,却出现高浓度低抑制现象,这可能与信号通路的负反馈调节机制有所关联。李楠等[26]研究发现MAPK/ERK信号通路的负反馈调节作用可降低结直肠癌细胞对奥沙利铂的敏感性同时可激活Bcl-2等的转录,促进结直肠癌细胞的增殖和侵袭。而当PD98059浓度为50μmol/L时,信号通路再次激活,MEK mRNA转录水平升高。Western blot结果显示,与对照组相比,PD98059抑制剂作用于胃癌细胞SGC-7901后,MEK1/2和p-MEK1/2在25μmol/L时蛋白表达未发生变化,说明较低浓度PD98059未对MEK蛋白的表达起到调控作用。而50和100μmol/L时MEK1/2蛋白表达随着PD98059浓度的增加逐渐升高,p-MEK1/2蛋白的表达逐渐降低。各剂量组总ERK1/2表达无显著差异,而随着PD98059浓度的增加,p-ERK1/2的蛋白表达量逐渐降低。本研究结果显示PD98059通过下调p-MEK1/2、p-ERK1/2的表达,即抑制MEK1/2和ERK1/2的磷酸化,从而抑制MAPK/ERK信号通路的活化。
综上所述,PD98059通过阻断MEK和ERK基因的表达抑制了胃癌细胞SGC-7901的生长和增殖。因此PD98059通过抑制MAPK/ERK信号通路活化从而发挥了有效的抗癌作用。目前通过抑制或阻断癌症相关信号通路中关键信号异常表达已经成为临床中癌症治疗的策略之一。研究结果有利于进一步探讨胃癌的相关发病机制,并为抑制剂PD98059作为抗癌药物优化治疗提供了新的依据。但目前尚有一些相关的分子生物学机制有待进一步探索与研究。

