哺乳动物单细胞研究技术的现状与未来
姜文倩,田亚茸,左锐,林峻
1 福州大学 应用基因组学研究所,福建 福州 350108
2 哥德堡大学 生物医药研究所感染性疾病中心,瑞典 哥德堡 40530
3 福建医科大学 基础医学院,福建 福州 350122
4 福州大学 生物科学与工程学院,福建 福州 350108
细胞是生命的基本单位,大多数生命体都是多细胞生物。过去,由于技术的限制,研究者对细胞的研究仅处于多细胞层面。多细胞研究假设培养皿中所有的细胞在培养过程中都相同,科学家们只是在放大信号。但这并不总是正确的,分子水平上的细微差别可能导致细胞行为的显著变化。
近年来,基于对多细胞DNA、RNA以及蛋白质的研究,科学家们对各种物种有了深刻的了解。但研究多细胞对理解细胞的多样性存在一定的局限性。每个细胞都是独一无二的,不仅肿瘤细胞存在异质性,人体正常细胞间也存在异质性[1-4],甚至在同一个体中,不同单细胞都有其独特的基因组。多细胞研究的结果仅体现出这些多细胞的总体情况,而不能体现单个细胞之间的差异。单个体细胞基因组的变异,诸如单核苷酸变异(SNVs)、拷贝数变异 (CNVs) 和结构变异,可能导致癌症及其他疾病的产生[5-7]。
为了打破多细胞研究的局限性,人们越来越关注单细胞研究。单细胞研究有助于我们研究癌症等相关疾病。无论是增殖或休眠的肿瘤组织,单个细胞都是支配癌症生物学各方面的决定因素[8]。对肿瘤组织单细胞水平的分析能了解肿瘤内遗传异质性对癌症的发展和治疗所产生的影响[9],能够让我们对疾病有更加深入的了解,从而制定更为有效的治疗对策。此外,法医学通常只有少量的材料可供分析,而能从少量的材料中获得结果则得益于先进的单细胞技术[10]。基于PCR反应的短串联重复序列 (Short tandem repeat,STR) 分型是法医鉴定的有力工具。而基于液滴微流体技术的单细胞STR分型技术,具有高灵敏度、高通量和高保真度,该技术在分析不同细胞材料时,对保持单一基因组的完整性十分有效[11]。在临床生殖医学方面,人卵母细胞的单细胞基因组分析对于减数分裂研究和植入前基因组筛查非常重要。基于多重退火环状循环扩增 (Multiple annealing and looping based amplification cycles, MALBAC) 的体外受精植入前基因组筛查可以精确和经济地选择出可用于胚胎移植的正常受精卵[12]。
随着人们对单细胞研究的深入,单细胞基因组学、单细胞转录组学和单细胞蛋白质组学正经历着突飞猛进的发展[13]。虽然单细胞研究与多细胞研究相比具有多种优势,但存在单细胞挑取和单细胞基因组扩增等难题。文中将从单细胞挑取、单细胞DNA分析、单细胞RNA分析、单细胞蛋白质分析等方面介绍单细胞研究现状。
1 单细胞分离技术
单细胞分离是单细胞分析的主要难点之一。文中将主要介绍以下3种单细胞分离技术。
1.1 显微移液法
常见的显微移液法可以在非常简单的实验条件下进行,例如用胰酶将培养细胞或者组织中的细胞消化,形成分散的单细胞,将细胞稀释至一定比例 (例如约500个单细胞均匀分布在10 cm细胞培养皿中),在显微镜下寻找单细胞,并用移液器吸取单细胞。除了上述方法,还能借助克隆环[14]挑取单细胞。先制备一个含有单克隆的平板,在显微镜下找到满意的单克隆并标记,用镊子将克隆环轻放至标记处并滴加胰酶消化,待细胞变圆后,用移液器吸取单细胞[15]。手工挑取单细胞对操作者、操作环境都有较高的要求,并且在吸液时容易吸到多个细胞,可能因操作不当导致细胞破裂,但因其操作简便、成本低廉,是实验室分离单细胞最常用的技术。
1.2 激光捕获显微切割 (Laser capture microdissection, LCM)
激光捕获显微切割 (LCM) 是一种通过显微镜寻找感兴趣的细胞,利用激光从非均一组织切片或活细胞培养中分离高纯度细胞群或单细胞的技术[16-18]。LCM一般分为两类:红外 (IR) 捕获系统[16-17,19-20]和紫外 (UV) 切割系统[21-22]。目前,主要有4种类型的激光显微切割仪,工作原理各异。
最早问世的激光显微切割仪基于红外 (IR)捕获系统和紫外 (UV) 切割系统。红外激光捕获感兴趣的细胞,紫外激光能显微切割所捕获的细胞。其工作原理为:首先,在倒置显微镜下找到感兴趣的细胞,将热塑性聚合物薄膜放在组织切片感兴趣的细胞上;操作者使用激光脉冲激活热塑性聚合物薄膜,使薄膜熔化并包围感兴趣的细胞;所形成的聚合物细胞复合物易从组织中转移出来,并用提取缓冲液溶解聚合物膜释放感兴趣的细胞[16-18]。
其余3种激光显微切割仪都是采用紫外激光系统,它们各有特色。其中一种依赖重力的激光显微切割仪,其特点在于不移动样品,而是移动激光。在正置显微镜下找到目标细胞后,使用高精度光学部件将激光束沿着棱镜上的期望切割线引导到组织上,切割目标区域,目标细胞将通过重力掉落到收集管中[23-24]。由于不接触样品,能使污染风险降到最低。另一种激光显微切割仪基于光压反弹分离系统。在倒置显微镜下找到目标细胞,利用高精度聚焦激光束切割样品后,发射一个激光脉冲,利用激光将目标细胞弹射至收集器中。该激光显微切割仪也不接触样品,能够快速、无污染地分离目的细胞。最后一种激光显微切割仪的特点在于样品的制备。样品被放置在MembraneSlide上,MembraneSlide是覆盖一层惰性薄膜的玻片,该薄膜有可以忽略不计的自体荧光;然后,将membraneslide倒置于载玻片上以防止污染。固态紫外激光器发射的紫外激光经聚焦透镜聚焦,在经偏振光合束器合成一束后进入相差显微镜,电脑控制玻片移动切割样品,切割下来的目的细胞可附着在具有黏性的分离帽上[25]。加入溶解缓冲液,管子倒置约10 min。细胞将处于悬浮状态,可以进行下游处理。
激光捕获显微切割 (LCM) 能分离研究人员感兴趣的特定细胞,而不污染周边细胞[16-17,26]。LCM操作简便,能精准分离目的细胞,但显微和激光设备成本较高,而且通过LCM获得的单细胞基因组测序数据质量一直比较差[27]。LCM的另一个缺陷是,对于组织样品,常常需要切片后才能在显微镜下观察,但是切片过程常常会在纵向上把一个细胞切成好几块薄层,我们用LCM得到的单细胞,常常只是单细胞的一个薄层而已,会缺失很多亚细胞定位特异性的物质;同时,染色体也有可能在切片时被切断,导致DNA分析出现偏差。
1.3 微流体技术
微流体技术是指在微米级别下操纵流体的技术,常用于需要对流体进行操作的生物实验。微流体辅助细胞筛选 (MACS) 通过向液流通道中注入细胞,并以逐渐压缩通道高度的方式工作以实现单细胞分离[13,28]。
基于微流体技术工作的单细胞自动制备系统能在微流体芯片 (Integrated fluidic circuit,IFC) 中将单细胞分离至个体反应室中,并用于mRNA测序、DNA测序、表观遗传学或miRNA表达等下游分析。使用该系统制备单细胞的核心过程主要包括5个步骤:首先,对于固体组织或贴壁细胞培养,需要适当的消化,而流体组织或悬浮细胞培养需要亚群富集;进一步富集细胞;之后,需要进一步富集和染色细胞;然后在使用该系统之前进行质量控制;最后可以通过微流体分离单个细胞。与显微移液法和激光捕获显微切割 (LCM) 分离单细胞相比,单细胞自动制备系统对操作者技术要求不高、耗时短,仅需1 h就能捕获96个单细胞,并且能够分辨所捕获的单细胞是活细胞还是死细胞,同时能将单细胞捕获及后期的基因组、mRNA、蛋白质等分析完全自动化。
另一种单细胞分离仪基于数字液滴技术[29]。在一次性微流控芯片中,将单细胞和barcodes封装到近乎纳升的液滴中,细胞裂解及逆转录等后续一系列反应将在液滴中进行,反应产物可用于后续单细胞RNA测序。该单细胞分离仪的优势在于每天能处理成千上万个细胞,且可直接进行下游分析。
2 单细胞分析
2.1 单细胞DNA分析
20世纪70年代DNA测序技术的出现使得测定生命体的核酸组成成为现实[30-31]。基于PCR法的基因组测序已在20世纪90年代被用于人类单细胞分析[32],约10年后出现了等温扩增法[33-34]。单细胞基因组测序技术已被用于分析人类单个生殖细胞的重组模式和非整倍体性[12,35],以及肿瘤细胞和循环肿瘤细胞中基因组的异质性[36]。
然而,要进行单细胞基因组测序,就必须以单细胞微量的基因组为模板进行扩增,这成为单细胞分析的另一难点。单细胞全基因组扩增在过去10年中已有实质性进展[37]。单细胞全基因组扩增主要有三大类方法。第一类方法完全基于PCR扩增,采用随机引物扩增单细胞基因组,如DOP-PCR (Degenerate oligonucleotide-primed polymerase chain reaction)[38]、PEP-PCR (Primer extension preamplif ication PCR)[32]等。这种方法会优先扩增基因组中特定的位点,这将导致基因组覆盖率低,但扩增均匀性更好[27]。第二类方法基于等温法,最常用的是多重置换扩增 (Multiple displacement amplification, MDA)。采用等温随机引物与具有持续合成能力、高保真性和链置换活性的phi29聚合酶延伸基因组[39],并通过链的置换而不断进行指数扩增。与PCR法相比,等温法基因组覆盖率更高,但指数扩增将导致第一扩增位点比例过高[40]。第三类方法将PCR法和等温法相结合,克服了PCR法覆盖率低以及等温法不均匀的缺点。通过限制等温扩增反应的时间,避免了指数扩增的缺陷,以等温扩增产物为模板进行PCR扩增获得全基因组序列[41]。多重退火环状循环扩增技术 (Multiple annealing and looping based amplification cycles, MALBAC)[42]属于第三类方法。MALBAC的关键在于只复制原始基因组DNA,而不复制扩增产物,扩增产物3′端和5′端通过互补形成环状而被保护起来[43]。2017年4月,研究人员开发出一种新型单细胞基因组扩增法——LIANTI (Linear amplification with transposon insertion)[44]。LIANTI通过插入含有T7启动子的Tn5转座子而对单细胞基因组进行线性扩增,能避免指数扩增导致的偏倚和误差[44]。
目前市场上主要有4款单细胞扩增试剂盒:QIAGEN单细胞扩增试剂盒 (REPLI-g Single Cell Kit)、亿康基因MALBAC单细胞DNA快速扩增试剂盒 (MALBAC Single Cell DNA Quick-Amp Kit)、SIGMA 单细胞全基因组扩增试剂盒(GenomePlex Single Cell Whole Genome Amplification Kit) 和Rubicon单细胞扩增试剂盒(PicoPLEX DNA-seq Kit)。这4种单细胞全基因组扩增比较结果如表1所示。
目前单细胞基因组测序技术发展迅猛,虽然市面上已有许多单细胞基因组扩增试剂盒,但基于目前单细胞基因组扩增的原理,这些试剂盒还存在许多缺陷,如基因组覆盖率不能达到100%、扩增过程会导致等位基因丢失、单细胞扩增成本昂贵、无法同时对大量单细胞样本进行扩增等[49]。随着对单细胞的深入研究,研究者有望开发出新的单细胞基因组扩增技术,研发出集单细胞分离、基因组扩增和高通量测序为一体的仪器设备,大大减少单细胞研究的成本和耗时。
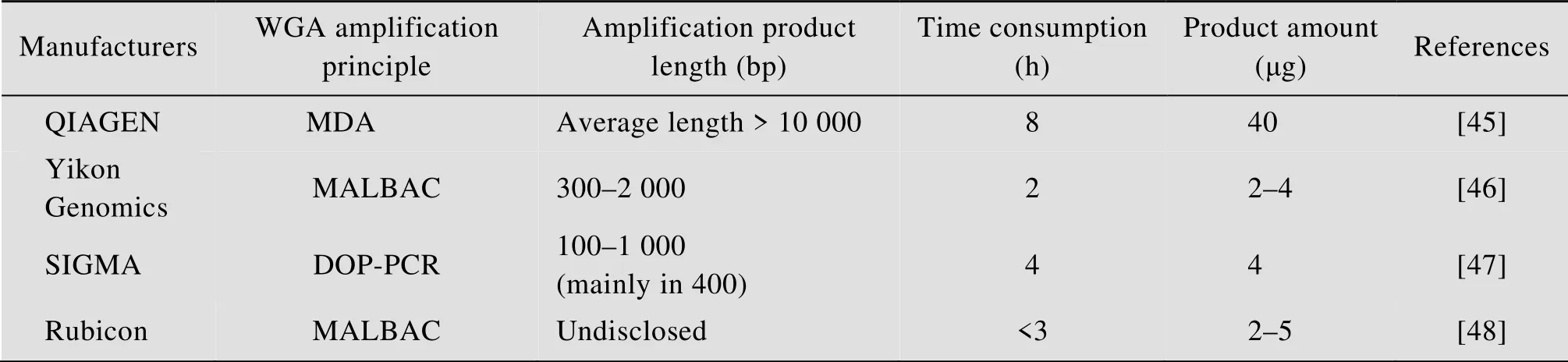
表1 4种单细胞全基因组扩增试剂盒比较Table 1 Comparison of 4 single cell whole genome amplification kits
2.2 单细胞RNA分析
单细胞RNA测序是研究细胞发育过程中转录组异质性的一个有效方法[50],某些新的细胞类型的发现就得益于单细胞RNA测序,单细胞RNA测序也为了解调控网络提供了深刻见解[51]。
2017年,10X Genomics公司开发出一个基于液滴技术的单细胞捕获系统。该技术的核心是乳液中的凝胶珠 (Gel bead in emulsion,GEM),凝胶珠由Illumina测序接头、引物、10× barcodes、分子标签 (Unique molecular identifiers,UMI) 和oligo-dT组成。凝胶珠在微流体芯片的通道中与单细胞结合,逆转录发生在每一个凝胶珠,带有条形码的cDNA大量扩增,构成cDNA库。其采用的微流控芯片有8个通道,一次可以同时处理8个样品,每个通道每6 min可以产生约100 000个凝胶珠,加入芯片的细胞约50%能被捕获[52]。目前,该技术已被用于免疫、肿瘤等方面的研究并取得相关进展,如CD8+T细胞的表观遗传学分析[53]、通过研究卡介苗对造血干细胞的作用为疫苗研发提供了新思路[54]、人脑胶质瘤的单细胞分析为其治疗提供了新策略[55]等。
除此之外,Shiroguchi等开发了一种数字RNA测序技术,通过加入过量的barcodes序列,使几乎每个cDNA分子两端都带上不同的barcodes。PCR后,应用双末端深度测序可以读取两个barcodes和cDNA序列,大大降低了序列依赖性偏倚和扩增噪音[56]。MALBAC除了能用于单细胞全基因组扩增,还可用于单细胞转录组扩增,且扩增产物检测效率高、准确性和可重复性好[57]。
单细胞RNA测序非常适合解决中枢神经系统固有的复杂性和动态性问题,目前已被应用到大脑分子的分类研究,且有望应用于开发治疗神经退行性疾病的新疗法[58]。基于高通量测序的单细胞转录分析已经应用于数百项研究中,并取得了丰硕的成果,使具有挑战性的新生物发现成为可能[59]。
单细胞转录组分析方法的最新进展,已经使科学家认识到许多表面上均质的细胞具有令人惊讶的表达差异性。此外,非编码RNA (Noncoding RNA,ncRNA) 被认为是基因调控过程的关键元件,其在单细胞内的表达模式可能有助于剖析单细胞变异的生物学功能。测量单个细胞中的ncRNA对于研究细胞类型和单细胞功能具有重要意义[60]。
2.3 单细胞蛋白质分析
显然,单细胞基因组和转录组只是它的一部分,单细胞的大多数功能是由其蛋白质组决定的。目前蛋白质组分析方法有蛋白质芯片[61]、流式细胞仪分析[62]、免疫共沉淀[63]、质谱分析[64]等,这些方法揭示了样品中蛋白质的性质。自从单细胞研究兴起后,研究人员对单细胞蛋白质也进行了不少研究。早在2009年,激光烧蚀电喷雾电离质谱就被用于单细胞原位代谢组学分析[65]。曾有研究人员采用同位素标记和质谱分析相结合的方法对造血系统的单细胞中34种物质进行分析,有助于尽早发现细胞病变,研发出针对性治疗药物[78]。基于单细胞蛋白质组学,对肿瘤细胞和正常细胞信号网络的研究能为癌症诊断和确定患者预后提供生物标记物[66]。
虽然已有许多研究者对单细胞蛋白、代谢进行了相关研究,但这些研究并不是真正意义上对单颗细胞内蛋白质的研究。无论是质谱、同位素标记、还是流式细胞分析,都只是单细胞层面的蛋白质分析,他们并没有将单颗细胞内的蛋白质释放出来,并进行放大用于研究。这是由于单细胞内蛋白质和代谢物含量极低、分离困难,目前还没有与核酸类似的蛋白质和代谢物的扩增方法[67],对单细胞蛋白质的研究仍存在许多技术难点。测序技术已广泛应用于单细胞DNA和RNA分析,但基于测序的单细胞蛋白质组学研究方法尚未见报道[68]。
2.4 单细胞表观遗传学
表观基因组学的研究对象,主要是基因组DNA序列的修饰构象,并将其与表观遗传记忆、细胞识别和具有组织特异性的生物学功能联系起来[85]。对于差异很小的细胞种群、罕见的细胞类型以及来源于组织的难以区分的不同细胞混合物,乃至于看似极具有同源性的细胞种群,都会在表观遗传、转录水平和表型上呈现出极大的差异。单细胞表观基因组学的研究,有望解决传统的对群体细胞进行研究的技术缺陷,并为涉及发育、细胞异质性等重要领域的表观遗传学研究开辟新的方向[69]。
单细胞表观基因组学的研究方法有:单细胞DNA甲基化分析、单细胞染色质映射、单细胞Hi-C、单细胞复制动力学等[69]。
单细胞表观基因组学的研究方法可以识别染色质的状态是开放或是关闭,包括核小体定位,由此可以推断某些转录因子是否结合在个别细胞内特定的DNA序列[70]。随着单细胞表观遗传学的不断发展,如今,我们可以在单个细胞分辨率上来研究大多数表观遗传调控机制。单细胞表观基因组学填补了表观遗传学发展过程中,传统显微镜检查与现代基因组学之间的历史鸿沟,有望成为表观遗传学和基因组调控研究的重要工具[69]。
2.5 循环肿瘤单细胞分析
循环肿瘤细胞 (Circulating tumor cell,CTC)源自原发性肿瘤或者转移性病变,蕴含有与肿瘤进展和癌症治疗相关分子特征等重要信息[71],因此对CTC的分析具有重大的临床意义。
CTC的单细胞分子分析已经产生了一系列意料之外的发现,例如癌细胞群体的异质性,肿瘤对化学疗法产生抗性的原因,以及肿瘤转移的机制[72]。目前高通量测序技术、微流体技术等技术已被用于CTC单细胞研究。通过研究CTC所揭示的肿瘤细胞异质性,对于理解和预测各种实体瘤治疗过程中耐药性的发展,以及为癌症的有效治疗制定适当的策略,具有重要的临床意义[73]。
2.6 单细胞分析研究成果
近年来,研究者对单细胞的不断深入研究已取得累累硕果。胶质母细胞瘤是一种致命的脑瘤,科学家发现,虽然靶向mTORC1/C2的CC214-2抑制剂抑制mTOR信号,但癌细胞迅速激活其他信号以促进耐药性[74]。单细胞磷酸化蛋白质组学绘制了单个肿瘤细胞中的信号网络,使研究者发现了癌细胞生长的其他路径,有助于开发更有效的胶质母细胞瘤联合疗法[74];Navin利用单细胞全基因组测序分析了96例肝癌细胞和15例正常肝细胞,证实了拷贝数变异发生在肝癌早期,但在肝癌发展过程中保持相对稳定,并发现znf717基因是肝细胞癌的一个潜在驱动基因,这些发现揭示了肝细胞癌中多个不同的肿瘤进化机制,为肿瘤治疗策略的制定提供了帮助[75-76]。单细胞RNA测序发现了新型免疫细胞,为研究免疫反应提供了另一种途径。根据RNA测序数据,科学家开发了一种新的算法来重建配对的T细胞受体 (TCR) 序列,并将T细胞特异性与功能性反应相关联[77];通过对648个单细胞进行单细胞RNA测序的分析,应用t-SNE细胞分型、SCDE基因差异表达分析,科学家们发现了新的免疫细胞CD62L+ILC3[78]。最近的进展,如大规模并行单细胞RNA-Seq和复杂的计算方法,正在催化我们对免疫学理解的一场革命。近年来大规模的单细胞RNA测序使研究者对免疫学有了更加深刻的理解,例如单细胞技术有望用于解读免疫系统的适应性和固有成分[79]。单细胞RNA测序被用于分类成年小鼠视皮层的皮质细胞,确定了49种细胞转录组类型,包括23种GABAergic、19种glutamatergic和7种非神经型,揭示细胞类型的多样性[80]。基于MALBAC技术开发的产前诊断新方法,以及在它的基础上开发的胚胎植入前基因组筛查技术——MARSALA (Mutated allele revealed by sequencing with aneuploidy and linkage analyses),可以同时检测单基因疾病和非整倍体,并且能够以经济有效的方式进行连锁分析,这可使父母免于将他们的遗传病传递给后代[81-82]。
2.7 单细胞研究优势和局限
单细胞研究的主要优势体现在疾病分析方面,多细胞分析可能会掩盖了群体中细胞特征的真实变异。以单细胞作为疾病分析的生物学单位,可以更准确地记录细胞反应的个体和范围,其价值逐渐得到认可。单细胞研究可以鉴定肿瘤内罕见的基因突变,更好地了解信号传导和代谢途径,制定最佳治疗方案以防止肿瘤再生[83]。
单细胞科学试图测量跨细胞群体的生物异质性,以提供对整体生物学状态或疾病状态的定量描述。例如单细胞转录组学可以提供关于细胞之间的生物变异信息[83]。在单细胞研究的数据分析方面,虽然许多方法已成功用于分析大量样本的基因组数据,但对于相对较短的测序读长,数据的稀疏结构以及细胞群异质性对有效的数据分析提出了重大的挑战[84]。
3 本实验室工作内容和经验
在“国家自然科学基金”等项目的资助下,本团队对单细胞操作和分析已有一定研究基础,并在实践解决问题的过程中积累了一定经验。
本团队近期的主要研究课题之一是CRISPR基因编辑技术。众所周知,在CRISPR编辑基因组时有可能发生脱靶效应,同时在编辑之后,靶细胞会启动DNA的损伤修复机制,在修复的过程中可能会导致一些意料之外的碱基的插入或缺失,这一现象具有潜在的副作用,比如可能会引发肿瘤相关基因的过表达或抑制,进而限制了CRISPR技术的临床应用安全性。而此前在CRISPR基因编辑副作用方面的研究,主要以细胞群体 (多细胞) 为主[85-87],本实验室尝试将CRISPR基因编辑技术与单细胞研究相结合,在单细胞水平上检验CRISPR基因编辑技术对细胞的影响,争取打破多细胞研究的局限。
例如,在单细胞挑取方面,本课题组结合各种单细胞分离方法的优缺点,为了达到最好的精确度,采用的单细胞分离方法为人工显微移液法。经过不断的实验以及条件优化,我们总结出用1 mL培养基重悬约500个单细胞,并均匀铺于10 cm细胞培养皿中,此时的细胞密度在显微镜下挑取单细胞较为适合,容易在显微镜下找到单个细胞,并且不易吸到多个细胞。
本团队在单细胞基因组扩增方面,曾尝试使用基于phi29 DNA 聚合酶的多种单细胞DNA扩增技术和基于PCR的单细胞扩增技术,使用phi29技术时,本团队已经能够从单个细胞中扩增获得长度大于21 kb的单细胞基因组,对扩增所得基因组进行高通量测序并进行数据分析后发现,基于phi29 DNA聚合酶的单细胞扩增试剂盒扩增单细胞基因组所产生的偏倚和误差非常严重,基因组的部分区域大量扩增,而某些区域则几乎没有扩增,在SNP分析中,也许可以通过扩大测序数据量来解决问题,而在CNVs等分析中就显得无能为力,但是phi29方法的最大好处在于能够得到大于21 kb的基因组序列,非常适于分析SV。基于PCR技术的单细胞扩增,可以解决上述扩增覆盖率不均匀的问题,但是缺点在于扩增片段长度很短。此外,本团队还将开展CRISPR编辑后的单细胞RNA转录组和蛋白质组分析。相关研究对于验证CRISPR基因编辑技术的副作用有重要意义。
4 展望
单细胞的分离技术,从最初的显微移液法到激光捕获显微切割,一直到近年来最先进的微流体技术,朝着自动化和高通量以及高精度的方向发展,这一切都离不开材料科学、纳米科学、自动化技术的进步。但是,现有的单细胞分离技术,基本上都局限在体外培养的细胞系,随着科学研究的深入,能否开发出直接从活体组织,尤其是实体组织里分离单细胞的技术?毕竟,体内状态下的细胞和体外的细胞有着非常大的区别,只有对体内的细胞进行研究,才是反映最真实的自然状态,才能帮助我们理解最真实的生命过程。另外,体内条件下获得的单细胞,常常在生物医学上有重要用途,比如用于肿瘤标记物的研究、肿瘤干细胞研究、免疫治疗研究、再生医学研究等等。但是,这就有很多工程技术上的问题需要克服,首先是活体、尤其是实体组织如何取材?如何把组织分散为单个的细胞?当然,血液等流体会相对容易。其次,活体的细胞,无论在细胞形状、大小、细胞活性、状态,都与体外的细胞系有很大的区别,活体细胞常常是高度分化的,一块组织中可能有多种不同类型的细胞,把细胞分类就是一个很大的难题,此外不同细胞内各种物质的含量常常具有重大差异,即便分离出活体单细胞,后续分析能否胜任极度微量的物质的分析?另外,有些细胞种群是非常稀有罕见的,如何在活体里提取、分拣和富集这些稀有的细胞,难度也非常大。此外,活体的某些类型单细胞,在组织解离分散、流体分拣挑选等过程,在各种不同的物理和化学环境中能否保持存活状态?随着高精度手术机器人、纳米机器、磁珠分离、人工智能和机器学习等技术的兴起,也许单细胞的分离技术能够更加先进、更加智能,例如可以根据研究目的和需求,可以更加有选择性、目的性和高精度,比如优选地挑取有特殊形状、特殊状态、特殊颜色的细胞,或者根据所检测到的细胞状态和类型,将细胞分配到不同的物理和化学条件下进行分拣,比如自动选择不同的pH和不同渗透压的缓冲液,以及选择不同流体剪切力和不同孔径大小的流体腔室,以保证单细胞分离的成功,减少人工的干预和误判,这应是将来的发展方向之一。
在单细胞内物质分析层面,本文从DNA、RNA、蛋白质逐一进行了介绍。随着新一代测序技术的崛起,目前对于单细胞DNA和RNA的分析已经趋于成熟。但是仍有可以发展的空间。例如,现有的单细胞DNA分析,所涉及到的单细胞DNA扩增技术,难免会造成扩增后的产物和原始的DNA存在偏倚,因此,目前也有很多科学家在开发具有高保真、能忠实还原原始DNA信息的单细胞DNA扩增技术,目前最先进的高通量单细胞分离 (微流体技术),还只能用于RNA分析,而对单细胞DNA分析不兼容。这就限制了单细胞DNA分析的通量和成本。在单细胞RNA分析领域,缺少能对单细胞总RNA直接进行大量扩增的技术,因此,对于一些微量或半衰期极短的RNA分子,现有的分析技术的灵敏度可能无法企及,而且RNA的种类众多,例如长的非编码RNA、mRNA、环状RNA、miRNA、piRNA、rRNA、tRNA等等,现有的单细胞RNA分析技术,绝无能力把不同类型的RNA进行纯化和分类,而不同类型的RNA,其分析和测序方法也不同,因此,在单细胞RNA分析层面,还有很多技术需要深入发展,事实上,现有的单细胞RNA测序,也仅仅只能分析mRNA等少数几种类型的RNA。另外,现有的单细胞DNA和RNA分析技术,很大程度上依赖于Illumina的测序技术,但是它的读长一般都只有几百个bp,比较短。在DNA层面,若要发现SV和CNV和融合基因;在RNA层面,若要发现可变剪接,较长读长的测序技术显然更有优势,但是,目前尚未见成熟的、能和较长读长测序技术兼容的单细胞DNA和RNA分析技术。在蛋白质分析方面,现有的研究报道少之又少,单细胞层面的蛋白质质谱、蛋白质测序,甚至蛋白质结构分析、单细胞蛋白质组学分析,对工程技术的要求比其他任何生物分析都高,蛋白是生命的基础,其种类和数量众多,但在目前的技术背景下,对单细胞蛋白进行定性和定量分析,仍是无法逾越的。
此外,在单细胞内还存在各种糖类、脂类物质,它们对细胞的各种生物学行为也有重大调控作用,另外,不同的单细胞相互之间存在通讯交流的现象,这也是单细胞研究需要关注的内容。另外,近年来单分子的研究发展也非常迅速,比如单分子荧光[88]、单分子成像[89]等,将单分子技术结合单细胞研究技术也是未来的发展方向之一。实时成像可以对动态的细胞生命过程进行可视化和分析,例如单细胞成像有助于研究胚胎发育过程中调节细胞命运和形态发生的过程,神经元回路和非神经元细胞类型对神经功能的贡献,基于成像的新方法还能以高时空分辨率解析神经疾病和癌症[90]。除此之外,单细胞研究在原位转录组分析、实时成像转录组分析、谱系示踪技术、单细胞多组学、细胞状态分布建模与预测、细胞功能验证、疾病研究、跨学科研究等方面[73],具有较好的发展前景和空间。
5 结语
DNA、RNA、蛋白质是构成细胞的基础物质,细胞又是构成生命的基本单元。细胞存在分化和异质性,细胞和细胞之间的差异造成了不同的生命功能和生物学现象。只有深入研究单细胞,把传统的在组织学、多细胞层面的研究深入到单细胞层面,才能更好地了解生命,揭示分子机制。无论在生命科学基础理论研究,还是在生物医学应用研究,或是生物工程学研究,单细胞研究必定是未来的重点研究方向之一。
随着单细胞分析技术的不断发展和成熟,单细胞分析也将在各种疾病中得到广泛应用。在肿瘤治疗方面,单细胞全基因组测序对寻找突变位点、研究肿瘤的进化机制意义重大。而对单细胞蛋白质的分析,能够研究正常和病变细胞的信号通路,揭示癌症的发生发展机制,为肿瘤的治疗提供全新的思路。在免疫系统研究方面,单细胞研究有助于发现新的免疫细胞,通过对免疫细胞信号通路的研究,能为疫苗的研制与开发提供深刻见解。在生殖健康方面,单细胞全基因组测序能够检测出碱基片段缺失或增添,有助于避免遗传疾病。虽然,单细胞分析技术有着众多优势,但其发展和成熟之路却将漫长而艰难。

