孜然精油抑菌机制
甘芝霖,倪元颖
(1.北京林业大学生物科学与技术学院食品科学与工程系,北京 100083;2.中国农业大学食品科学与营养工程学院,北京 100083)
植物精油具有较强的抑制或杀死微生物的特性[1-3],尤其以生姜、八角茴香等为代表的香辛料类精油可以作为天然防腐剂应用于食品加工过程中微生物污染的控制[4-5]。
孜然(CuminumcyminumL.)又名安息茴香或孜然芹,芳香气味浓烈、口感独特,是一种常见的香辛料和调味品,同时也是一种药食同源植物[6],其精油具有抗氧化等功效作用[7]。近年来,国内外对孜然精油(cumin essential oil,CEO)的抑菌活性也有一些报道,研究结果表明,孜然精油对细菌、霉菌、酵母菌均有一定的抑制作用[8-10]。但是,大多数研究只停留在定性分析方面,缺乏理论深度。有关孜然精油对微生物生长曲线、杀菌曲线的影响鲜有报道,其抑菌机制尚不清楚,需要更深入的研究和探讨。
本文以大肠杆菌等8种细菌作为供试菌种,首先通过牛津杯实验、最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定筛选出孜然精油抑制作用最强的两种细菌,然后绘制生长曲线和杀菌曲线,进一步探究其抑菌活性,最后通过细胞膜相对电导率的测定、透射电镜和扫描电镜对菌体形态变化进行观察,探讨其抑菌作用机理,为孜然精油在食品防腐中的应用提供理论依据和参考。
1 材料与方法
1.1 材料与仪器
孜然(21-6新孜2号) 产自新疆和田地区,由新疆农科院提供,贮藏于4 ℃冷库中;金黄色葡萄球菌(Staphylococcusaureus,ATCC6538)、福氏志贺氏菌(Shigellaflexneri,ATCC12022)、肺炎克雷伯氏菌(Klebsiellapneumoniae,ATCC13883)、肺炎链球菌(Streptococcuspneumoniae,ATCC49619)、肠炎沙门菌(Salmonellaenteritidis,ATCC13076)、枯草芽孢杆菌(Bacillussubtilis,ATCC6633)、单增李斯特(Listeriamonocytogenes,ATCC19115)、大肠杆菌(Escherichiacoli,ATCC25922) 上海瑞楚生物科技有限公司;丙酮分析纯 北京化工厂;葡萄糖 国药集团化学试剂有限公司;营养琼脂培养基(LB)、水解酪蛋白肉汤培养基(MHB)、脑心浸出液培养基(BHI) 北京奥博星生物技术责任有限公司。
DL-CJ-1F型试验医用型洁净工作台 哈尔滨市东联电子技术开发有限公司;BS223S型电子天平 德国Sartorious公司;ZYpureEDlc-100-UP型超纯水机 北京中扬永康环保科技有限公司;YX0602型自动蒸汽灭菌机 山东新华机械股份有限公司;DHP-9082型电热恒温培养箱 上海一恒科技有限公司;T6型新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;DW-HL388型86 ℃立式超低温冷冻储存箱 中科美菱低温科技有限责任公司;EC215电导率仪 美国Hanna公司;TGL-16M型高速台式冷冻离心机 湖南省湘仪集团;FEI Quanta 200型扫描电镜 捷克FEI公司;H-7650B型透射电镜 日本日立公司。
1.2 实验方法
1.2.1 孜然精油的制备 首先采用超临界二氧化碳萃取法得到孜然油树脂(深棕色粘稠状液体,得率13.56%)[11],然后利用分子蒸馏技术对其进行纯化,制备得到孜然精油(金黄色液体,流动性良好,得率25.97%)[12]。用80%的丙酮溶液配制200 μg/mL的孜然精油母液,在4 ℃条件下避光储存待用。
1.2.2 培养基配制和菌液制备 各种供试菌株分别用合适的培养基进行活化和培养。分别称取LB、MHB和BHI三种培养基粉末32、24和49 g,加入1000 mL蒸馏水中,加热煮沸溶解,分装后于121 ℃高压灭菌15 min备用。
金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、志贺氏菌于37 ℃下,在LB培养基中培养24 h,然后转接到MHB培养基于37 ℃下培养24 h,进行二次活化。最后,按照1%的比例(v/v)将上述菌液加入到新的MHB培养基中进行培养,采用活菌计数法测定菌数,使菌液浓度达到107CFU/mL。
沙门氏菌、肺炎链球菌、肺炎克雷伯菌、李斯特菌于37 ℃下,在BHI培养基中培养24 h,然后转接到MHB培养基于37 ℃下培养24 h,进行二次活化。最后,按照1%的比例(v/v)将上述菌液加入到新的MHB培养基中进行培养,采用活菌计数法测定菌数,使菌液浓度达到107CFU/mL。
以上菌株均在摇床中以100 r/min的转速下进行培养。
1.2.3 牛津杯法测定抑菌谱 参考文献[13]方法略作修改,按照菌种配制相应的固体培养基,高温高压灭菌后以每个大约10 mL的体积倒入平板中,培养基凝固后,加入50 μL菌悬液,然后用涂布棒轻轻涂匀,放置10 min后,用镊子(无菌)夹取高压蒸汽消毒且被烘干的牛津杯(内径6 mm,外径7.8 mm,高10 mm),轻轻放置于已经涂布菌液的培养基上,小心加压,使其尽量与培养基之间无空隙,每个培养皿内放置三个牛津杯作为平行,分别在不同的牛津杯内缓慢加入50 μL样品液,其中孜然精油的浓度为0.1 mg/mL,以无菌蒸馏水和丙酮分别为空白对照和溶剂对照。然后将培养皿小心放入4 ℃冰箱中,待样品液扩散12 h后,将平板倒置放入37 ℃培养箱中,培养24 h后,用游标卡尺测量透明抑菌圈的直径大小。在该实验中,抑菌圈直径越大,代表药物的抑菌能力越强。
1.2.4 最小抑菌浓度(MIC)与最小杀菌浓度(MBC)的测定 MIC的测定根据文献[14]中的液体试管二倍稀释法略作修改。取8支无菌试管,从1~8进行标号,1~6号为样品管,7号管为溶剂对照,8号管用无菌蒸馏水作空白对照。1~6号每管加入1 mL无菌培养液,然后向1号管中加入1 mL浓度为200 μg/mL的孜然精油溶液,混匀后,吸取1 mL加入到2号管中,按照上述步骤依次稀释,到6号管时,从其中吸取1 mL弃掉。7号管中加入1 mL 80%丙酮溶液,8号管中加入1 mL无菌水。接着,每管统一加入1 mL浓度为107CFU/mL处于对数生长期的菌液,摇匀后加上灭过菌的硅胶塞,在37 ℃培养箱中培养24 h。培养过后用肉眼观察各个试管,试管中培养液澄清的浓度即为最小抑制浓度(MIC)。然后分别取100 μL MIC(包括MIC)以上的浓度的试管内培养液,接种LB固体培养基上,在37 ℃培养箱中培养24 h,观察平板,没有菌落生长的最低浓度即为受试菌种的最小杀菌浓度(MBC),选出孜然精油抑制作用最强的两种细菌。
1.2.5 对微生物生长曲线抑制作用 孜然精油对大肠杆菌和志贺氏菌的生长曲线抑制作用的测定方法按照文献[15]略作修改,具体如下:将以上两种供试细菌培养至对数期,以2%的接种比例(v/v)加入到新的MHB培养基中,根据1.2.4实验结果中孜然精油对大肠杆菌和志贺氏菌的MIC值设置浓度,以不加精油组作为对照组。在37 ℃下,以100 r/min在振荡摇床中培养24 h,每隔2 h,取一定量的菌液用分光光度计测定其吸光值(OD),波长为600 nm。然后以培养时间(h)为横坐标,OD值为纵坐标,绘制孜然精油对大肠杆菌和志贺氏菌抑制作用的生长曲线。
1.2.6 活菌计数法测定时间-杀菌曲线 孜然精油对大肠杆菌和志贺氏菌的时间-抑菌曲线的测定方法按照文献方法略作修改[16],具体如下:将以上两种供试细菌培养至对数期(培养时间均为10 h),取一定量菌液接种于MHB培养基之中使其浓度达到108CFU/mL。根据1.2.4确定的孜然精油的MIC值,配制二者浓度分别为MIC、2×MIC的培养基,在37 ℃下、100 r/min振荡摇床中培养24 h,分别在0、2、4、6、8、12、16、20、24 h处取1 mL菌液进行梯度稀释,用LB培养基进行计数,以不加精油组作为对照组。然后以培养时间(h)为横坐标,各时间点测得的平均菌落数的对数值为纵坐标,绘制时间-杀菌曲线。
1.2.7 细胞膜渗透性测定 参照文献[15]中的方法研究孜然精油对微生物细胞膜渗透性的影响,以相对电导率为指标进行测定。按照1.2.5绘制的生长曲线,将培养至对数期的大肠杆菌、志贺氏菌菌液在4 ℃下,10000 r/min下离心10 min,弃掉上清液,收集菌体,然后用5%的葡萄糖溶液对菌体进行反复清洗,直到其电导率接近5%的葡萄糖溶液,由此获得等渗细胞。根据1.2.4所得孜然精油的MIC值,加入到50 mL 5%的葡萄糖溶液中,测定其电导率并记为L1。将加入两种药物的等渗细胞溶液,在37 ℃下培养6 h,每隔1 h测定其电导率记为L2。等渗细胞溶液在沸水中加热5 min作为对照,记为L0。通过公式(1)计算相对电导率,并绘制时间-相对电导率变化曲线。
相对电导率(%)=(L2-L1)×100/L0
式(1)
1.2.8 扫描电子显微镜(SEM)观察 以1.2.5所述方法加入孜然精油对大肠杆菌、志贺氏菌进行处理,分别于4 ℃、10000 r/min下离心10 min,弃去上清液后收集菌体。首先用含有3%戊二醛的0.1 mol/L PBS缓冲液(pH约7.2)在室温下固定5 h。然后用PBS缓冲液对其洗涤3次,再用含有1%的四氧化锇的PBS缓冲液在室温下固定1 h。然后用25%、50%、75%和100%的乙醇,依次按照顺序各脱水一次,每次约10 min。然后用50%、70%、90%和100%的乙酸异戊酯逐级取代乙醇,每级置换约3 min。临界点干燥之后将样品用双面导电胶粘贴在样品台上,离子溅射喷金,厚度约1 μm。处理后的样品可在加速电压12 kV下观察,选择典型视野采集图像。
1.2.9 透射电子显微镜(TEM)观察 以1.2.5所述方法对大肠杆菌、志贺氏菌进行加药处理,分别于4 ℃、10000 r/min离心10 min,弃去上清液后收集菌体。首先用含有3%戊二醛的0.1 mol/L PBS缓冲液(pH约7.2)在室温下固定5 h。然后用PBS缓冲液(同上)对其洗涤3次,在用含有1%的四氧化锇的PBS缓冲液(同上)在室温下固定1 h。接着,用30%、40%、50%、60%、70%、80%、90%的乙醇依次按照顺序各脱水一次,每次约20 min,然后再用无水丙酮脱水3次,每次30 min。将脱水后的样品嵌入到环氧树脂812中于45 ℃处理24 h,然后聚合到斯珀尔树脂中(含有1.5%硬化剂DMP-30的环氧树脂812)于65 ℃处理72 h。用超波切片机将以上样品切成约50 nm的薄片,1%磷钨酸染色后,在透射电镜下观察并采集图片。
1.3 数据处理
所有试验均做三次重复,用SPSS 22.0软件对数据进行方差分析,用Origin 8.6软件对数据进行拟合并绘图。
2 结果与分析
2.1 孜然精油抑菌作用定性分析
由表1可得,溶剂对照和空白对照组在所有供试菌种的培养基上均没有抑菌圈的出现,说明丙酮对供试菌种并没有抑制作用,因此丙酮在本实验中可以被当做样品溶剂使用。8种细菌中,孜然精油的抑菌圈从大到小依次为志贺氏菌>大肠杆菌>枯草芽孢杆菌>金黄色葡萄球菌>沙门氏菌>肺炎链球菌>肺炎克雷伯菌>李斯特菌。抑菌圈<13 mm为低度抑菌,13~19 mm为中度抑菌,>19 mm为高度抑菌[17],可以判断,孜然精油对大肠杆菌和志贺氏菌这两种革兰氏阴性菌具有高度抑制作用,对枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌具有中度抑制作用,而对肺炎链球菌、肺炎克雷伯菌和李斯特菌表现出低度抑制作用。与以往研究相比较[18-19]孜然精油抑菌圈测量结果对比,可以发现由于产地、品种以及提取方式的不同,孜然精油对同一个菌株产生的抑菌圈大小不相同,即表现出的抑菌作用不同。

表1 孜然精油抑菌活性定性试验结果Table 1 Qualitative test results of the antimicrobial activity of CEO
孜然精油对供试菌种的MIC和MBC如表1所示。8种细菌中,孜然精油对大肠杆菌和志贺氏菌的抑制作用最强(MIC均为25 μg/mL,MBC均为50 μg/mL)。李大强[20]研究得出,孜然精油对大肠杆菌和金黄色葡萄球菌的MIC分别为123和246 mg/mL,均高于本实验的结果;而在Oroojalian等[21]的研究中,孜然精油对大肠杆菌和金黄色葡萄球菌的MIC分别为3和0.75 mg/mL,与本实验的结果同样存在差异,这进一步说明了孜然精油受产地、种类、提取方式的影响,其抑菌活性等功能性质亦有所不同。
以上实验结果表明,孜然精油对革兰氏阴性菌(大肠杆菌和志贺氏菌)作用明显强于其他供试菌株,因此,在后续实验中选取大肠杆菌、志贺氏菌进行深入研究。
2.2 对微生物生长曲线抑制作用
孜然精油对大肠杆菌和福氏志贺氏菌的生长曲线抑制作用如图1所示,两种菌的正常生长曲线均在8~10 h开始进入稳定期。相比于溶剂对照组变化明显,MIC组的OD值基本趋于0呈一条直线,说明孜然精油可以有效抑制大肠杆菌和福氏志贺氏菌的繁殖。

图1 孜然精油对大肠杆菌和福氏志贺氏菌的生长曲线抑制作用Fig.1 Inhibitory effect of CEO on the growth curve of E. coli and S.flexneri
2.3 活菌计数法测定时间-杀菌曲线
通过活菌计数法测定孜然精油对大肠杆菌、福氏志贺氏菌的时间-杀菌曲线如图2所示。溶剂对照组的大肠杆菌和福氏志贺氏菌在培养了12 h后,其从各自初始对数值分别上升了4.22和2.33;以MIC剂量的孜然精油作用于大肠杆菌24 h后,其对数值相比于初始值上升了1.43,虽然不能完全抑制其生长,但在一定程度上延长了其延滞期。2×MIC的孜然精油作用于大肠杆菌24 h后,其对数值下降了0.96。而当两个剂量的孜然精油作用于福氏志贺氏菌24 h后,活菌数量均有所下降,分别下降了0.36和0.42个对数值。以上结果还说明孜然精油的抑菌性存在剂量-作用依赖关系。

图2 孜然精油对大肠杆菌、福氏志贺氏菌的时间-杀菌曲线Fig.2 Time-kill curves showing the Inhibitory effect of CEO on the growth curve of E. coli,S. flexneri
由图2还可以看出,两种细菌的快速增殖期在0~14 h左右,孜然精油在此时间段内可以有效抑制微生物的生长。刁文睿[22]、陶翠等[23]和Yakob[24]的研究显示,公丁香精油、油樟叶挥发油和罗勒精油对细菌的抑制作用在0~12 h之内,与本实验结果相似。
2.4 细胞膜电导率的测定
电导率的测定可以判断细胞膜通透性改变的情况。孜然精油以MIC剂量作用于两种供试菌后,其相对电导率如图3所示。与各自溶剂对照组相比,MIC剂量组的相对电导率都有了明显提升,其中对福氏志贺氏菌影响相对较大,作用时间4 h后可以提高13%以上。实验结果表明两种供试菌受到精油作用后,细胞膜通透性发生变化,有可能导致细胞内组分泄露,进而导致微生物死亡、生长被抑制。有关报道显示[25-27],肉桂、八角茴香等植物精油作用于细菌后,微生物的电导率都有明显上升,说明微生物细胞膜通透性发生改变,进而导致一些蛋白质、糖类、金属离子和小分子物质等被释放出来,使得微生物生长受阻,与本文的研究结果相似。
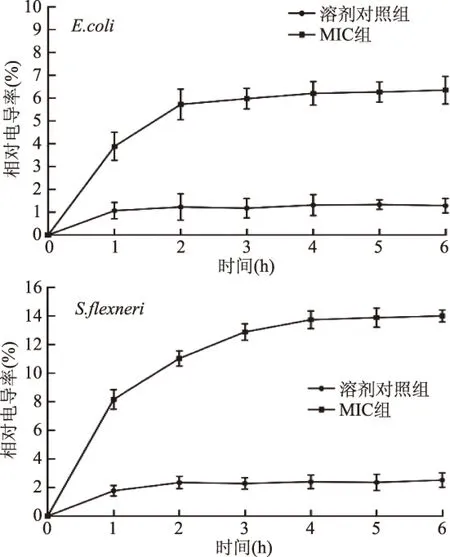
图3 大肠杆菌、福氏志贺氏菌生长过程中受到孜然精油作用的相对电导率Fig.3 Relative electrical conductivity of growth matrix of E.coli,S.flexneri with CEO
2.5 扫描电子显微镜结果
如图4A和图4B,大肠杆菌在精油组和对照组中的形态有明显的差异。溶剂对照组中的大肠杆菌细胞结构完整,呈饱满的长杆状,表面光滑。精油处理后,部分菌体的形态发生改变,皱缩呈不规则形状,而且可以看到部分菌体被裂解成聚合在一起的丝状或片状溶解物,说明细胞膜被破坏,导致细胞被裂解死亡。

图4 大肠杆菌(A、B)和福氏志贺氏菌(C、D)的SEM图(3000×)Fig.4 SEM images of E. coli(A and B)and S. flexneri(Cand D)(3000×)
如图4C和图4D,与大肠杆菌的SEM结果相似,溶剂对照组的菌体结构完整,呈饱满的短杆状,表面光滑。精油处理后,菌体发生皱缩,部分菌体被裂解成碎片。说明孜然精油同样破坏了福氏志贺氏菌的细胞膜,细胞内部组分泄露,导致细胞死亡。
本文的结果存在多个文献支持,实验药物抑菌作用也是通过改变微生物细胞膜的通透性、破坏细胞壁,导致细胞裂解死亡。在Gao等[28]的研究中,迷果芹种子精油对大肠杆菌有一定的抑制作用,起作用的产生也是细胞膜通透性发生了明显变化,通过扫描电镜发现大肠杆菌的形态出现褶皱的现象,表面变得粗糙,并伴随有细胞碎片的产生。
2.6 透射电子显微镜结果
如图5A和图5B,大肠杆菌在精油组和溶剂对照组中的形态有明显的差异。溶剂对照组中的大肠杆菌呈圆形,细胞壁和细胞膜结构完整,胞壁和胞质结合紧密,细胞质密度均匀。精油处理后,部分菌体的形态发生改变,呈不规则形状,部分细胞的细胞壁遭到破坏,细胞质聚合溶解,使细胞内部出现空腔。

图5 大肠杆菌(A和B)和福氏志贺氏菌(C和D)TEM图(6000×)Fig.5 TEM images of E. coli(A and B)and S. flexneri(C and D)(6000×)
如图5C和图5D,和大肠杆菌结果相似,福氏志贺氏菌在精油组和溶剂对照组中的形态有明显的差异。溶剂对照组中的福氏志贺氏菌呈椭圆形,细胞壁和细胞膜结构完整,胞壁和胞质结合紧密,细胞质密度均匀。精油处理后,菌体形态发生改变,收缩呈不规则形状,部分细胞的细胞壁遭到破坏,细胞质聚合溶解,使细胞内部出现空腔,并有细胞溶解现象出现。
Diao等[16]发现,公丁香精油作用于大肠杆菌和金黄色葡萄球菌之后,TEM观察下,细胞结构模糊,菌体内胞质萎缩固化、出现空洞。黄德峰[29]研究发现,菊科中草药植物精油作用于金黄色葡萄球菌、大肠杆菌、伤寒杆菌、痢疾杆菌等之后,TEM观察下,菌体形态发生变化、细胞壁膜发生皱缩、破损、胞内内容物溢出,细胞器模糊不清,胞内形成了大的空泡。
综上所述,孜然精油具有广谱抑菌性,对细菌有一定的抑制作用,在8个供试菌种,对大肠杆菌、福氏志贺氏菌的抑制效果相对较好。抑菌作用的机理都是通过改变细胞膜的通透性,使得细胞形态发生变化,细胞内的组分泄露流出,导致细胞裂解死亡。与研究报道的孜然精油抑菌作用相比[10,19,31],本实验中的孜然精油对同一菌种的抑制能力,比如抑菌圈的大小、MIC和MBC等指标并不一致,这可能与孜然的产地和品种、精油的提取方式及供试菌株的来源及活力都有很大的关系。
3 结论
通过牛津杯实验对孜然精油的抑菌谱进行了测定。结果发现其对8种供试菌均有一定的抑制作用。对比不同菌株抑菌圈直径大小发现,孜然精油对大肠杆菌和志贺氏菌有较好的抑制作用。
最小抑制浓度(MIC)和最小杀菌浓度(MBC)评价实验中,孜然精油对大肠杆菌和福氏志贺氏菌的抑制作用最强(MIC均为25 μg/mL,MBC均为50 μg/mL),与牛津杯实验结果相吻合。
孜然精油能显著提高大肠杆菌、福氏志贺氏菌的相对电导率(p<0.05),通过改变细胞膜的渗透性对微生物起到抑制作用。其中,福氏志贺氏菌的相对电导率最高,达到13%以上。
扫描电镜和透射电镜下,发现孜然精油可以使菌体的形态发生改变,细胞普遍出现皱缩、不规则的凸起,甚至被裂解成碎片,部分细胞的细胞壁遭到破坏,细胞质聚合溶解,使细胞内部出现空腔,从而说明了其抑菌活性的机理是改变了细胞膜的通透性,使得菌体发生形态变化,细胞内物质泄漏,导致细胞死亡。

