黑灵芝多糖对免疫抑制小鼠肠道黏膜形态及肠道黏膜免疫的影响
赵明明,余 强,王 辉,向全丹,聂少平,谢明勇,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学生命科学学院,江西 南昌 330047)
肠道是将机体内部与外界环境分隔开的生物屏障,是机体消化吸收营养物质的主要场所,同时也是机体最大的免疫器官[1]。肠上皮是机体最大的黏膜表面,上皮细胞减少,肠绒毛变短,导致肠道黏膜面积减少,不利于营养物质的消化吸收[2]。肠道黏膜系统受损导致内部环境紊乱,不利于微生物定植,增加肠道疾病的风险。细胞因子分泌于免疫应答效应阶段,介导免疫应答、炎症反应并进行有效的调节,决定T、B细胞的分化[3]。肠道黏膜的免疫活性主要通过分泌细胞因子及其他途径发挥体液免疫及细胞免疫的功能。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)、白细胞介素(interlrukin,IL)-6、IL-10是几种重要的免疫调节相关细胞因子,TNF-α、IFN-γ主要由参与机体细胞免疫的T细胞亚群分泌,IL-6、IL-10主要由介导机体体液免疫的T细胞亚群分泌,通过检测不同细胞因子的分泌水平可间接衡量机体不同T细胞亚群的平衡状态[4-5]。严胜泽等[6]发现太子参多糖能显著提高免疫抑制小鼠小肠组织中IL-6含量。Xu Xiaofei等[7]通过建立体外模拟小肠模型,发现香菇多糖能显著促进TNF-α、IFN-γ的分泌。
灵芝作为一种药食两用资源,在中国、韩国、日本等国家已经有两千多年的使用历史[8]。黑灵芝又称玄芝,是灵芝中的极品,长期食用可调节机体多种机能,其中多糖被证明是灵芝的主要活性成分,而灵芝多糖的免疫调节活性被认为是多种药理学作用的基础。灵芝多糖通过活化胸腺、脾脏等免疫器官改善机体免疫力;通过促进脾淋巴细胞增殖、提高自然杀伤细胞活性,发挥免疫抑制肿瘤作用;通过提高腹腔巨噬细胞中环磷腺苷浓度引起蛋白激酶活化,增加蛋白激酶C的活性;通过提高三磷酸肌醇含量促进二酰基甘油的合成,激活巨噬细胞[9-10],诱导NO、活性氧及细胞因子的产生,进而增强先天免疫和适应性免疫。本实验室前期采集江西赣南地区人工栽培的黑灵芝,分离纯化其多糖组分,证明其具有抗氧化[11]、抗肿瘤[12]、心肌保护[13]、降血糖[14]等生物活性。前期研究发现,黑灵芝多糖可有效促进环磷酰胺诱导的免疫抑制小鼠T、B淋巴细胞增殖,提高机体血清IL-2、TNF-α分泌水平,通过体液免疫和细胞免疫功能发挥免疫调节作用[15-16]。但目前黑灵芝多糖对肠道黏膜免疫的损伤修复作用还鲜有相关研究,因此本实验以腹腔注射环磷酰胺构建免疫抑制小鼠模型,探究黑灵芝多糖对免疫抑制小鼠肠道黏膜免疫的调节作用,为进一步研究其可能机制提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
48 只SPF级BALB/c雌性小鼠,体质量18~22 g,周龄6~8 周,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。实验过程中所有动物实验严格遵守南昌大学动物管理条例,伦理委员会鉴定许可。实验垫料、饲料经过辐照杀菌处理,饮用水经高压灭菌处理,符合SPF级动物使用标准。
黑灵芝多糖由食品科学与技术国家重点实验室提取,原料采自江西赣州赣南灵芝基地,分离纯化得到的黑灵芝多糖的主要单糖组分为葡萄糖、半乳糖、甘露糖及半乳糖醛酸,其物质的量比为4.91∶1.28∶1∶0.71,平均分子质量1 013 kDa[17]。
环磷酰胺一水合物 美国Sigma公司;盐酸左旋咪唑 山东仁和堂药业有限公司;小鼠IL-6、IL-10、TNF-α、IFN-γ酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 武汉博士德生物工程有限公司;苏木精-伊红(hematoxylineosin,HE)染色液 上海碧云天生物技术有限公司;PrimeScript RT reagent Kit with gDNA Eraser (Perfect Real Time)、SYBR®Premix Ex Taq™ II (Tli RNaseH Plus) 日本TaKaRa公司;其他试剂均为国产分析纯。
1.2 仪器与设备
自动组织脱水机、组织包埋机、生物组织摊烤片机、轮转式切片机 金华市科迪仪器设备有限公司;3K15冷冻离心机 德国Sigma公司;Primo Vert倒置显微镜德国Carl Zeiss公司;Varioskan Flash多功能酶标仪美国Thermo公司;LDZX-50KB立式压力蒸汽灭菌器上海申安医疗器械厂;SHP-150生化培养箱 上海森信实验仪器有限公司;V123530聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;7900 HT实时定量PCR仪 日本Applied Biosystems公司。
1.3 方法
1.3.1 动物分组及处理
小鼠在SPF级动物房自由饮食、饮水适应环境一周后,苦味酸标记,8 只一组,随机分为:正常对照组、模型组、阳性对照组及黑灵芝多糖低、中、高剂量组。黑灵芝多糖剂量组及阳性对照组小鼠按1%体质量连续3 d于上午9:30腹腔注射环磷酰胺80 mg/(kg·d),正常对照组注射等量生理盐水,建立免疫抑制小鼠模型,造模结束后从正常对照组及模型组各随机选择3 只小鼠计算脾脏指数、检测血清中IFN-γ的含量,结果显示模型组小鼠脾脏指数、血清中IFN-γ的含量均显著低于正常对照组小鼠,确定模型建造成功。依据本实验室前期黑灵芝多糖的实验研究[15-16],造模结束24 h后黑灵芝多糖低、中、高剂量组分别灌胃25、50、100 mg/(kg·d)的黑灵芝多糖,阳性对照组灌胃40 mg/(kg·d)的盐酸左旋咪唑,正常对照组、模型组灌胃等体积的生理盐水,每天上午9:30开始灌胃,连续灌胃7 d。小鼠饲喂环境:温度(21±1)℃、相对湿度(50±10)%,12 h光照12 h黑暗交替,自由饮水、饮食,笼子、水瓶定期换洗消毒。
1.3.2 体质量测定
小鼠造模及灌胃前半个小时每天观察小鼠状态、称取并记录体质量变化。
1.3.3 空肠组织病理学观察
取适量空肠组织用生理盐水冲洗后,按照体积比1∶10在体积分数10%的中性福尔马林溶液中充分固定,参照Chen Changying等[18]的方法,空肠组织经脱水、包埋、切片及HE染色处理后,使用100 倍倒置光学显微镜选取视野范围内5 根最长肠绒毛拍照观察并比较空肠黏膜形态的变化,应用图像分析系统,测量空肠绒毛长度(绒毛顶部到肠腺绒毛连接处)和隐窝深度(肠腺绒毛连接处到肠腺基底),取平均值,并计算绒毛长度/隐窝深度比值(V/C值)。
1.3.4 小肠组织细胞因子含量测定
以预冷磷酸盐缓冲液为匀浆液,取适量小肠组织,在冰浴条件下制成10%组织匀浆液,4 ℃、3 000 r/min离心15 min,收集并分装小肠组织上清液,于-80 ℃保存备用。分别按照IL-6、IL-10、TNF-α和IFN-γ ELISA试剂盒操作说明,检测相应细胞因子的含量。
1.3.5 小肠组织RT-qPCR分析

表1 RT-qPCR引物序列Table1 Primer sequences used for RT-qPCR
取适量小肠组织样品,参照Trizol提取法的详细说明提取总RNA并定量,琼脂糖凝胶电泳对总RNA质量进行检测后,使用PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒逆转录获得cDNA。使用SYBR Premix Ex Taq™ II(Tli RNaseH Plus)试剂盒进行反转录定量PCR(reverse transcription-quantitative PCR,RT-qPCR)扩增,扩增程序为:95 ℃预变性1 min 30 s;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 30 s,共40 次循环,引物序列见表1。同时检测SYBR Green Ⅱ和校正染料ROX Reference Dye的荧光信号。
以β-actin为内参基因,使用2-△△Ct计算T-bet和GATA-3 mRNA的相对表达水平,△△Ct按下式计算。

1.4 数据统计分析
2 结果与分析
2.1 小鼠体质量的变化
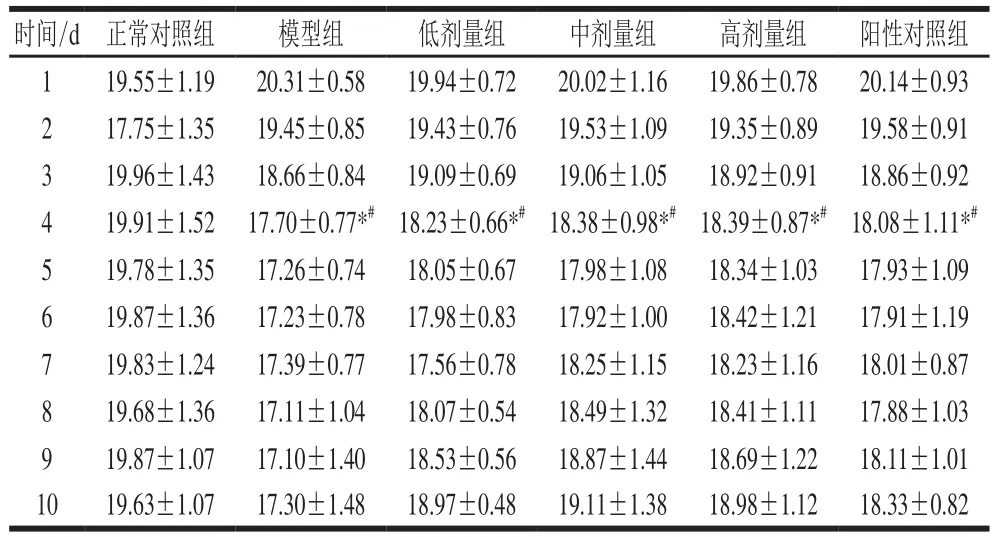
表2 小鼠体质量变化Table2 Change in body mass g
实验期间,腹腔注射环磷酰胺后小鼠食欲下降,毛色暗淡且伴有脱毛现象,精神不佳,粪便干涩,说明免疫抑制模型建造成功。体质量变化如表2所示,腹腔注射环磷酰胺第2天开始,所有免疫抑制组小鼠体质量急剧下降。末次腹腔注射环磷酰胺24 h后(第4天),相比正常对照组,各组免疫抑制小鼠体质量显著下降(P<0.05);相比腹腔注射第1天,各组免疫抑制小鼠末次腹腔注射环磷酰胺24 h后,体质量显著下降(P<0.05)。第5天开始,各组小鼠体质量基本停止下降,相比模型组,灌胃黑灵芝多糖剂量组及阳性对照组小鼠体质量回升速度较快。
2.2 免疫抑制小鼠空肠组织病理学观察
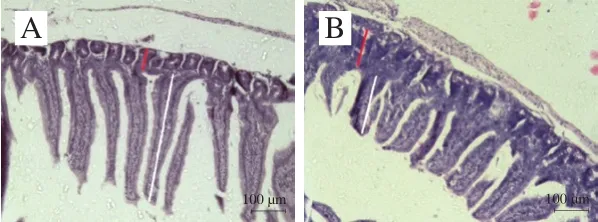
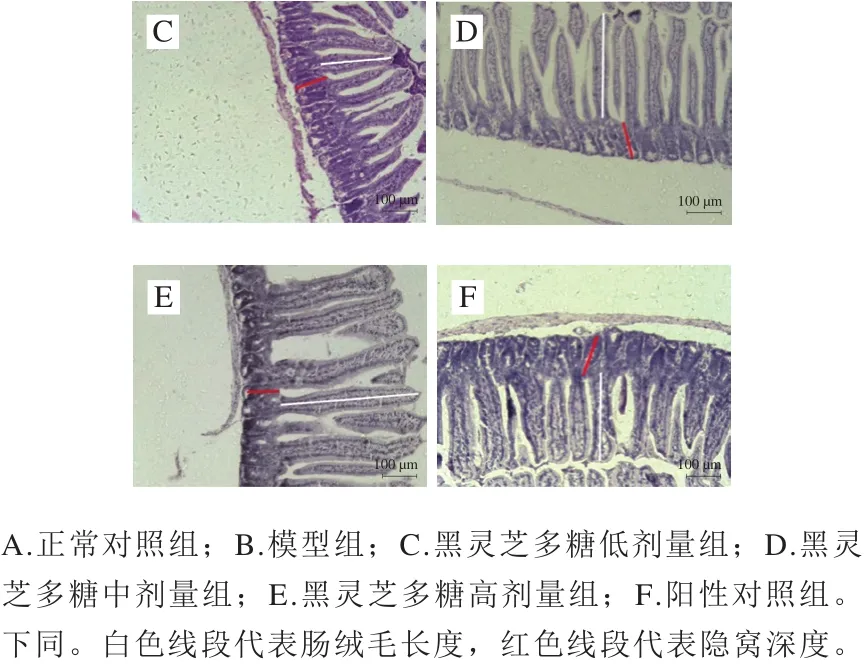
图1 小鼠空肠组织切片病理学观察(×100)Fig.1 Pathological observation of jejunal tissue sections from mice (× 100)
绒毛长度、隐窝深度及绒毛长度/隐窝深度(V/C值)是反映小肠消化吸收功能和机体健康状况的重要指标[19]。倒置显微镜下观察并比较空肠组织黏膜形态结构的变化,相比正常对照组(图1A),模型组(图1B)肠绒毛较短且伴有肿胀现象,隐窝变浅。相比模型组(图1B),黑灵芝多糖剂量组小鼠(图1C、D、E)绒毛较为细长,肿胀现象得以改善。
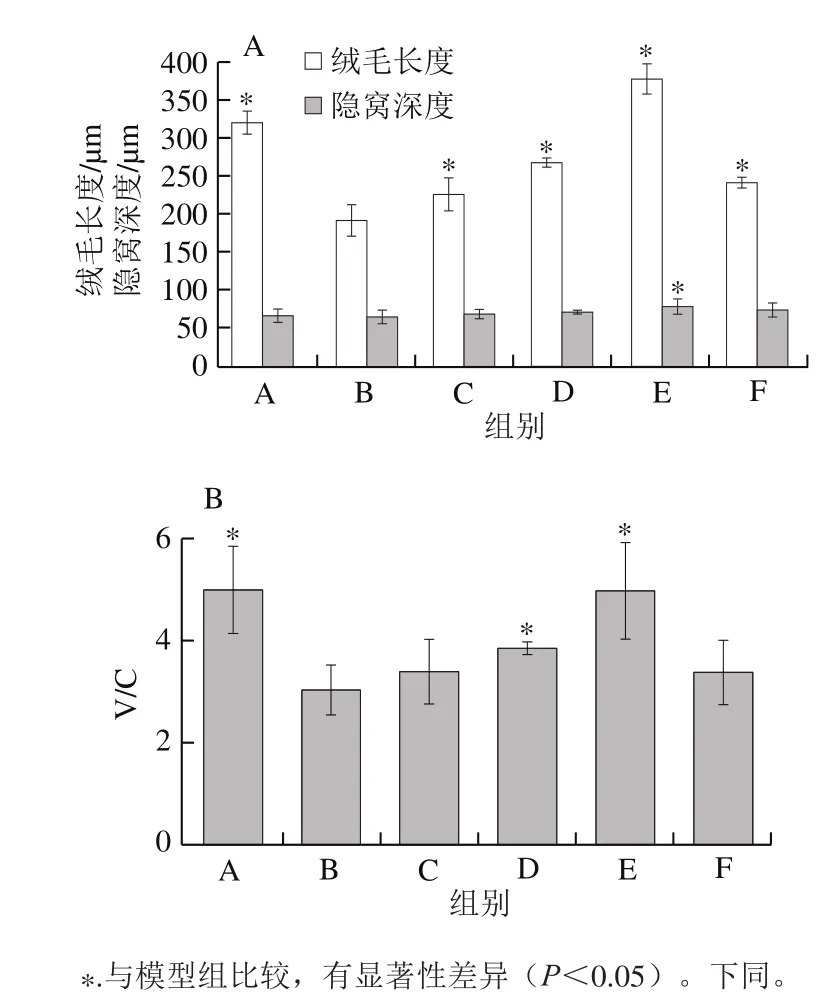
图2 小鼠空肠绒毛长度、隐窝深度(A)和V/C值(B)Fig.2 Villus length, crypt depth (A) and V/C value (B) in the jejunum of mice
对各组小鼠空肠组织黏膜形态进行统计学分析,如图2A所示,相比模型组,黑灵芝多糖剂量组与阳性对照组绒毛长度均有显著性增加(P<0.05),隐窝深度有上升趋势,除黑灵芝多糖高剂量组有显著性增加外(P<0.05),其余各组与对照组均无显著性差异。如图2B所示,相比模型组,黑灵芝多糖中、高剂量组小鼠V/C值显著性增加(P<0.05),低剂量组V/C值无显著性增加,V/C值呈剂量依赖性增加。
2.3 黑灵芝多糖对免疫抑制小鼠细胞因子水平的影响
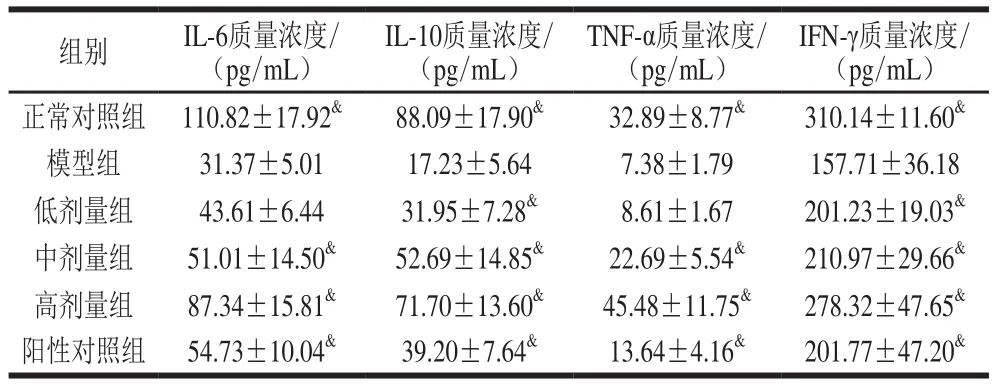
表3 各组小鼠小肠细胞因子质量浓度Table3 Levels of small intestinal cytokines in mice
由表3可知,与正常对照组相比,模型组小肠组织IL-6、IL-10、TNF-α和IFN-γ分泌水平都显著降低(P<0.05)。相比模型组,黑灵芝多糖低、中、高剂量组IL-10和IFN-γ质量浓度均显著增加(P<0.05);黑灵芝多糖中、高剂量组的IL-6和TNF-α质量浓度相比模型组显著增加(P<0.05),但低剂量组并无显著性差异。
2.4 小肠中T-bet和GATA-3 mRNA的表达水平
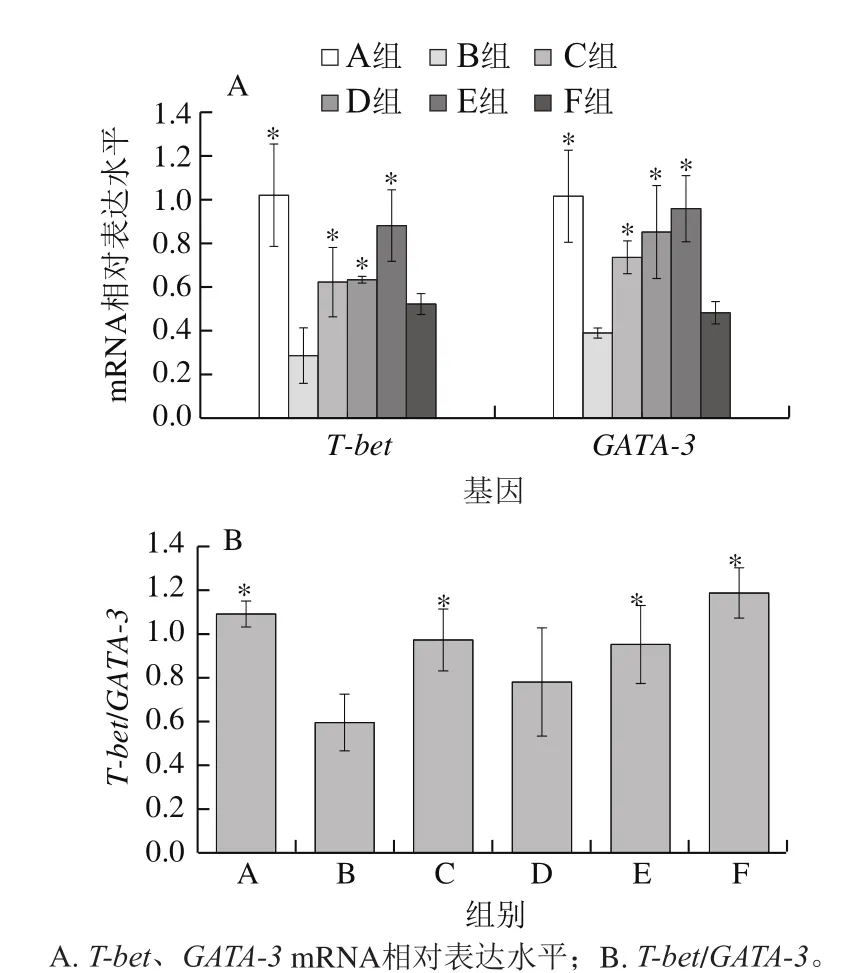
图3 小肠T-bet和GATA-3的mRNA相对表达水平Fig.3 Relative mRNA expression levels of T-bet and GATA-3 in small intestine of mice
T-bet、GATA-3是不同T细胞亚群细胞核内的关键转录因子。如图3所示,相比模型组,灌胃黑灵芝多糖剂量组T-bet和GATA-3基因的相对表达水平均显著增加(P<0.05),GATA-3基因的相对表达呈剂量依赖性增加。相对模型组,灌胃不同剂量的黑灵芝多糖T-bet/GATA-3比值均有所提高,且低、高剂量组呈显著性增加(P<0.05)。
3 讨 论
环磷酰胺属化疗类抗肿瘤药物,目前作为免疫毒理学中常用的阳性药物,其介导的细胞毒作用会损伤DNA,对机体具有免疫抑制效果[20-21]。正常小鼠过量摄入环磷酰胺导致免疫抑制,表现为体质量下降,精神萎靡,食欲下降[22]。本实验结果显示,相比模型组,灌胃黑灵芝多糖后各剂量组小鼠体质量回升显著,表明黑灵芝多糖对免疫抑制小鼠体质量下降有改善作用。
肠道作为机体最大的免疫器官,小肠是机体消化吸收的最大场所,绒毛是小肠的特有结构,良好的黏膜形态结构能够保障营养物质的充分消化吸收[23]。肠绒毛上的杯状细胞分泌的黏蛋白构成防止微生物入侵的第一道防线,肠上皮细胞不断从隐窝深处分化,向绒毛顶部迁徙,弥补正常的细胞凋亡,具有吸收功能,在介导肠道微生物和免疫平衡中具有重要作用[2,24]。石玉祥等[25]通过连续7 d给小鼠灌胃枸杞多糖发现,枸杞多糖可有效改善小肠黏膜屏障,促进屏障结构趋于完整。陈凌锋等[26]研究发现太子参茎叶多糖能够增加断奶仔猪肠绒毛长度,维持肠道微生态平衡。小肠绒毛肿胀、变短,不利于机体的消化吸收功能,本实验结果表明,黑灵芝多糖能在一定程度上增长环磷酰胺致免疫低下小鼠的肠绒毛长度,提高V/C值,改善肠道绒毛形态,促进营养物质的吸收。
黏膜免疫系统是机体免疫的重要组成部分,细胞因子广泛存在肠道黏膜中,参与机体的免疫调节作用,细胞因子的质量浓度与肠黏膜的免疫状态息息相关。IL-6是重要的促炎因子,分泌途径多样,T淋巴细胞和单核巨噬细胞的活化,促进IL-6的分泌,进而反馈调节活化的T细胞增殖[27]。IL-10是重要的抗炎因子,通过抑制抗原提呈细胞降低免疫应答,防止机体过度免疫[28]。TNF-α属重要的促炎因子,是TNF超家族成员,来源单核细胞、巨噬细胞及T淋巴细胞,调节自身免疫[29-30]。IFN-γ由活化的T淋巴细胞和NK细胞产生,是巨噬细胞的激活剂,在适应性细胞介导的免疫应答中起重要作用[31]。王君巧等[16]的研究表明,黑灵芝多糖能有效提高免疫抑制小鼠脾细胞TNF-α质量浓度。孙晓雨等[32]的研究也表明枸杞多糖和茯苓多糖对提高免疫抑制小鼠小肠及血清中IFN-γ的质量浓度有明显促进作用。本实验结果显示,相比模型组,灌胃黑灵芝多糖小鼠的IL-10和IFN-γ质量浓度均显著升高,且呈剂量依赖性;黑灵芝多糖高、中剂量组IL-6、TNF-α质量浓度显著增加,低剂量组质量浓度有上升趋势,表明黑灵芝多糖能通过增加IL-6、IL-10、TNF-α及IFN-γ等细胞因子的分泌正向调节机体的免疫活性,对维持肠道黏膜免疫内稳态有促进作用。
T细胞参与机体适应性免疫应答,是淋巴细胞中具有复杂功能的一类细胞,根据功能的不同分为众多亚群,Th1、Th2是免疫功能下T淋巴细胞分化的两个重要亚群。Th1细胞主要介导细胞免疫,分泌TNF-α和IFN-γ等细胞因子;Th2细胞刺激B细胞增殖,主要介导体液免疫,分泌IL-6和IL-10等细胞因子[33]。机体在正常情况下Th1/Th2细胞维持动态平衡状态,T-bet和GATA-3分别为Th1型细胞和Th2型细胞核内关键转录因子,T-bet/GATA-3的比值可用来衡量机体Th1/Th2细胞的平衡状态[34]。本研究结果发现,黑灵芝多糖能显著提高T-bet和GATA-3相对表达水平,且低、中、高剂量组T-bet/GATA-3的比率均高于模型组,提示黑灵芝多糖可能通过调节Th1/Th2细胞的平衡来调控机体免疫应答。
综上所述,黑灵芝多糖有利于环磷酰胺诱导的免疫低下小鼠体质量的恢复,改善肠道黏膜形态结构,促进肠道组织中重要细胞因子分泌,提高Th1和Th2细胞核转录因子基因相对表达水平,表明黑灵芝多糖能够调节环磷酰胺导致的小鼠肠道黏膜免疫。本实验结果可为进一步研究黑灵芝多糖对肠道黏膜免疫的机制提供理论依据。

