预酶解-挤压膨化对全谷物糙米粉品质特性的影响
赵志浩,刘磊,张名位,*,张瑞芬,肖娟,魏振承,马永轩
(1.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610;2.福建农林大学食品科学学院,福建 福州 350000)
全谷物是指其种皮、胚乳和胚的相对比例与天然谷物籽粒构成相同的谷物原料。糙米是指脱除谷壳后的稻谷颖果,包含米糠、胚和胚乳,是一种典型的全谷物。相比于精米而言,糙米的米糠层中不仅含有丰富的蛋白质、脂肪、碳水化合物、维生素和矿物元素等营养素[1-2],而且还富含谷维素、酚酸、黄酮、谷甾醇、γ-氨基丁酸等多种植物活性成分[3-5],其营养价值和保健功效更高。然而,由于不易蒸煮、米饭适口性差等原因,糙米通常需要经过加工后再食用。挤压膨化是一种可以同时实现搅拌、加热、杀菌、膨化等多种基本操作的技术,具有效率高、能耗低、多功能、连续生产、卫生环保等优点[6-8],利用挤压膨化技术生产糙米速食粉、代餐粉等是糙米加工的重要方式。
早在1995年,金增辉[9]就开发出利用挤压膨化加工速食糙米粉的方法。但一直以来,挤压膨化糙米粉面临冲调分散性差、冲调黏度过高等弊端,产品不易被消费者接受。近年来的研究发现,挤压膨化过程中添加α-淀粉酶可以提高产品水溶性、降低冲调黏度、提高淀粉消化率[10-11],酶解辅助挤压膨化已经成为近年来的研究热点。许亚翠等[10]研究发现添加高温α-淀粉酶辅助挤压膨化可降低米粉的结块率和冲调黏度。Xu Enbo等[12-13]研究发现添加高温α-淀粉酶处理提高了膨化糯米的水溶性指数(water solubility index,WSI),降低了其吸水性指数(water absorption index,WAI)。Myat等[14]研究发现,加入高温α-淀粉酶在95 ℃和115 ℃下进行挤压膨化,膨化玉米淀粉的WSI分别由2.59%和2.81%提高到8.45%和8.56%。申德超等[15]研究发现,添加α-淀粉酶挤压的大米作为啤酒辅料,糖化过程不易结块,过滤速度提高。本课题组采取高温α-淀粉酶辅助挤压膨化的方法提高了发芽糙米粉的冲调分散性和淀粉消化性能[11]。这些研究共同表明,挤压膨化过程中添加α-淀粉酶可以在一定程度上改善产品冲调分散性,但由于挤压膨化工艺存在加工温度高、作用时间短及水分含量低等特点,使得酶在短时间内变性失活,导致酶解作用受到很大的限制,对糙米粉品质的改善也相对有限。
本研究采用预酶解-挤压膨化技术,即向原料中添加少量的水和高温α-淀粉酶,在适当温度下先进行预酶解处理,再对预酶解后的原料进行挤压膨化制备全谷物糙米粉。该技术使高温α-淀粉酶在预处理和膨化两个阶段均能发挥水解作用,可以突破挤压过程中高温、短时、低水分含量等不利因素对酶解的限制,提高酶解效率,进一步改善糙米粉品质。本研究以普通糙米、红色糙米、黑色糙米3 种糙米为原料,以预酶解-挤压膨化制备的糙米粉作为实验组,未经预酶解处理直接挤压膨化制备的糙米粉作为对照组,分别测定其WSI、WAI、结块率、分散时间、米糊黏度、色度、糊化度、感官评分以及淀粉、还原糖、总蛋白质、可溶性蛋白含量等指标,并对淀粉和蛋白质进行体外模拟消化,比较分析预酶解-挤压膨化对糙米粉冲调分散性、营养消化性和感官特性等品质特性的影响。旨在为改善膨化糙米粉食用品质、促进预酶解-挤压膨化技术在谷物加工中的应用提供参考。
1 材料与方法
1.1 材料与试剂
普通糙米(‘合丰粘’)、红色糙米(‘红宝石’)、黑色糙米(‘龙锦1号’)由广东省农业科学院水稻研究所提供,下文分别简称普通糙米、红米和黑米;高温α-淀粉酶(酶活力120 KNU-S/g) 诺维信(中国)生物技术有限公司;胃蛋白酶(250 U/mg)、猪胰α-淀粉酶(50 U/mg) 美国Sigma-Aldrich公司;糖化酶(100 000 U/g) 江苏锐阳生物科技有限公司;高峰氏淀粉酶(4 000 U/g) 上海源叶生物科技有限公司;胰蛋白酶(250 U/mg) 广州齐云生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
XFB-1000型中药粉碎机 吉首市中诚制药机械厂;LS-75HD型立式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;DS30-II型双螺杆膨化机 山东赛信膨化机械有限公司;DHG-9425电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;DF-101S型集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;PCE-E3000型恒温水浴振荡器 苏州威尔实验用品有限公司;Heraeus Multifuge X1型离心机 美国Thermo Scientific公司;AR-1500ex流变仪 美国TA公司;UltraScan VIS型色差仪 美国Hunter Lab公司;UV-1800型紫外-可见分光光度计 日本岛津公司;K8400型蛋白质分析仪 丹麦FOSS公司;SQP224型电子天平 赛多利斯(北京)科学仪器有限公司。
1.3 方法
1.3.1 样品制备
3 种糙米原料粉碎至60 目,将高温α-淀粉酶液分散于一定量的蒸馏水中,以边搅拌边喷淋的方式调节水分质量分数和加入高温α-淀粉酶,使原料水分质量分数达到22%,添加1 500 U/g高温α-淀粉酶,之后转移至大烧杯中,保鲜膜封口,于蒸汽灭菌锅中100 ℃加热0.5 h进行预酶解,流水冷却至25 ℃。预酶解后的糙米粉利用双螺杆膨化机进行挤压膨化,仪器参数参考张冬媛等[11]的方法并稍加修改。设置挤压机前、中、后段温度分别为60、98 ℃和134 ℃,螺杆转速为29.6 Hz,进料速率为300 g/min,制得预酶解-挤压膨化糙米粉。以边搅拌边喷淋的方式调节原料水分质量分数至22%,在上述条件下进行挤压膨化,制得挤压膨化糙米粉作为对照。挤出物均在55 ℃恒温干燥箱中干燥2 h,粉碎并过60 目筛,低温密封保存。实验分为6 组:挤压膨化普通糙米粉(extruded brown rice fl our,E-Brown Rice)、预酶解-挤压膨化普通糙米粉(extruded brown rice fl our pretreated by enzyme,EE-Brown Rice)、挤压膨化红米粉(extruded red rice flour,E-Red Rice)、预酶解-挤压膨化红米粉(extruded red rice fl our pretreated by enzyme,EE-Red Rice)、挤压膨化黑米粉(extruded black rice fl our,E-Black Rice)、预酶解-挤压膨化黑米粉(extruded black rice flour pretreated by enzyme,EE-Black Rice)。
1.3.2 水分质量分数的测定
参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》中方法测定水分质量分数。
1.3.3 径向膨化率的测定
随机选取10 段挤出物,用游标卡尺测量直径,径向膨化率的计算公式如式(1)所示。1.3.4 WSI、WAI的测定

参考Anderson等[16]的方法并稍加改进。准确称取2.5 g样品,置于100 mL离心管中,加去离子水30 mL,适当混匀至所有样品浸润,275 r/min下振摇30 min,然后3 000×g离心15 min,分离上清液和沉淀物。上清液倒入预先干燥至恒定质量的铝制扁形称量瓶中,105 ℃蒸发至恒定质量。WSI和WAI的计算公式如式(2)、(3)所示。

1.3.5 分散时间的测定
参考张冬媛等[11]的方法。准确称取2.5 g样品,通过直径为11.5 cm的漏斗加入到60 r/min磁力搅拌的70 ℃热水中(200 mL烧杯中加入100 mL水),漏斗下端出口与液面的距离为12 cm,从样品加入漏斗中开始计时,粉体分散均匀时终止计时,该段时间即为分散时间,重复5 次。
1.3.6 结块率的测定
参考刘静波等[17]的方法。准确称取20 g样品,置于500 mL烧杯中,加入预热至80 ℃的去离子水180 mL,静置10 min后用预先干燥至恒质量的20 目筛过滤,清水漂洗结块,105 ℃干燥至恒质量,连带筛网称质量,减去筛网质量即为结块物的质量。结块率的计算公式如式(4)所示。

1.3.7 米糊黏度的测定
样品经105 ℃干燥至恒质量,冷却至室温,称取20 g,加入80 mL 80 ℃热水,玻璃棒缓慢搅拌至均匀,制得质量分数20%的米糊。使用装备40 mm直径铝平板夹具的AR-1500ex流变仪,设置夹具与样品台的间距为1 mm,温度25 ℃,角频率范围0.01~200 rad/s。移取适量米糊样品于样品台上,静置10 min,操作流变仪下压夹具,并移除夹具边缘溢出的样品,启动程序进行测定。
1.3.8 色度的测定
使用UltraScan VIS型色差仪,选用CIELab色彩空间进行色度测定,并计算色差值(ΔE*),计算公式如式(5)所示。

式中:ΔL*、Δa*和Δb*分别为实验组与对照组亮度值、红/绿值和黄/蓝值的差值。
1.3.9 淀粉、还原糖含量的测定
淀粉含量的测定:酶水解法,参照GB 5009.9—2016《食品安全国家标准 食品中淀粉的测定》。
还原糖含量的测定:参考文伟等[18]的方法并稍加改进。准确称取2 g样品,置于100 mL离心管中,加去离子水30 mL,25 ℃振荡30 min,4 000 r/min离心10 min,取上清液定容至50 mL,二硝基水杨酸法测定其还原糖含量,结果以每克干基中的葡萄糖质量(mg/g)表示。
1.3.10 总蛋白质含量、可溶性蛋白含量的测定
总蛋白质含量的测定:凯氏定氮法,参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》。
可溶性蛋白含量的测定:考马斯亮蓝法,参照方勇等[19]的方法。准确称取样品1.0 g,加入9 mL生理盐水,冰浴条件下机械均质,悬浊液2 500 r/min离心10 min,取上清液定容至25 mL。取定容后的上清液50 μL,加入3.0 mL考马斯亮蓝显色剂,混匀并静置10 min,595 nm波长处测定吸光度A1。50 μL去离子水代替样液作空白对照,测得吸光度A0,50 μL蛋白标准品(质量浓度为0.563 g/L的牛血清白蛋白)作标准对照,测得吸光度A2。样液可溶性蛋白质量浓度计算公式如式(6)所示,样品可溶性蛋白质含量计算公式如式(7)所示。

1.3.11 淀粉糊化度的测定
采用碘分光光度法,参考Birch等[20]的方法并稍加改进。准确称取0.1 g样品,使之均匀分散在49 mL去离子水中,加入1 mL浓度为10 mol/L的KOH溶液,缓慢磁力搅拌5 min,4 500×g离心10 min,取上清液1.0 mL,加入0.4 mL浓度为0.5 mol/L的HCl溶液,用去离子水定容至10 mL,再加0.1 mL碘液(0.5 g碘和2 g碘化钾定容至50 mL),混合均匀后600 nm波长处测定吸光度A1;在测定过程中,将去离子水体积替换为47.5 mL,KOH溶液体积替换为2.5 mL,HCl溶液体积替换为1.0 mL,其他操作相同,所测得吸光度为A2。糊化度计算公式如式(8)所示。

1.3.12 淀粉体外消化特性的测定
参考Englyst等[21]的方法并稍加改进。准确称取0.3 g样品,使样品均匀分散于10 mL醋酸缓冲液(0.2 mol/L、pH 5.2),加入10 mL混合酶液(290 U/mL猪胰α-淀粉酶和15 U/mL糖化酶),37 ℃、120 r/min下水浴振荡。分别反应0、20、120 min后取1 mL酶解液,加入4 mL去离子水稀释,立即沸水浴灭酶5 min,流水冷却,6 000×g离心10 min,取上清液定容至10 mL,二硝基水杨酸法测定其还原糖含量。
淀粉体外消化特性通过测定快消化淀粉、慢消化淀粉和抗性淀粉的比例来表征,其计算公式如式(9)~(11)所示。

式中:G20和G120分别为消化20 min和120 min后酶解液中还原糖的质量/mg;FG为消化前酶解液中还原糖的质量/mg;TS为样品总淀粉的质量/mg;RDS、SDS分别为快消化淀粉、慢消化淀粉比例/%。
1.3.13 蛋白质体外消化特性的测定
参考甄红敏等[22]的方法并稍加改进。准确称取10 g样品分散于200 mL浓度为0.1 mol/L的H C l溶液中,预热至37 ℃,加入1 0 0 μ g胃蛋白酶(酶∶底物为1∶1 0 0,m/m),37 ℃水浴振荡,分别在消化0、30、60、120 min后取酶解液10 mL,加入1 mol/L NaOH溶液调节pH值至7.0后,加入100 μg胰蛋白酶(酶∶底物为1∶100,m/m),37 ℃水浴振荡,分别在消化30、60、90、120 min之后取酶解液10 mL。
所有酶解液取出后立即沸水浴5 min灭酶,流水冷却后加入10 mL质量分数10%三氯乙酸(trichloroacetic acid,TCA)溶液,混合均匀后8 000×g离心20 min,弃去上清液,向沉淀中加入10 mL质量分数10% TCA溶液洗涤,同样条件下再次离心20 min。转移沉淀,采用凯式定氮法测定其氮质量。各取样时间点的蛋白质体外消化率计算公式如式(12)所示。

式中:N0为消化前样品TCA溶液中不溶性氮质量/mg;Nt表示消化时间t/min后样品TCA溶液中不溶性氮质量/mg。
1.3.14 感官评分的测定
参考张丽霞等[23]的方法并稍加改进。称取适量样品于清洁的白色陶瓷盘中,保持样品质量一致,在明亮柔和的灯光下目测样品色泽;将相同质量的样品倒入透明玻璃杯中,加入8 倍体积的80 ℃温开水,搅拌均匀,观察其冲调性并评分;嗅其气味并品尝其滋味,对米糊气味和口感进行评分;各单项评分采取百分制(表1);统计各评定人员的单项评分,并根据各单项评分权重计算出综合评分,公式如式(13)所示。


表1 感官评分标准Table1 Criteria for sensory evaluation of extruded rice fl our
1.3.15 粗脂肪、膳食纤维含量的测定
粗脂肪含量的测定:索氏提取法,参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》。
膳食纤维含量的测定:酶质量法,参照GB 5009.88—2014《食品安全国家标准食品中膳食纤维的测定》。
1.4 数据统计与分析
使用Excel 2007软件处理数据,除特殊说明,实验数据为3 次平行测定结果,表示为±s,使用SPSS Statistics 19.0软件进行Duncan法多重比较及显著性分析,P<0.05表示差异显著;使用Origin 9.0软件作图。
2 结果与分析
2.1 糙米原料主要化学成分的含量

表2 糙米原料的主要化学成分含量Table2 Chemical composition of brown rice
如表2所示,红米的蛋白质含量最高,达到9.81 g/100 g,其次是黑米,而普通糙米的蛋白质含量最低;黑米的粗脂肪含量最高,其次是普通糙米,红米的粗脂肪含量最低;普通糙米的淀粉含量最高,而膳食纤维含量最低;黑米的淀粉含量最低,而膳食纤维含量最高;红米的淀粉和膳食纤维含量均介于普通糙米和黑米之间。
2.2 预酶解-挤压膨化对糙米粉挤出物径向膨化率的影响

图1 预酶解-挤压膨化对糙米粉挤出物径向膨化率的影响Fig.1 Effect of enzymatic pretreatment and extrusion on radial expansion ratio of brown rice extrudates
如图1所示,预酶解-挤压膨化处理显著降低了3 种糙米粉的径向膨化率(P<0.05)。其中,普通糙米粉的径向膨化率由2.02下降至1.15;红米糙米粉由2.29下降至1.59;黑米糙米粉由2.08下降至1.12。
径向膨化率是衡量膨化率的重要指标。Mezreb等[24]研究发现添加蔗糖对挤压膨化玉米和小麦的截面膨化率和轴向膨化率均有减小的作用;Keith等[25]研究发现向玉米和小麦混合粉中添加盐和糖均具有减小挤出物径向膨化率的作用。挤压膨化过程中,物料在膨化机腔内受到压力和热力的共同作用而形成熔融态,熔融体的黏度过低会导致挤出模口后其内部气泡易塌陷、破裂,最终导致挤出物的膨化率降低[26]。糙米粉在预酶解-挤压膨化过程中,部分淀粉被高温α-淀粉酶分解,转化成糊精、低聚糖、麦芽糖和葡萄糖等小分子糖类。淀粉的相对含量减少导致挤压机腔内熔融体的黏度降低,进而降低径向膨化率。同时,小分子糖类的存在会使熔融体的表面张力增大,降低其玻璃态转化温度,一方面使挤出瞬间熔融体的气泡膨胀减弱;另一方面使熔融体经过无定形态转变为玻璃态的过程延长,进而使气泡收缩的时间延长,收缩程度加大[27]。由于预酶解处理的酶添加量和水分含量相对较高,水解的淀粉含量相对较高,导致糙米粉的径向膨化率降低幅度较大。另外,预酶解过程涉及湿热作用,原料在这个过程中粉质变软也对膨化率的降低有一定影响。
2.3 预酶解-挤压膨化对糙米粉冲调分散性的影响
如表3所示,预酶解-挤压膨化处理显著提高了3种糙米粉的WSI(P<0.05),普通糙米、红米和黑米3 种糙米粉的WSI分别提高了2.04、1.35和1.71 倍。WAI均显著降低(P<0.05),普通糙米、红米和黑米3 种糙米粉的WAI分别降低了67.87%、60.96%和62.17%。分散时间均显著缩短(P<0.05),普通糙米、红米和黑米3 种糙米粉的分散时间分别缩短了66.61%、61.79%和64.30%。结块率均显著升高(P<0.05),普通糙米、红米和黑米3 种糙米粉的结块率分别提高了5.44、6.27 倍和3.07 倍。
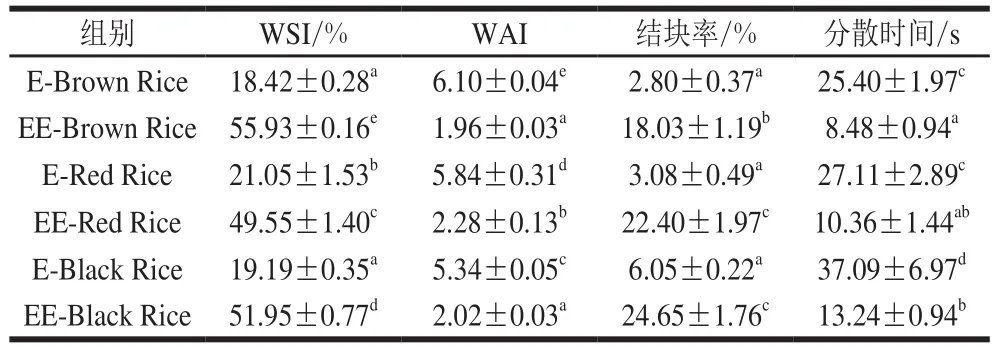
表3 预酶解-挤压膨化对糙米粉冲调分散性的影响Table3 Effect of enzymatic pretreatment and extrusion on dispersability of brown rice fl our
挤出物的WAI主要反映淀粉的持水性能,而WSI主要反映大分子降解的程度[28]。预酶解-挤压膨化过程中高温α-淀粉酶降解部分淀粉分子,使小分子糖类等可溶性物质含量增加,同时淀粉结构被破坏,与水作用后吸水和持水性能下降,宏观表现为WSI上升而WAI下降。分散时间的结果也与WAI、WSI相对应,经预酶解-挤压膨化的糙米粉分散时间更短,其原因在于经过预酶解-挤压膨化,淀粉含量降低、结构松散、小分子亲水物质含量增加,糙米粉亲水性增强,综合表现为分散时间更短。Xu Enbo等[12-13]发现添加高温α-淀粉酶的糯米和糯米、大豆混合物经过挤压膨化后,其WAI比不添加高温α-淀粉酶均有下降,而WSI均有升高,与本研究结果一致。预酶解-挤压膨化普通糙米粉的WSI达到55.93%,高于张冬媛等[11]发芽-挤压-淀粉酶协同处理的42.06%和许亚翠等[10]直接添加高温α-淀粉酶处理的10.91%,而WAI为1.96,低于张冬媛等[11]发芽-挤压-淀粉酶协同处理的3.78,说明预酶解-挤压膨化技术对糙米粉冲调分散性的改善更加显著。
许亚翠等[10]研究发现在大米的挤压膨化过程中,添加高温α-淀粉酶使米粉的结块率由32.0%下降到11.25%。张冬媛等[11]也发现在糙米挤压膨化过程中,加入高温α-淀粉酶使糙米粉结块率降低。但本研究发现预酶解-挤压膨化显著提高糙米粉的结块率。其原因可能是由于物料在机腔内停留时间只有十几秒至几十秒,添加的酶制剂没有足够的反应时间作用于物料,而本研究采用预酶解-挤压膨化技术,预酶解处理于挤压膨化前进行,反应时间长、原料酶解程度较高,挤压后糙米粉中小分子糖和糊精含量更高,亲水性更强。在加入热水后,表层粉体迅速吸水,结块率的测定过程中没有搅拌操作,表层粉体附着在物料表面,阻碍内部粉体吸收水分,最终形成内部包裹干粉的团块结构。而分散时间的测定方法是将粉体通过漏斗缓慢加入磁力搅拌的热水中,所以并未形成结块,分散时间更短。朱云辉等[29]在研制复合营养粉时发现,适当添加亲水性较强的奶粉可以改善复合营养粉的冲调性,但奶粉添加量过高时复合营养粉的结块率会增加。表层粉体亲水性过强的同时缺乏搅拌,引起的移动分散过慢可能是结块率升高的共同原因。
2.4 预酶解-挤压膨化对糙米粉米糊黏度的影响
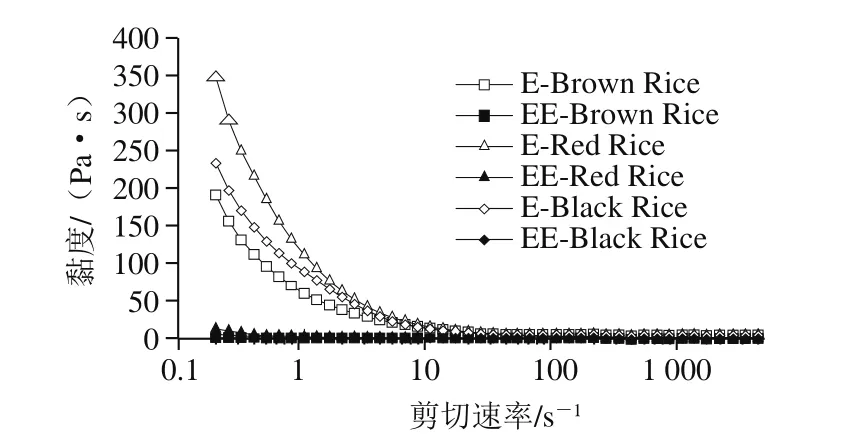
图2 预酶解-挤压膨化对糙米粉米糊黏度的影响Fig.2 Effect of enzymatic pretreatment and extrusion on viscosity of brown rice paste
如图2所示,预酶解-挤压膨化使糙米粉的米糊黏度降低,预酶解-挤压膨化糙米粉和对照组糙米粉均有剪切稀释的性质,但预酶解-挤压膨化使糙米粉的米糊在较低的剪切速率下具有较低的黏度,黏度曲线趋于平直,剪切稀释效应与对照组相比不明显,与2.3节中WSI、WAI和分散时间的实验结果相符,均证明了预酶解-挤压膨化可以改善糙米粉的冲调性能。
2.5 预酶解-挤压膨化对糙米粉色度的影响

表1 预酶解-挤压膨化对糙米粉色度的影响Table1 Effect of enzymatic pretreatment and extrusion on color of brown rice fl our
如表4所示,与对照组相比,预酶解-挤压膨化使红米和黑米原料糙米粉的亮度值、红/绿值和黄/蓝值均显著升高(P<0.05);但普通糙米粉的亮度值显著升高(P<0.05),而红/绿值和黄/蓝值显著降低(P<0.05)。与对照组相比,预酶解-挤压膨化使糙米粉产生一定的色差,色差值均大于3,表示色差肉眼可分辨。
糙米原料在预酶解-挤压膨化的过程中,与直接挤压膨化相比,色度的变化主要有3 个方面的原因:首先,糙米原料经过预酶解,还原糖含量升高,进而对美拉德反应、焦糖化反应等非酶褐变具有促进作用;其次,预酶解过程中的湿热作用使糙米原料粉质发生软化,挤压过程中粉体颗粒之间的摩擦力减小,进而导致机腔内压力和温度降低,对非酶褐变的反应又具有抑制作用;最后,预酶解-挤压膨化过程中由于高温α-淀粉酶的酶解作用使糙米原料中的色素物质得到释放,对糙米粉色度产生一定影响。3 种原料经过预酶解-挤压膨化后亮度值均显著增加,其中色素含量低、颜色更白的糙米原料红/绿值和黄/蓝值显著降低,说明预酶解处理实际上抑制了挤压膨化过程中的非酶褐变。红米和黑米中花青素、花色苷和原花色素等有色物质含量丰富[30-32],淀粉酶分解淀粉的过程对这些物质具有一定的释放作用,所以其红/绿值和黄/蓝值显著升高,普通糙米中这些色素物质含量很低,则未表现出这种现象。
2.6 预酶解-挤压膨化对糙米粉淀粉、还原糖、总蛋白质、可溶性蛋白含量和糊化度的影响
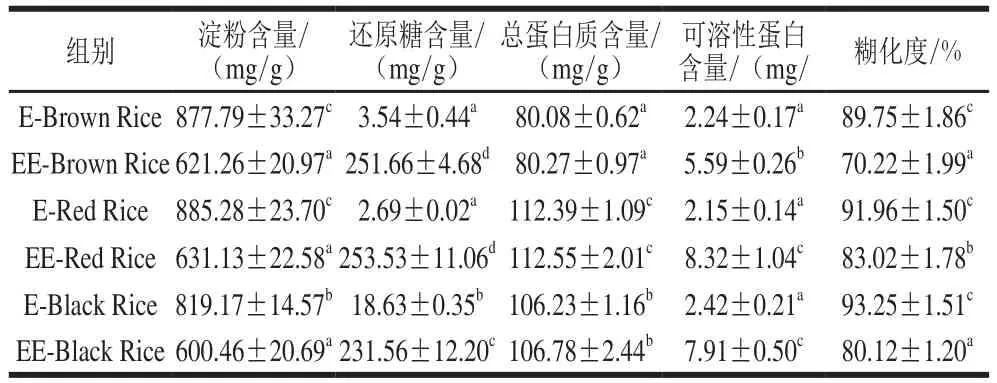
表5 预酶解-挤压膨化对糙米粉淀粉、还原糖、总蛋白质、可溶性蛋白含量和糊化度的影响Table5 Effect of enzymatic pretreatment and extrusion on the contents of starch, reducing sugar and soluble/total protein,and gelatinization degree of brown rice fl our
如表5所示,与对照组相比,预酶解-挤压膨化处理显著降低了3 种糙米粉的淀粉含量(P<0.05),普通糙米、红米和黑米3 种糙米粉淀粉含量分别降低了29.22%、28.71%和26.70%;显著提高了3 种糙米粉的还原糖含量(P<0.05),普通糙米、红米和黑米3 种糙米粉还原糖含量分别升高了70.09、93.25 倍和11.43 倍;显著提高了3 种糙米粉的可溶性蛋白含量(P<0.05),普通糙米、红米和黑米3 种糙米粉可溶性蛋白含量分别提高了1.50、2.87 倍和2.27 倍;增加了3 种糙米粉的总蛋白质含量,但差异不显著;显著降低了3 种糙米粉的淀粉糊化度(P<0.05),普通糙米、红米和黑米3 种糙米粉淀粉糊化度分别降低了19.53%、8.94%和13.13%。
预酶解-挤压膨化过程中超过1/4的淀粉发生了水解。淀粉水解直接表现为淀粉含量的显著降低和还原糖含量的显著升高,而淀粉糊化度的降低和可溶性蛋白含量的提高则源于淀粉水解的间接作用。淀粉水解使与其紧密结合的蛋白质暴露、分离[33],导致可溶性蛋白含量提高。淀粉糊化度的降低有两方面原因:一方面,物料在预酶解过程中受到湿热作用,粉质变软,挤压过程中的压力和温度降低;另一方面,糊化的淀粉被水解也是淀粉糊化度降低的一个重要因素[34]。
2.7 预酶解-挤压膨化对糙米粉淀粉体外消化特性的影响
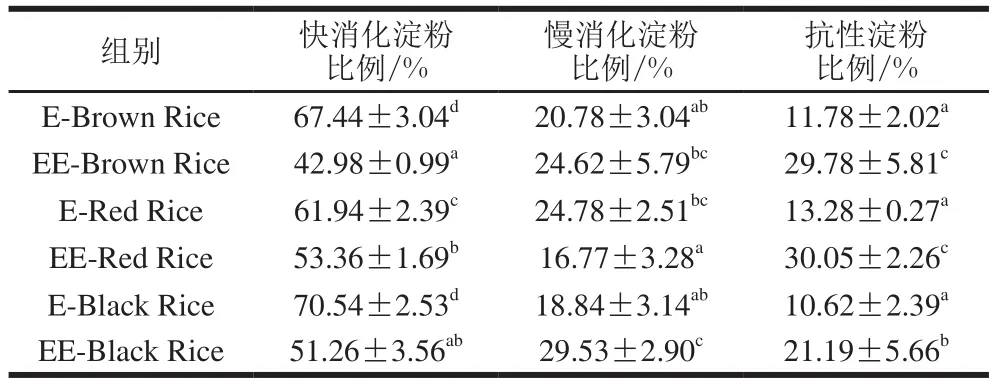
表6 预酶解-挤压膨化对糙米粉淀粉体外消化特性的影响Table6 Effect of enzymatic pretreatment and extrusion on starch digestibility in vitro of brown rice fl our
如表6所示,与对照组相比,预酶解-挤压膨化处理显著降低了3 种糙米粉快消化淀粉的比例(P<0.05),普通糙米、红米和黑米3 种糙米粉快消化淀粉的比例分别降低了36.27%、13.85%和27.33%;显著提高了3 种糙米粉抗性淀粉的比例(P<0.05),普通糙米、红米和黑米3 种糙米粉抗性淀粉的比例分别提高了152.80%、126.28%和99.53%;提高了普通糙米和黑米糙米粉慢消化淀粉的比例(分别提高了18.48和56.74%),但红米糙米粉慢消化淀粉的比例显著降低(P<0.05)。预酶解-挤压膨化减慢了糙米粉淀粉的体外消化速率。
预酶解-挤压膨化对糙米粉淀粉体外消化的影响主要由两方面原因造成:一方面,如2.6节所述,淀粉水解的间接作用导致淀粉糊化度的降低,虽然未糊化的淀粉也能够被体外消化过程中的淀粉酶水解,但是其水解速率远低于糊化后的淀粉;另一方面,淀粉含量降低的同时,糊精、麦芽糖、葡萄糖等小分子产物含量增加,体外消化模型的本质是酶促反应,底物浓度的降低和产物浓度的升高均能降低酶促反应的速率。红米糙米粉慢消化淀粉的比例显著降低,与其他两种原料的变化趋势相反,其原因可能是原料种类不同,造成淀粉体外消化速率随时间变化的趋势稍有不同,经过特定反应时间段的计算,得到慢消化淀粉比例下降的结果,但总体趋势依然是淀粉体外消化速率减慢,快消化淀粉比例降低。
2.8 预酶解-挤压膨化对糙米粉蛋白质体外消化特性的影响
如图3所示,与对照组相比,预酶解-挤压膨化提高了3 种糙米粉的蛋白质体外消化速率,且显著提高了胃和肠消化终点处的消化率。肠消化终点处普通糙米、红米和黑米3 种糙米粉的蛋白质体外消化率分别由72.55%、74.43%和70.68%提高至85.20%、83.06%和79.97%。

图3 预酶解-挤压膨化对糙米粉蛋白质体外消化特性的影响Fig.3 Effect of enzymatic pretreatment and extrusion on protein digestibility in vitro of brown rice fl our
如2.6节所述,预酶解-挤压膨化过程中淀粉的水解释放了一定量的蛋白质。这些蛋白质本来与淀粉互相结合而存在,淀粉被水解、结构变松散之后,与这部分淀粉相结合的蛋白质变为游离态。同时,预酶解过程中的湿热作用也可能使蛋白质发生一定的热变性,从而使蛋白质的结构变松散、酶切位点更多地暴露出来,体外消化过程中更易被蛋白酶水解,导致蛋白质体外消化速率和最终消化率均有所提高。
2.9 预酶解-挤压膨化对糙米粉感官评分的影响

表7 预酶解-挤压膨化对糙米粉淀粉感官评分的影响Table7 Effect of enzymatic pretreatment and extrusion on sensory evaluation scores of brown rice fl our
如表7所示,与对照组相比,预酶解-挤压膨化显著提高了3 种糙米粉的冲调性单项评分和加权综合评分(P<0.05),但对色泽、气味和口感没有显著影响,综合感官评分的提高主要源于预酶解-挤压膨化对糙米粉冲调性的改善。
3 结 论
预酶解-挤压膨化处理使糙米粉的W S I显著提高(P<0.05),WAI、分散时间和米糊黏度显著降低(P<0.05),冲调分散性得到极大改善,冲调性评分和综合感官评分显著提高(P<0.05)。普通糙米、红米和黑米3 种糙米粉的WSI分别提高了2.04、1.35 倍和1.71 倍,WAI分别降低了67.87%、60.96%和62.17%,分散时间分别缩短了66.61%、61.79%和64.30%。
预酶解-挤压膨化使红米和黑米糙米粉的亮度值、红/绿值和黄/蓝值均显著升高(P<0.05),但普通糙米粉的亮度值显著升高(P<0.05),而红/绿值和黄/蓝值显著降低(P<0.05),3 种糙米粉的色差值均大于3。
预酶解-挤压膨化处理使糙米粉的淀粉含量和糊化度显著降低(P<0.05),还原糖、可溶性蛋白含量显著提高(P<0.05),淀粉体外消化速率减慢,快消化淀粉比例显著降低(P<0.05),蛋白质体外消化速率加快,消化率提高。普通糙米、红米和黑米3 种糙米粉的可溶性蛋白含量分别提高了1.50、2.87 倍和2.27 倍,淀粉含量分别降低了29.22%、28.71%和26.70%。
本研究结果可为改善糙米粉食用品质、拓宽糙米的加工利用途径提供指导。

