Th22细胞及IL-22因子在原发性肝细胞肝癌发生发展中的表达及意义
施振静,吴道义,吴丽丽,乔彬彬,郑冰汝,李成,施昌盛,虞希祥
(1.温州医科大学附属第三医院 介入科,浙江 温州 325200;2.温州医科大学附属第三医院 胃肠外科,浙江 温州 325200;3.温州医科大学附属第三医院 放化疗科,浙江 温州 325200;4.宁陵县人民医院 肿瘤科,河南 商丘 310006;5.温州医科大学附属第一医院 介入科,浙江 温州 325015;6.温州市人民医院 血管介入科,浙江 温州 325699)
原发性肝癌是常见的恶性肿瘤,我国80%~90%的肝癌由乙型肝炎引起,长期慢性炎症反应引起的恶变及免疫监视逃逸是肝癌形成的重要原因[1]。肝炎、肝硬化的炎症微环境是引发肝细胞恶性表型的重要因素[2]。具有免疫监视作用的辅助性T细胞(T helper cell,Th cell)参与肝癌免疫逃逸并与肿瘤的发生密切相关[3-4]。此外,Th细胞分泌的细胞因子也是炎症反应中的重要调节因子[5]。本研究旨在研究肝癌患者中的Th细胞和IL-22水平及其临床意义。
1 资料和方法
1.1 对象 选取2015年1月至2016年12月于温州医科大学附属第三医院就诊并经临床病理检查确诊为肝细胞肝癌伴慢性乙型肝炎、乙肝肝硬化患者(肝癌组)38例,其中男26例,女12例;年龄39~61(60.6±16.8)岁。同时收集同一时期于我院就诊经临床病理检查确诊为慢性乙型肝炎肝硬化患者42例(肝硬化组),其中男22例,女18例,年龄38~56(48.2±14.8)岁,均符合慢性乙型肝炎肝硬化诊断标准,就诊前无抗病毒治疗史。选取我院体检中心同一时期的健康受检者30例(健康对照组),其中男18例,女12例,年龄36~61(45.97±11.65)岁。选取于我院门诊同一时期就诊的慢性乙肝患者(慢性乙肝组)21例,其中男12例,女9例,年龄33~59(47.2±19.4)岁。4组受检者排除标准:合并HIV、HCV或HDV感染;伴有其他恶性肿瘤或严重疾病;酗酒、吸毒患者。4组性别和年龄均具有可比性。收集本院检验科所检测4组受检者临床相关指标,包括谷草转氨酶(glutamic oxalacetic transaminase,AST)、谷丙转氨酶(glutamic-pyruvic transaminase,ALT)、总胆红素(total bilirubin,TBIL)和白蛋白(albumin,ALB)信息。本研究经本院伦理委员会批准,所有受检者均知情同意。
1.2 主要试剂 人IL-22 ELISA试剂盒购自上海苏贤生物科技有限公司,人淋巴细胞分离液购自触凯生物科技(上海)有限公司,PBS液购自美国Hyclone公司,离子霉素、莫能霉素、TMB、固定剂和破膜剂购自美国Sigma公司,FITC标记鼠抗人CD4单抗、PE标记鼠抗人IL-22购自上海旦震生物科技有限公司。
1.3 方法
1.3.1 血液收集处理:所有受检者于清晨空腹(住院患者为治疗前)肘静脉采血10 mL并用肝素抗凝管收集为2份,每份5 mL。一份标本在采集后的1~2 h以2 000 r/min离心15 min,分离血清,冷冻保存用于ELISA检测。另一份用于分离及培养外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。
1.3.2 ELISA检测IL-22表达水平:将人抗IL-22抗体覆盖在96孔板上,注入标准品或血清样本到孔中,使样品中的IL-22与固定抗体结合。洗涤液清洗96孔板后添加生物素标记的人抗IL-22抗体孵育。洗涤液清洗未结合的生物素抗体,并在孔中加入过氧化物酶共轭链霉亲和素孵育。再次清洗96孔板,加入TMB底物溶液,每孔显色的深浅与所结合的IL-22的数量成剂量关系。在450 nm处检测吸光度值,根据标准曲线测定IL-22浓度。
1.3.3 分离及培养PBMC:取外周血去血浆,用淋巴分离液分离出人PBMC层,分离出的液体可形成4层。小心取出中间白膜层,即为PBMC层,然后将PBMC接种到培养板里孵育4 h。
1.3.4 流式细胞仪检测:将孵育好的PBMC培养板内的细胞用PBS洗涤沉淀制成106/mL的细胞悬液,分别移至流式管中,每管放置2×105个细胞,分别加入4 μL CD4-PerCP、固定剂和破膜剂,再分别加入1 μL IL-22-PE室温孵育30 min,将染色后的细胞群上机检测,并用Flowjo 7.6.1软件分析各细胞。
1.4 统计学处理方法 采用SPSS 20.0统计学软件进行分析。计量资料以±s表示,2组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床指标检测结果 4组受检者AST、ALT、TBIL和ALB差异有统计学意义(P<0.05),其中肝硬化组和肝癌组患者AST、ALT、TBIL和ALB显著高于慢性乙肝组和健康对照组,差异有统计学意义(P< 0.01);肝癌组患者AST、ALT、TBIL和ALB高于肝硬化组,差异有统计学意义(P<0.01);慢性乙肝组和健康对照组间差异无统计学意义(P>0.05)。此外,我们还发现随着肝癌的发生发展患者的AST、ALT、TBIL和ALB逐渐升高。见表1。
2.2 流式细胞仪检测结果 健康对照组、慢性乙肝组、肝硬化组及肝癌组外周血Th22细胞含量差异有统计学意义(P<0.05);其中肝癌组及肝硬化组的外周血Th22高于慢性乙肝组和健康对照组,差异有统计学意义(P<0.05);肝癌组外周血Th22高于肝硬化组,差异有统计学意义(P<0.05)。慢性乙肝组的Th22细胞含量与健康对照组差异无统计学意义(P>0.05)。见图1。此外,我们还发现随着肝癌的发生发展,外周血Th22细胞含量逐渐升高。
表1 健康对照组、慢性乙型肝炎肝硬化患者和肝癌患者肝功能指标(±s)

表1 健康对照组、慢性乙型肝炎肝硬化患者和肝癌患者肝功能指标(±s)
与健康对照组比:aP<0.05;与慢性乙肝组比:bP<0.05;与肝硬化组比:cP<0.05
组别 n ALT/(U/L) AST/(U/L) TBIL(μmol/L) ALB/(g/L)健康对照组 30 24.33±11.32 18.76±14.67 11.64± 6.82 41.57±25.64慢性乙肝组 21 37.29±19.87 29.11±21.46 15.31±10.58 50.33±32.86肝硬化组 42 109.12±75.81ab 83.56±51.42ab 29.34±13.45ab 67.64±48.61ab肝癌组 30 265.48±91.56abc 195.21±86.45abc 55.17±28.46abc 89.56±63.41abc

图1 4组受检者外周血Th22细胞含量的比较
2.3 ELISA法检测结果 4组受检者外周血IL-22表达水平差异有统计学意义(P<0.05)。其中肝癌组及肝硬化组的外周血IL-22表达水平高于健康对照组,差异有统计学意义(P<0.05);肝癌组外周血IL-22表达水平高于肝硬化组,差异有统计学意义 (P<0.05)。慢性乙肝组的IL-22表达水平与健康对照组差异无统计学意义(P>0.05)。见图2。此外,我们还发现随着肝细胞肝癌的发生发展,外周血IL-22水平逐渐升高。
2.4 肝癌组Th22含量和IL-22水平组内分析 根据巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分期[6]将本研究中纳入的38例肝癌患者分为早期(n=11)和中晚期(n=27),并对血清中Th22含量和IL-22表达水平进行比较。结果显示,早期肝癌患者外周血Th22含量和IL-22表水平低于中晚期肝癌患者,差异有统计学意义(P<0.05)。见图3。
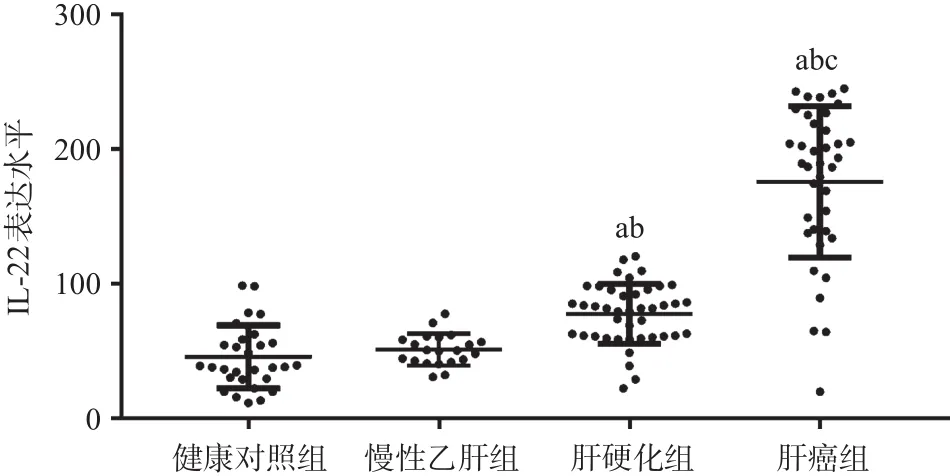
图2 4组受检者外周血IL-22表达水平的比较
3 讨论

图3 不同BCLC分期肝细胞肝癌患者外周血Th22细胞含量(A)和IL-22表达水平(B)的比较
Th细胞是T细胞的一种,其主要表面分子标记是CD4,激活后可分泌多种细胞因子以协助或调节免疫反应,目前发现Th细胞至少存在4种亚型,分别为Th1、Th2、Th17和Th22。Th1细胞主要分泌INF-γ、TNF-β、IL-2等细胞因子并参与细胞免疫,在抗肿瘤免疫反应中起到重要的作用;Th2细胞主要分泌IL-4、IL-5、IL-13等细胞因子并参与体液免疫,具有抗Th1细胞的作用[3]。生理状态下,Th1/Th2比例处于平衡状态;而在肿瘤发生发展的过程中,存在着Th1/Th2漂移现象,Th1的相对减少可使机体对肿瘤细胞的免疫监视功能削弱[7-9]。Th17主要分泌IL-17、IL-4、IL-22和TNF-α等细胞因子,其在胃癌、急性白血病、卵巢癌等多种肿瘤中明显增高,目前已有针对Th17细胞分化的调控分子的诸多报道[10-12]。 Th22细胞是发现于2009年的Th细胞亚群,因其主要分泌IL-22而得名,人体约65%的IL-22由Th22细胞分泌[13]。Th22细胞表面标志为CD4+,CCR6、CCR4和CCR10,除分泌IL-22外,还可分泌IL-10、IL-6、IL-13等多种细胞因子,但不产生IFN-γ、IL-4和IL-17[13]。Th22细胞主要通过IL-22发挥作用,IL-22的靶细胞为皮肤、胰腺、肝脏等组织细胞,在感染免疫、组织修复等方面起到重要作用[14]。在生理状态下,Th22细胞与其他Th细胞亚群互相调控,使机体处于平衡状态。
Th22细胞介导了多种由上皮细胞参与的自身免疫性和慢性炎症性疾病的发生发展[15]。研究证实,在刀豆蛋白A(ConA)及四氯化碳诱导的肝炎中,IL-22具有抑制炎症反应和保护肝细胞的作用[16-17]。但在慢性乙型病毒性肝炎中,其作用存在着争议:有学者认为IL-22能够促进非特异性炎症细胞浸润,并放大特异性细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)的效应,从而促进由炎症反应引起的肝损[18-19];而有些学者则认为,肝炎患者IL-22浓度的增高是在炎症反应诱导下的代偿性增高,其实质是肝细胞保护性细胞因子,在肝炎中起到抑制肝脏炎症反应并参与肝组织损伤修复的作用[20]。RADAEVA等[17]通过阻断肝脏中的IL-22表达进行研究,发现信号转导及转录激活子3(signal transduction and transcriptional activator,STAT3)在肝组织中的表达降低,肝组织损伤加重;而注射重组IL-22后,肝组织的损伤程度又降低,这一结果提示IL-22具有保护甚至修复肝组织的作用。本研究中,乙肝肝硬化患者及肝癌伴肝硬化患者的Th22细胞及IL-22因子均高于慢性乙型肝炎患者和健康受检者,而慢性乙型肝炎与健康受检者之间却并无差异,说明Th22细胞及IL-22因子主要在肝硬化和肝癌的发生发展过程中呈现差异表达,其具体机制如何,是炎症反应诱导下的代偿性增高,还是机体的损伤修复作用的表现,需要进一步的研究证实。
JIANG等[21]通过长期观察从肝炎发展至肝细胞肝癌的小鼠模型,发现IL-22在促进肝细胞损伤后修复的同时,却加速了肝细胞从慢性炎症向肝细胞肝癌的转化,认为IL-22可能促进了肝细胞肝癌的发生、发展,但其中的机制尚不明确。有临床研究报道,肝细胞肝癌伴肝硬化组织中的Th22细胞含量及IL-22表达水平高于周围正常肝组织,肝细胞肝癌伴肝硬化患者外周血中的Th22细胞及IL-22水平亦高于正常人群,提示体内Th22细胞含量与肝细胞肝癌之间存在相关性[22]。而RADAEVA等[17]发现,在肝癌细胞株HepG2中,过表达的IL-22通过激活STAT3信号转导通路而诱导抗凋亡反应,通过促进有丝分裂蛋白(myc,cyclin D1,Rb2,CDK4)的表达而促进肝癌细胞的生长。本研究中肝癌伴肝硬化患者的Th22细胞含量及IL22表达水平均高于乙肝肝硬化患者,且早期肝癌中Th22细胞含量及IL-22表达水平显著低于中晚期肝癌,提示其与肝细胞癌存在正相关性,但其高表达是肿瘤发生发展过程中的伴随现象,还是与JIANG等[21]的小鼠模型中情况类似,为一种促癌机制,则需要更多的研究来阐述。

