辣木叶提取液在发酵过程营养成分及其抗氧化活性的变化
李 倩,夏杏洲,周 伟 ,廖良坤,李积华,彭芍丹,郭长青
(1.广东海洋大学食品科技学院,广东湛江524088;2.中国热带农业科学院农产品加工研究所,广东湛江524001;3.农业部热带作物产品加工重点实验室,广东湛江524001;4.河南金辣木生物科技有限公司,河南鹤壁458000)
辣木(Moringa oleifera)是一种具有独特经济价值的热带植物,含有丰富的蛋白质,维生素,矿物质[1]等。辣木也含有多种天然抗氧化物质,如类胡萝卜素,酚类、黄酮类、植物甾醇、苷类、多糖等[2-4],具有抗氧化、抗炎、抗菌、抗病毒、抗肿瘤、抗癌、降血脂、降血压等生物学功能[5-6]。
乳酸菌是一种能将糖类转化为乳酸的益生菌,被广泛的应用于发酵食品的行业。乳酸菌发酵能产生独特的风味。例如赵福利等[7]利用植物乳杆菌发酵燕麦,得到一款风味独特、感官评价高的发酵燕麦型饮料。乳酸菌发酵制品还具有许多益生功能,如抗氧化活性、抑菌活性、抗血栓、抗高血压,降低胆固醇等功能。刘海燕[8]研究发现经乳酸菌发酵的豆粕抗氧化能力比未发酵的有显著提高(p<0.05)。Upadhyay等[9]选取5株乳酸菌进行单增李斯特菌对肠细胞的粘附和侵袭的试验,结果显示5株乳酸菌均有抗菌效果。因此,选用乳酸菌作为发酵剂,不仅天然、安全,还能开发出具有更高生物活性的产品。目前辣木主要应用在保健食品及药品,禽畜饲料,水质净化,日化用品上[10-11]。目前研究辣木发酵物功能活性国内外已有报道。Joung等[12]报道,发酵辣木提取物能降低高脂饮食诱导的肥胖小鼠的肝脏肥胖和改善葡萄糖耐受量。刘佩佩等[13]研究了辣木发酵物对大鼠生长发育,骨骼代谢的影响。但对辣木发酵物的活性物质和抗氧化能力的研究未见报道。
本研究对乳酸菌发酵辣木叶提取液过程中pH,固形物含量,总酸等基本理化性质进行检测,分析了发酵过程中还原糖、黄酮、多酚、有机酸等营养成分的变化,研究了乳酸菌发酵对辣木DPPH清除能力,羟自由基清除能力,超氧阴离子清除能力的影响,为辣木发酵制品的研发提供了技术指导,同时也拓展了辣木精深加工产业的领域。
1 材料与方法
1.1 材料与仪器
辣木叶 由河南金辣木生物科技有限公司提供;植物乳杆菌S35 购于中国工业微生物菌株保藏管理中心;MRS营养肉汤、MRS培养基 广东环凯微生物科技有限公司;硝酸铝、氢氧化钠、亚硝酸钠、碳酸钠、无水乙醇、酒石酸钾钠、无水亚硫酸钠 广东光华科技股份有限公司;草酸(纯度≥99.0%)、柠檬酸(纯度≥99.5%)、琥珀酸(纯度≥99.5%)、丙酮酸(纯度≥99.0%),乳酸(纯度≥91.2)、乙酸(纯度≥99.9%)、没食子酸(纯度≥99.9%)、葡萄糖(纯度≥99.5%)、芦丁(纯度≥99.5%)、福林酚 美国Sigma公司;酚酞、磷酸、DPPH(纯度≥97.0%)、3,5 二硝基水杨酸、苯酚 美国阿拉丁工业公司;羟自由基测定试剂盒、抗超氧阴离子自由基测试盒 南京建成生物有限公司。
万能高速粉碎机 上海菲力博食品有限公司;HG-50全自动高压蒸汽灭菌锅 日本Hirayama公司;ZHJH-C1115B超净工作台 上海智城分析仪器制造公司;Atago PAL-3糖度计 日本Atago公司;梅特勒FE20-FiveEasy PlusTMp H计 美国Mettler Toledo公司;UV-1780型紫外可见分光光度计 日本Shimadzu公司;3-30K型低温高速离心机 德国Sigma公司;LC-20A高效液相色谱 日本岛津公司;Benson有机酸分离色谱BP-OA Waters中国有限公司。
1.2 实验方法
1.2.1 原料处理 辣木速溶粉制备工艺:干燥辣木叶→拣选→粉碎→过筛→加水→蒸煮→浓缩→过滤→辣木叶提取液→真空干燥
选取无斑点、无虫蛀的辣木叶,经过粉碎机粉碎5 min后过80目筛,然后以辣木粉∶水为1∶15(质量比)进行蒸煮提取,提取1 h,再将辣木汁过滤,取上清液得到辣木叶提取液,浓缩液在60℃下真空干燥24 h后得到辣木叶速溶粉。
1.2.2 辣木叶提取液的制备 称取干燥好的辣木叶速溶粉∶蒸馏水=1∶25(质量比)制成辣木叶提取液,于121℃下灭菌15 min。在超净工作台中接入1%的植物乳杆菌S35,于37℃恒温培养箱培养培养72 h。分别在接种后 0、8、16、24、32、40、48、56、64、72 h定时无菌操作取出50 mL,以10000 r/min,15℃条件下离心15 min,取上清液,于4℃冰箱备用。
1.2.3 基本理化性质 检测辣木叶提取液发酵过程中p H、总酸、可溶性固形物含量的变化,利用p H计来测定辣木液发酵过程中的pH。利用糖度计来测定发酵期间的可溶性固形物含量。总酸的测定按照GB/T 12456-2008《食品安全国家标准食品中总酸的测定》[14]。
1.2.4 营养成分
1.2.4.1 还原糖测定 采用DNS试剂法[15]测定样品中的还原糖。标准曲线的制作:精密称取预先干燥至恒重的葡萄糖0.1 g,用双蒸水定容至100 mL,得到1 mg/mL的葡萄糖母液,再进一步梯度稀释成0.5、0.4、0.3、0.2、0.1、0.05 mg/mL 的标准品工作液。取2 mL不同浓度的标准溶液加入25 mL的具塞试管中,再加入2 mL的DNS试剂摇匀,置沸水浴中加热煮沸7 min,取出流水冷却,用双蒸水定容至25 mL,于540 nm波长下检测,记录吸光度。以葡萄糖的含量来测定样品中还原糖含量,按照标准曲线线性方程y=0.9488x-0.0434(R2=0.9954)来测定还原糖的含量,其中 x为样品质量浓度(mg/mL),Y为吸光度。
样品的测定:精密的吸取辣木叶提取液2 mL,按照上述的方法进行操作并测定吸光度,每个实验重复三次。
1.2.4.2 总黄酮的测定 标准曲线的制作:精密称取预先干燥至恒重的芦丁10 mg,加甲醇定容至100 mL,得到100 mg/L的芦丁母液,再进一步梯度稀释成60、48、36、24、12 mg/L 的标准品工作液。取0.5 mL不同浓度的工作液于10 mL的容量瓶中,加入少量的双蒸水,先加入0.5 mL浓度为5 g/100 mL的NaNO2溶液,摇匀,静置6 min,再加入0.5 mL浓度为0.1 g/mL Al(NO3)3溶液,摇匀,静置6 min后,加入4 mL浓度为4 g/100 mL的NaOH溶液,然后用蒸馏水定容至10 mL,于510 nm处检测[16]。以芦丁标准品计算总黄酮含量,按照标准曲线线性方程y=0.0077x+0.0549(R2=0.999)来测定黄酮含量,其中x为样品质量浓度(mg/L),Y为吸光度。
样品的测定:精密的吸取辣木叶提取液0.5 mL,按照上述的方法进行操作并测定吸光度,每个实验重复三次。
1.2.4.3 多酚的测定 采用福林酚法[17]测定多酚含量。标准曲线的制作:精密称取预先干燥至恒重的没食子酸 2 mg,加双蒸水定容至 100 mL,得到20 mg/L的没食子酸母液,再进一步梯度稀释成6.0、4.0、3.2、2.4、1.6、0.8 mg/L 的标准品工作液。取 1 mL不同溶度的标准溶液于25 mL容量瓶中加入10 mL 10%的福林酚。再加入8 mL的7%NaCO3溶液,放置1 h,在765 nm处测吸光值。以没食子酸标准品计算总多酚含量,按照标准曲线线性方程y=0.0988x-0.0099(R2=0.9992)来测定总酚含量,其中x为样品质量浓度(mg/L),Y为吸光度。
样品的测定:精密的吸取辣木叶提取液1 mL,按照上述的方法进行操作并测定吸光度,每个实验重复三次。
1.2.4.4 有机酸的测定 采用HPLC法并参照马丽娜等[18]测定方法略作修改,色谱条件:流动相为0.8%的磷酸水溶液,等梯度洗脱,流速0.5 mL/min,紫外检测器,检测波长210 nm,柱温30℃,进样量10 μL,柱子:BP-OA 2000-0(300 mm ×7.8 mm)。
标准溶液的制备:准确的称取10.0 mg草酸、乳酸、乙酸、柠檬酸、丙酮酸、琥珀酸,加入超纯水定容到10 mL,得到1 mg/mL的有机酸母液,再进一步梯度 稀 释 成,0.8 mg/mL,0.6 mg/mL,0.4 mg/mL,0.2 mg/mL;样品的测定:吸取辣木叶提取液5 mL,10000 r/min离心15 min,取1 mL上清液,并用流动相稀释3倍,过0.22μm尼龙膜过滤,上机分析。
1.2.5 体外抗氧化活力
1.2.5.1 DPPH清除能力 参照岳秀洁[19]的方法并加以改进,将19.72 mg的DPPH溶于250 mL无水乙醇中,配制成DPPH工作液,将1 mL样品加入2 mL进行反应,于517 nm处测定,吸光值为A1,以无水乙醇代替DPPH加入样品中,扣除样品溶液的本底吸收,吸光值为A2。用相同体积的蒸馏水代替样品作为对照组,吸光值为A0,DPPH清除率计算公式如下:
清除率(%)=[1-(A1-A2)/A0]×100
1.2.5.2 羟自由基清除能力 将发酵过程中各个阶段的辣木叶提取液在10000 r/min,15℃条件下离心15 min,合并上清液,并用超纯水稀释80倍后得到待测样品,采用羟自由基测定试剂盒测定羟自由基清除率。
1.2.5.3 超氧阴离子清除能力 将发酵过程中各个阶段的辣木叶提取液在10000 r/min,15℃条件下离心15 min,合并上清液,并用超纯水稀释10倍后得到待测样品,采用抗超氧阴离子自由基测试盒测定超氧阴离子清除率。
1.3 数据处理
每个实验重复三次取平均值,实验结果以平均值±标准差表示,实验数据采用Origin 8软件进行数据分析作图。
2 结果与讨论
2.1 辣木叶提取液发酵特性动态研究
pH和总酸是乳酸菌发酵的重要参数,同时直接影响着微生物的生长和代谢过程[20]。从图1可以看出,随着发酵时间的延长,pH和可溶性固形物含量整体呈下降的趋势,总酸呈现整体上升的趋势。p H在0~24 h下降幅度较大,由5.8降至4.2,24 h之后下降幅度减小,最终p H为3.7。总酸在发酵过程中呈上升趋势,在发酵时间为0~32 h之间上升较快,从3.17 g/L上升至5.88 g/L。可溶性固形物含量从4.5%下降至3.6%。在发酵时间0~32 h,由于底物充足,乳酸菌利用碳源和氮源快速繁殖,并在生长的过程中产生各种有机酸,尤其是乳酸,使得pH迅速下降,总酸不断上升,可溶性固形物含量减少。32 h之后,随着发酵时间的增加,总酸的不断累积以及底物的消耗,使得这种酸性环境不适宜乳酸菌的大量生长,发酵速度减慢,发酵液的可溶性固形物含量和p H下降幅度逐渐减缓,总酸缓慢增加[21]。
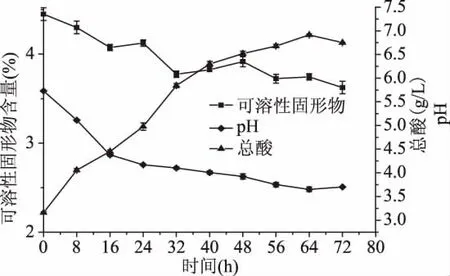
图1 发酵时间对辣木叶提取液pH、可溶性固形物、总酸的影响Fig.1 Effect of fermentation time on pH,soluble solids and total acid of Moringa oleifera leaf extract
2.2 发酵对辣木叶提取液营养成分的影响
2.2.1 发酵过程中还原糖含量的变化 如图2所示,在辣木叶提取液的发酵过程中,还原糖的含量呈下降的趋势,在0~16 h,乳酸菌生长迅速,大量消耗还原糖,尤其是葡萄糖;在16~32 h,由于菌种达到稳定期,消耗速率减慢。而在32~40 h还原糖出现短暂的上升趋势,这与丁艳如等[22]在对红茶发酵过程中还原糖的含量变化相似。在发酵40 h之后,还原糖又开始下降,这是可能是由于还原糖的大量减少,使得乳酸菌将辣木叶提取液中的多糖转化为还原糖供其生长[23]。
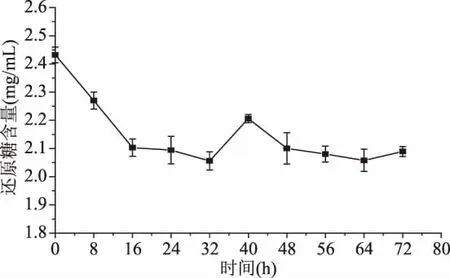
图2 发酵时间对辣木叶提取液还原糖含量的影响Fig.2 Effect of fermentation time on reducing sugar content of Moringa oleifera leaf extract
2.2.2 发酵过程中黄酮含量的变化 由图3可知,辣木叶提取液中黄酮含量整体随发酵时间的增加呈现先升后降的趋势,在整个发酵过程中,黄酮均高于未发酵的辣木叶提取液,其含量在发酵24 h达到最高,此时含量为 223.11 mg/L,相比未发酵的提高了45%,这是由于发酵过程生成黄酮糖苷类物质。随着发酵时间的延长,黄酮含量开始迅速下降,最终黄酮含量下降至170 mg/L,这是由于乳酸菌分泌了β-葡萄糖苷酶、β-葡萄糖醛酸苷酶、葡萄糖碳苷酶等多种糖苷酶,使得黄酮糖苷物分解为苷元,导致黄酮含量急剧下降[24]。在发酵48~72 h后黄酮含量下降趋势变缓,可能是有机酸的大量积累,pH降低,导致发酵液中分解黄酮的酶类活力降低。

图3 发酵时间对辣木叶提取液黄酮含量的影响Fig.3 Effect of fermentation time on flavonoid content of Moringa oleifera leaf extract
2.2.3 发酵过程中多酚含量的变化 微生物发酵是生产抗氧化酚类化合物的重要途径[25]。如图4所示,在整个发酵过程中,辣木叶提取液的多酚含量呈现先上升后下降的趋势,多酚含量均高于未发酵的辣木叶提取液,其含量在发酵32 h达到最高,为100.60 mg/L,比未发酵的提高了21%,这由于微生物的生长繁殖过程代谢产生了多酚类物质。在发酵32~48 h,可能是乳酸菌代谢中会产生分解多酚的酶类如多酚氧化酶,这些酶类将多酚分解成更小的物质,而引起多酚浓度降低。在48~72 h,多酚含量趋于平稳,这是由于发酵过程中代谢产物尤其是有机酸的累积,使得环境中分解多酚酶催化能力减弱。此结论与李雪等[26]关于仙人掌果酒发酵过程中总酚变化的结论一致。
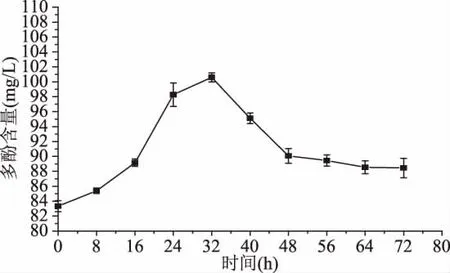
图4 发酵时间对辣木叶提取液多酚含量的影响Fig.4 Effect of fermentation time on polyphenol content in Moringa oleifera leaf extract
2.2.4 发酵时间对辣木叶提取液有机酸的影响 从表1可知,草酸在整个发酵过程中呈现波动性变化,经发酵的草酸浓度均高于未发酵的辣木提取液。柠檬酸在发酵过程中先上升后下降,在8 h达到最高,这可能是乳酸菌将丙酮酸代谢成柠檬酸的速度大于柠檬酸进入三羧酸循环的速度。在发酵32 h,柠檬酸已代谢消失,这是由于柠檬酸经柠檬酸脱氢酶代谢为乙酸、2,3-丁二酮等物质。丙酮酸在发酵过程中先下降后趋于平稳,在发酵0~24 h期间急剧下降,在这段期间乳酸菌产生乳酸脱氢酶,直接将丙酮酸转化为乳酸[27]。琥珀酸是未发酵辣木叶提取液中主要的有机酸,初始含量达410.65 mg/L。在发酵过程中呈现下降的趋势,经发酵32 h,琥珀酸已代谢消失,这可能是琥珀酸在三羧酸循环经琥珀酸脱氢酶形成延胡索酸并产生能量供乳酸菌生长[28]。从表1可知,在经过发酵16 h之后,乳酸变成辣木叶提取液中含量最多的有机酸,当发酵40 h时,乳酸含量达到最大值,为135.43 mg/L,这是由于乳酸菌在生长繁殖的过程中,葡萄糖经糖酵解成为丙酮酸,后者被乳酸脱氢酶还原为乳酸,导致乳酸不断增加[29]。乳酸是由乳酸菌发酵所产生的,不仅可以改善辣木叶提取液的风味,而且也是发酵制品中重要的风味物质。

表1 发酵时间对辣木叶提取液有机酸的影响Table 1 Effects of fermentation time on organic acids in Moringa oleifera leaf extract
2.3 发酵对辣木叶提取液抗氧化活力的影响
2.3.1 发酵对辣木叶提取液DPPH清除能力的影响 DPPH是一种很稳定的氮中心的自由基,常用于抗氧化成分的体外活性评价。如图5所示,整个发酵过程,DPPH清除能力呈现先上升后下降的趋势,经发酵的辣木叶提取液DPPH抗氧化能力均高于未发酵的。发酵32 h,DPPH清除能力达到最高,清除率为89%,比未发酵的提高了16%,这与发酵中产生的酚类物质有关。酚类物质能很容易地给出1个氢离子,并通过共振杂化而稳定,这是具有高自由基清除能力的主要原因[28]。随着发酵的继续,DPPH清除能力开始下降,最终降至79%左右,可能是黄酮类物质的不稳定性和发酵过程中产生了分解酚类物质的酶,导致 DPPH 清除率下降[30]。
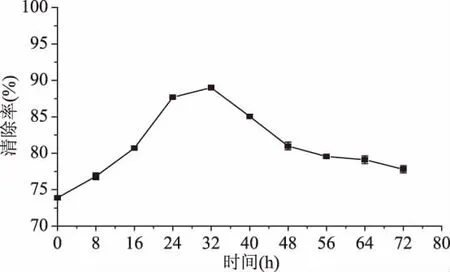
图5 发酵时间对辣木叶提取液DPPH清除能力的影响Fig.5 Effects of fermentation time on the DPPH scavenging ability of Moringa oleifera leaf extract
2.3.2 发酵对辣木叶提取液羟自由基清除能力的影响 羟自由基系活性氧的一种,具有极高的氧化能力,可以杀死红细胞、降解DNA、破坏细胞膜和多糖化合物。由图6可知,在整个发酵的过程,羟自由基清除能力为先上升后下降的趋势,且发酵过后的羟自由基清除能力均高于未发酵辣木叶提取液。在发酵时间8 h,羟自由基清除率达到最高,清除率为64%,相比于未发酵时提高了27%。在8~48 h,清除率开始呈现波动式下降。最终,在48 h之后趋于平稳,清除率最终为43%左右。这与束文秀等[31]研究发酵时间对胡柚汁的羟自由基清除率的整体变化一致。羟自由基的清除能力与总酚有一定的关系,清除率随总酚含量而增加,但也与发酵过程中产生的的抗氧化酶类能清除自由基有关,如SOD酶。由于抗氧化活性取决于清除自由基化合物的结构,羟自由基清除率的下降,可能是在微生物的发酵过程中活性强的物质被结构修饰成活性低的物质[32]。由于整个抗氧化体系太过复杂,不能确定是被简单的某一个因素所影响。

图6 发酵时间对辣木叶提取液羟自由基清除能力的影响Fig.6 Effect of fermentation time on hydroxyl radical scavenging ability of Moringa oleifera leaf extract
2.3.3 发酵对辣木叶提取液超氧阴离子清除能力的影响 发酵时间对辣木叶提取液超氧阴离子清除能力的影响如图7所示。在整个发酵过程中,发酵后的辣木叶提取液的超氧阴离子清除能力均高于未发酵的,在发酵32 h,达到最高,清除率为60%,比未发酵的清除率提高了19%,这是由于发酵过程中乳酸菌产生了多酚,强化了辣木叶提取液的超氧阴离子清除能力。由于在32~72 h时多酚开始被乳酸菌分解成更小的物质,超氧阴离子清除能力呈现波动下降,最终停留在53%左右。张晓松等[33]研究也发现,总酚与清除超氧阴离子能力有明显的量效关系。在整个发酵过程中,超氧阴离子清除能力都高于未发酵条件下,说明乳酸菌发酵能提高辣木叶提取液的抗氧化活力。
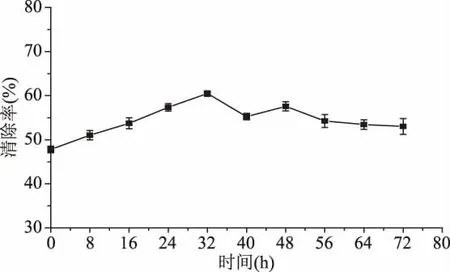
图7 发酵时间对辣木叶提取液超氧阴离子清除能力的影响Fig.7 Effects of fermentation time on the scavenging ability of superoxide anion in Moringa oleifera leaf extract
3 结论
辣木叶在发酵过程中,p H和可溶性固形物有不同程度的下降,总酸呈现上升的趋势。还原糖整体呈现下降的趋势。柠檬酸、琥珀酸、丙酮酸、乙酸随着发酵时间的延长整体呈下降趋势,乳酸则整体上升。在整个发酵过程中,黄酮和多酚的含量均高于未发酵的辣木叶提取液,其含量分别在发酵24 h和32 h达到最高,相比未发酵的提高了45%和21%,结果显示这种乳酸菌发酵辣木有利于黄酮和多酚的积累。DPPH清除能力、羟自由基清除能力、超氧阴离子清除能力都是先上升后下降的趋势。在发酵32 h时,DPPH清除能力、超氧阴离子清除能力达到最高,清除率分别为89%和60%。在发酵8 h时,羟自由基清除能力达到最大值,清除率为54%,说明乳酸菌发酵能提高辣木叶提取液的抗氧化能力。综上,辣木叶经乳酸菌发酵后,黄酮和多酚含量,以及其抗氧化能力均有所提高。

