生脉方的研究进展
王厚恩, 白文宇, 刘 唤, 余河水∗, 王春华, 李 正
(1. 天津中医药大学中药制药工程学院, 天津300193; 2. 天津中医药大学中医药研究院, 天津市现代中药重点实验室, 天津300193; 3. 天津国际生物医药联合研究院中药新药研发中心, 天津300457)
以人参、 麦冬和五味子组成的“生脉方”, 在临床和中成药制剂中应用广泛。 生脉散首载于金代张元素的《医学启源》, 由人参、 麦冬、 五味子组成; 生脉饮由红参、 麦冬、 五味子组成, 也有将红参替换为党参; 生脉注射液源自“生脉散”, 由华西医科大学研制, 现收载于卫生部药品标准中成药成方制剂第十五册(WS3-B-2865-98-2011),2001 年被列为国家中药保护品种。 生脉方中人参(红参) 甘温, 具有益气生津之功效, 为君药; 臣以麦冬, 甘寒, 具有养阴清热、 润肺生津之功效, 与君药合用益气养阴之功益彰; 五味子酸温, 具有敛阴止汗、 生津止渴之功效, 为佐药, 三药合用, 一补一润一敛, 益气养阴, 生津止渴, 敛阴止汗, 使气复津生、 汗止存阴、 气充脉复, 故名“生脉”。
生脉注射液用于气阴两亏、 脉虚欲脱的心悸、 气短,四肢厥冷、 汗出、 脉欲绝及心肌梗塞、 心源性休克、 感染性休克等症候[1], 广泛用于冠状动脉粥样硬化性心脏病、心力衰竭、 低血压、 心律失常、 休克、 肺源性心脏病、 病毒性心肌炎、 急性心肌梗死、 脑梗死、 脑出血、 新生儿缺氧缺血性脑病、 肿瘤、 各类中毒、 糖尿病等疾病的治疗及辅助治疗[2]。 现代药理研究表明, 该方对于心脑血管系统、 免疫系统药效显著, 并具有降血糖、 抗休克、 保肝等作用[3-4]。 近年来, 国内外对该方化学成分和药理作用研究广泛, 本文对生脉方中的化学成分、 药理作用、 药物代谢动力学以及不良反应等方面进行归纳总结, 以期为该方物质基础、 现代临床应用以及进一步开发应用提供参考。
1 化学成分
生脉方中的红参、 麦冬和五味子均为临床常用药, 对其化学成分研究较多, 但鲜有对全方化学成分的研究[5-6]。目前主要采用分析手段定性定量确定结构, 如液相方法、液相色谱-质谱联用法等, 其化学成分主要含有皂苷类、 黄酮类、 木脂素以及有机酸类、 多糖等130 种。 王占良等[7]利用HPLC-DAD-ESI MS 分析鉴定了生脉饮汤中的17 种人参皂苷, 包括10 个人参二醇型皂苷化合物, 分别为20(R) -ginsenoside Rg3、 20 (S) -ginsenoside Rg3、 20 (R) -ginsenoside Rh2、 20 (S) -ginsenoside Rh2、 20 (R) -PPT、20(S) -PPT、 ginsenoside Rk3、 ginsenoside Rg6、 ginsenoside Rh4、 ginsenoside F4; 7 个人参三醇型皂苷化合物分别为20(R) -ginsenoside Rg2、 20 (S) -ginsenoside Rg2、 20 (R) -ginsenoside Rh1、 20 (S) -ginsenoside Rh1、 ginsenoside Rf、ginsenoside Rk1、 ginsenoside Rg5。
Wang 等[8]采用HPLC-DAD-MS/MS 成功鉴定了生脉散中53 个化合物, 包括14 个人参皂苷、 6 个甾体皂苷、 12个高异黄酮和21 个木脂素。 Wu 等[9]采用UPLC-HDMS 法鉴定了生脉散中92 个化合物, 包括49 个人参皂苷、 31 个木脂素、 5 个甾体皂苷和7 个高异黄酮, 其中25 个羟基人参皂苷在生脉散中首次被发现。 王艳慧等[10]建立了HPLCDAD-ESI/MS/MS 方法鉴定分析了12 批生脉散提取物并找出45 个共有化合物。 Wu 等[11]采用HPLC-DAD-CL 和ESIMS/MS 法探索生脉散中抗氧化成分时鉴定了23 种成分,包括16 种木脂素、 4 种麦冬皂苷和3 种高异黄酮。
Zheng 等[12]采用基于片段离子的诊断扩展策略结合LC-ESI-IT-TOF/MS 方法快速鉴定生脉注射液中35 个人参皂苷、 21 个木脂素。 Li 等[13]使用HPLC-MS 联用技术鉴定了生脉注射液中62 个化合物, 并定量了其中21 种成分含有量, 包括14 种三萜皂苷、 6 种木脂素和1 种来自麦冬的化合物L-borneol-7-O- [β-D-apiofuranosyl (1→6) ] -β-Dglucopyranoside, 17 种三萜皂苷的总含有量范围为1.05 ~1.70 mg/mL, 6 种木脂素的总含有量范围为12.35 ~51.26 μg/mL, L-borneol-7-O- [β-D-apiofuranosyl (1→6) ] -β-Dglucopyranoside 的含有量范围为0.12 ~0.40 μg/mL。 刘瑞等[14]采用RRLC-DAD-ESI-MSn联用技术分析并鉴定了生脉注射液中34 种成分, 包括19 种人参皂苷、 14 种木脂素。1.1 三萜皂苷 生脉方主要活性成分是人参皂苷, 其中含有多种稀有人参皂苷。 目前, 文献报道的生脉方中55 个三萜皂苷均来源于红参(见表1、 图1), 包括35 个人参二醇型皂苷和20 个人参三醇型皂苷, 其中12 个人参皂苷连有乙酰基或丙二酰基。于五味子, 见表2、 图2。

图1 人参皂苷类化合物类型
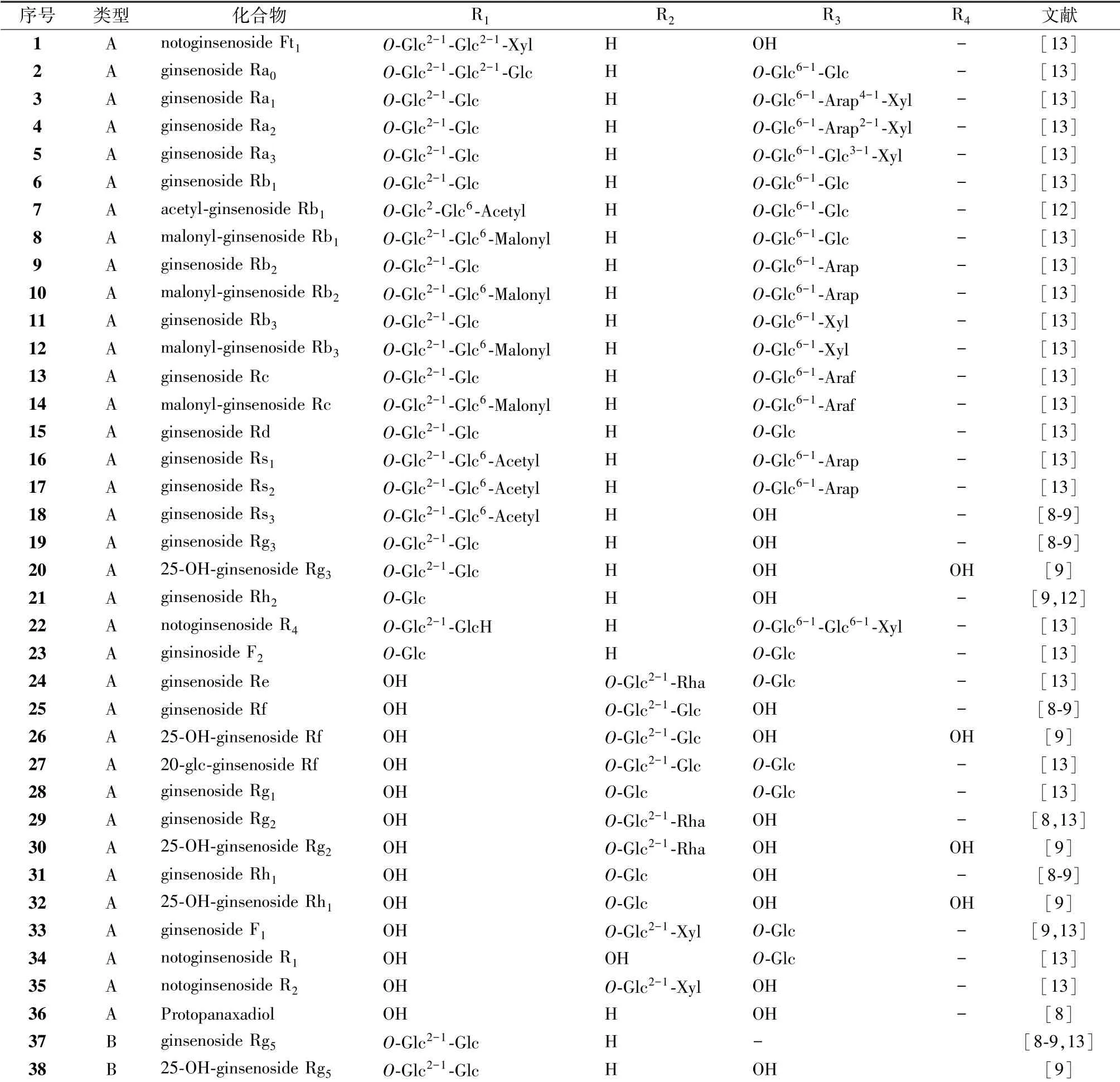
表1 人参皂苷类化合物
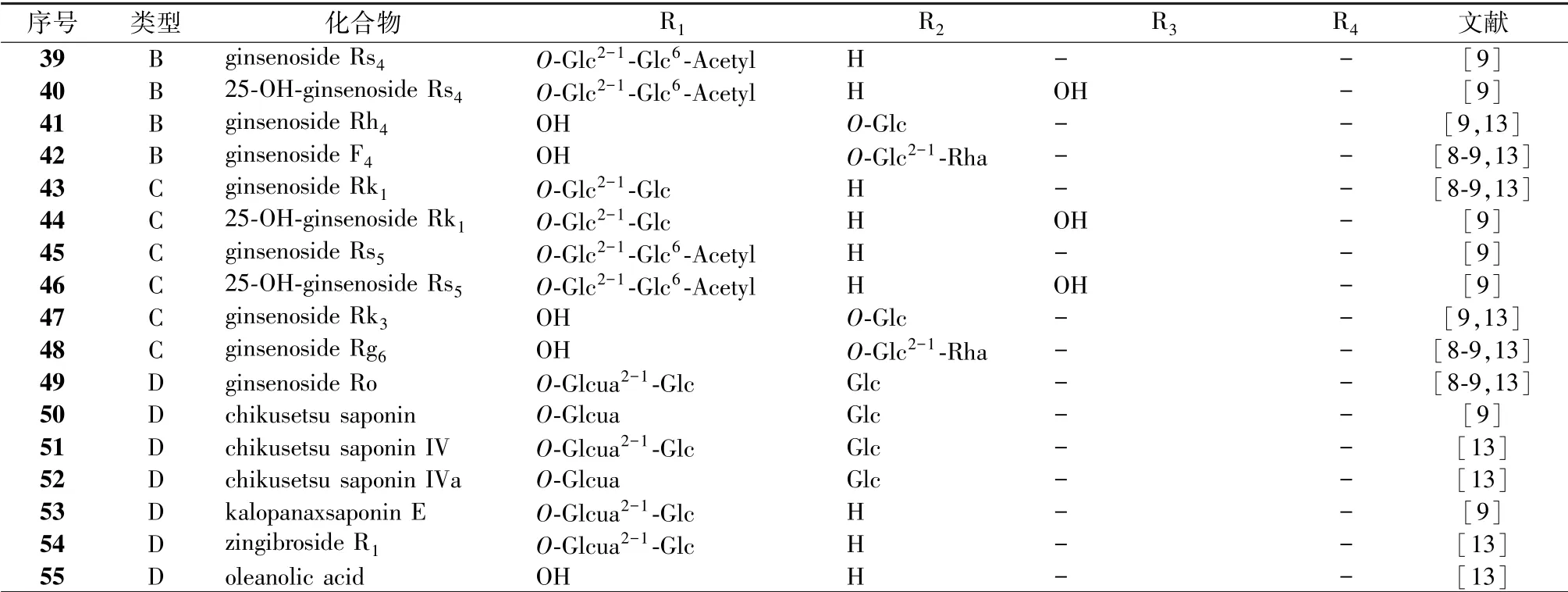
续表1
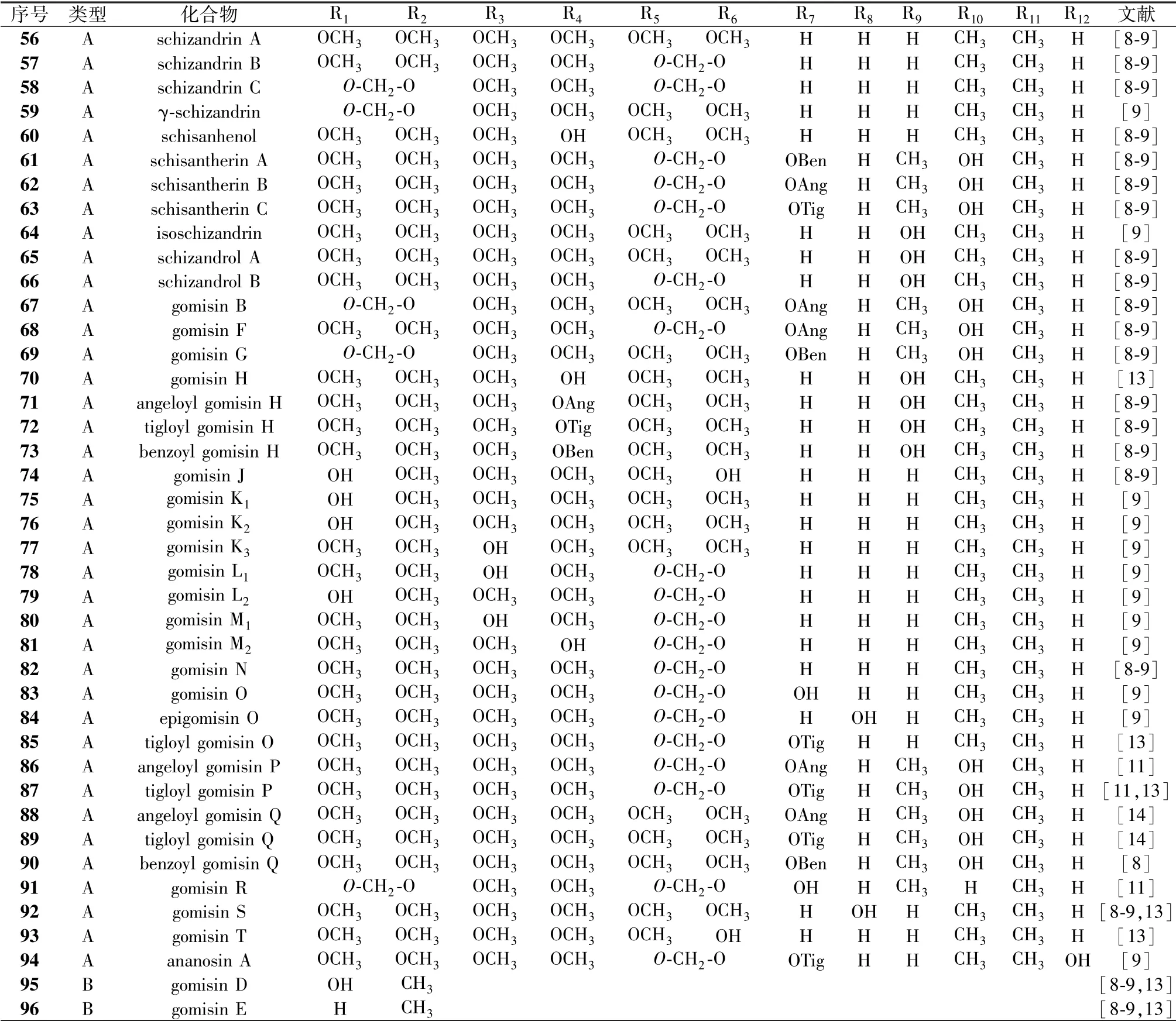
表2 木脂素类化合物
1.3 甾体皂苷 目前, 文献报道生脉方中甾体皂苷数量较少, 仅7 个螺甾烷型甾体皂苷被发现, 而呋甾烷型甾体皂苷则未见报道, 其甾体皂苷均来自于麦冬, 见表3、 图3。
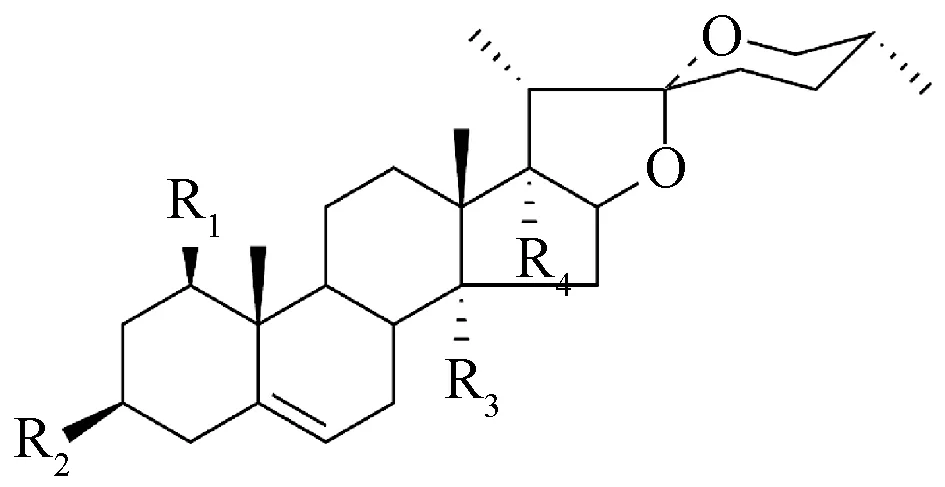
图3 甾体皂苷类化合物类型

表3 甾体皂苷类化合物
1.4 高异黄酮 高异黄酮是3-苯基色原酮B、 C 环之间多一个-CH2-基团所形成的化合物。 文献报道生脉方中16 个高异黄酮类化合物均来源于麦冬, 见表4、 图4, 其中14个为高异黄烷酮化合物。
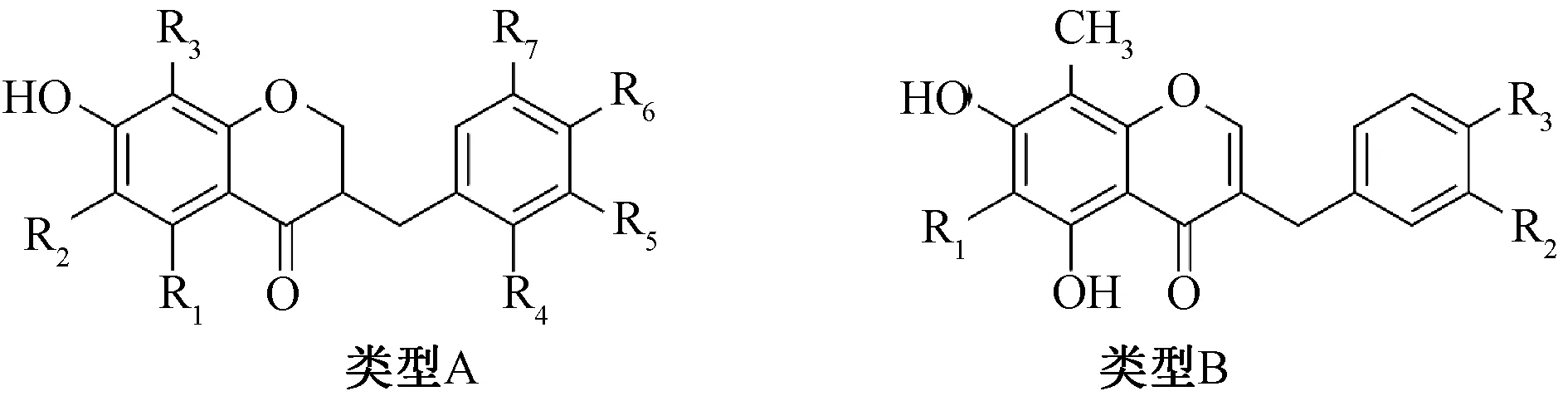
图4 黄酮类化合物类型
1.5 有机酸 生脉方中含少量有机酸类成分且具有一定抗氧化等药理作用, 目前有4 个被报道。 刘瑞等[15]采用离子排阻色谱法测定了生脉注射液中的苹果酸(120)、 琥珀酸(121)、 柠檬酸(122) 3 种有机酸, 此外还有Citric acid monomethyl ester[12](123), 且有机酸成分主要来源于五味子。 见图5。
1.6 其他 生脉方中已报道的化合物还有L-borneol-7-O-[β-D-apiofuranosyl ( 1 → 6 ) ] -β-D-glucopyranoside[13](124)、 4-allyl-1, 2-benzenediol1-O-α-L-rhamnpyranosyl(1→6)-O-β-D-glucopyranoside[13](125)、 citronellol[13](126)、dianthoside[13](127)、 5-hydroxymethyl furfural[13](128)、citral[13](129)、 pregomisin[11](130), 见图6。
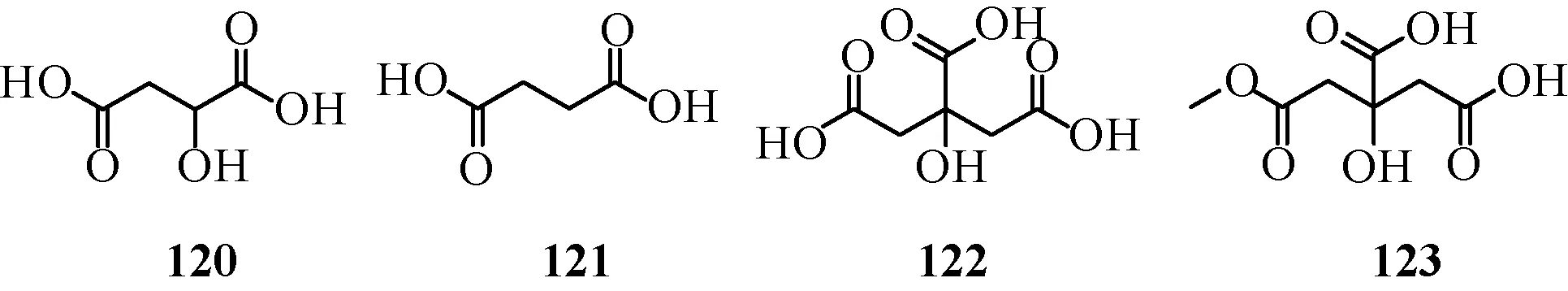
图5 有机酸类化合物结构
2 药理活性
2.1 心脑血管系统保护作用 保护心脑血管是生脉方最重要的作用, 包括抗心肌缺血缺氧、 抗心律失常、 抗心肌纤维化、 抗心肌肥大、 调节血压、 降血脂、 抗脑缺血缺氧等。生脉方中人参皂苷、 麦冬皂苷、 高异黄酮等活性物质对心血管保护作用效果明显。
2.1.1 心肌保护作用 睢诚等[16]通过对大鼠结扎左冠状动脉前降支制备急性心肌梗死模型, 研究生脉注射液对实验性心肌梗死的保护作用。结果表明, 生脉注射液中、 大剂量组可使急性心肌梗死24 h 大鼠的心肌梗死面积明显缩小, 血清AST、 LDH、 CK 活性及MDA 含有量明显降低,SOD 及GSH-Px活性明显升高, 血液黏度及血浆黏度明显下降。
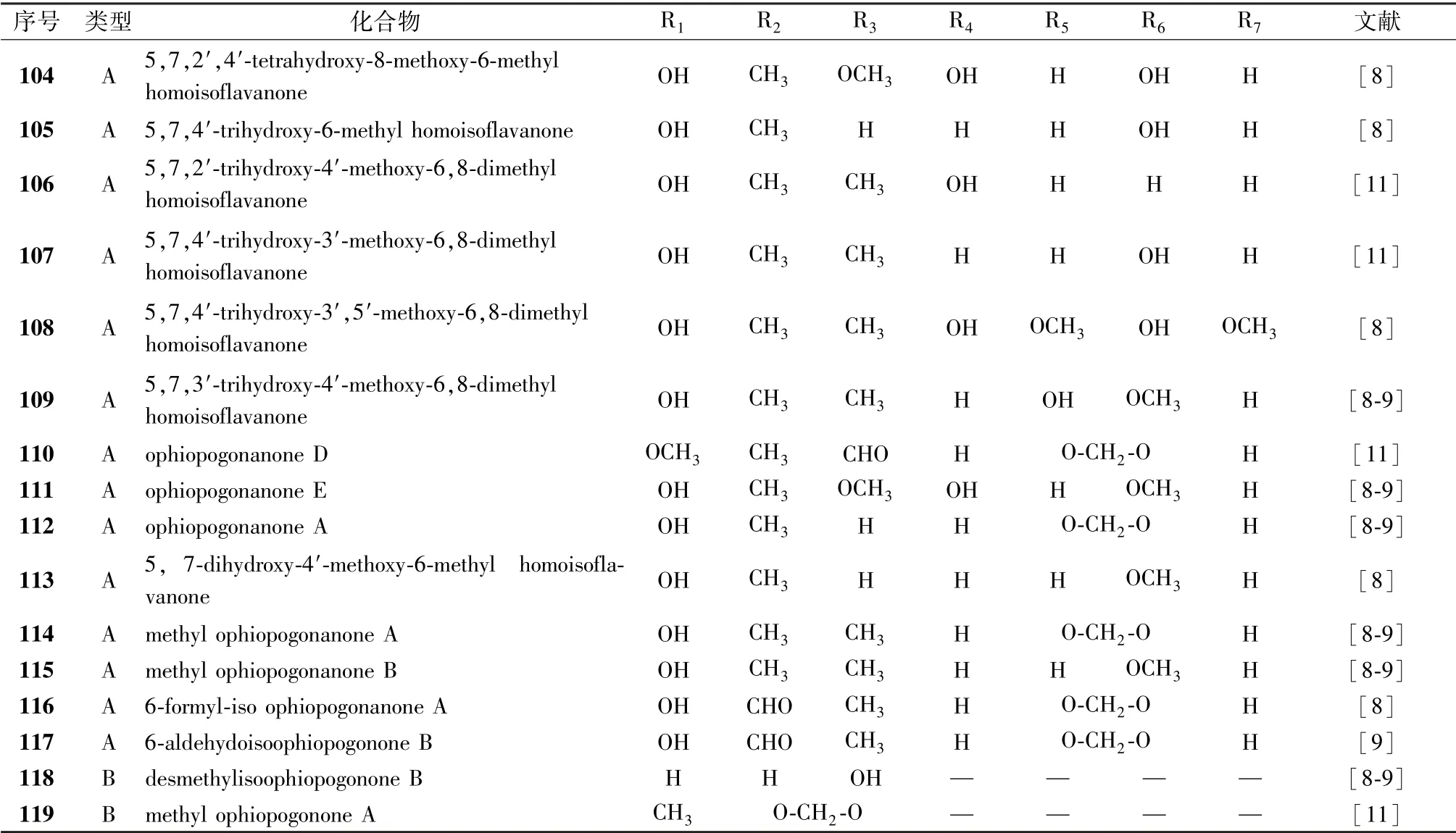
表4 黄酮类化合物
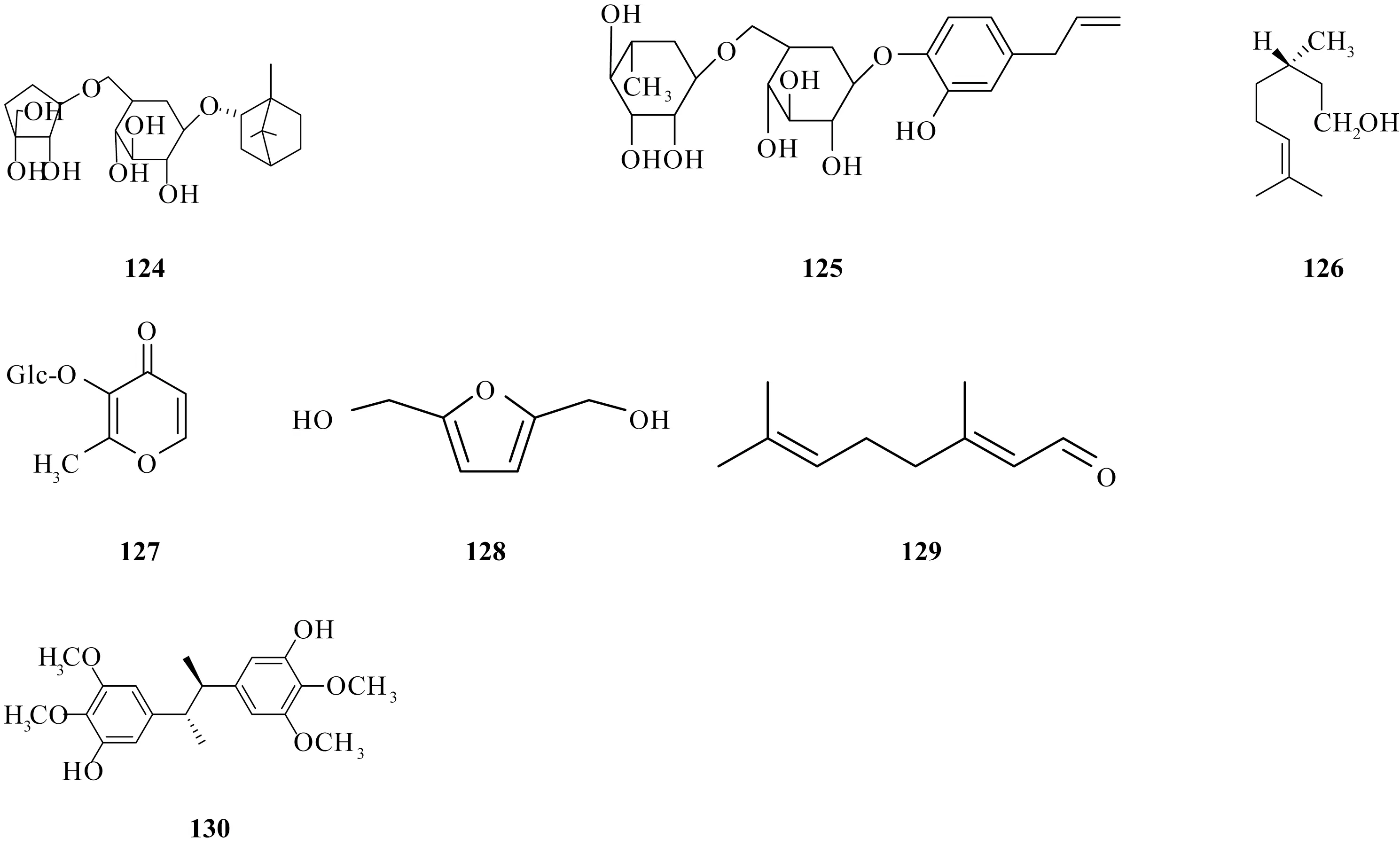
图6 其他化合物结构
Jiang 等[17]采用代谢组学方法, 通过核磁共振光谱分析单体给药(人参皂苷Rg1、 人参皂苷Rb1、 麦冬皂苷D、五味子醇甲) 及联合给药前后大鼠血清样品成分, 偏最小二乘判别分析(PLS-DA) 评分图显示联合治疗组与急性心肌梗死(AMI) 组有显著差异, 而单药治疗组无差异。 联合治疗较单体治疗相比改善了更多AMI 诱导的代谢变化,表明联合治疗改善AMI 效果更佳。
人参皂苷Rg1对缺血心肌再灌注损伤具有一定的保护作用, 预处理后可改善缺血再灌注损伤引起心肌组织的形态学变化, 降低心肌梗死面积, 减轻心肌细胞凋亡程度,降低TNF-α、 IL-1β 含有量和p65 蛋白表达, 增加IκB 蛋白表达, 其机制可能与下调NF-κB 通路, 降低炎症反应有关[18]; 还对异丙肾上腺素所致大鼠急性心肌缺血有一定的保护作用, 能有效降低心率, 对抗心电图ST 段升高; 同时能显著增强心脏表面血流微循环, 降低血清中乳酸脱氢酶(LDH)、 肌酸激酶(CK) 的活性及丙二醛(MDA) 的含有量, 升高血清中超氧化物歧化酶(SOD) 的活性及谷胱甘肽合成酶(GSH), NO 的含有量, 减轻心肌损伤的程度[19]。 人参皂苷Re 对心肌缺血再灌注损伤有保护作用,可显著抑制心肌缺血再灌注中性粒细胞(PMNs) 浸润和髓过氧化物酶(MPO) 活性[20]。
麦冬水提物中分子量10 000 以下的组分是其抗心肌缺血的主要活性成分[21]。 王思思等[22]优化麦冬提取条件,并采用心肌细胞Na2S2O4缺氧/复氧模型考察细胞存活率,结果表明麦冬总皂苷为治疗冠心病的主要成分。 另有研究表明, 麦冬高异黄酮具有对缺氧缺糖H9C2 心肌保护作用,且构效关系影响较大[23]。 麦冬皂苷D 可显著上调CYP2J3,ELISA 实验也证实它能增加大鼠H9C2 心肌细胞中EETs 的含有量; 增强了AA 向EETs 代谢转化, 从而产生对心血管系统的保护作用; 还可诱导大鼠心肌细胞CYP2J3 在mRNA及蛋白水平表达, 并增加花生四烯酸代谢产物EETs 的含有量; 通过调节大鼠心肌细胞内钙调蛋白的表达以维持胞内Ca2+稳态; 通过抑制内质网应激及其介导的细胞凋亡信号通路进一步抑制细胞凋亡[24]。
五味子对心肌缺血再灌注损伤有保护作用。 畅瑞苗等[25]以大鼠心肌缺血再灌注损伤为研究模型进行实验, 血清MDA 含有量明显升高, 结果表明五味子甲素和五味子酯甲能有效减轻由缺血/再灌注引起的心肌损伤。 琥珀酸是五味子中存在的一种有机酸, 可以抑制心肌细胞缺氧复氧损伤所致的LDH 漏出、 心肌细胞凋亡百分数及cleaved caspase-3 的蛋白表达, 提示琥珀酸可以抑制心肌缺血再灌注过程中心肌细胞的凋亡和坏死。 再进一步考察了琥珀酸对缺氧复氧损伤所致的心肌细胞Akt 磷酸化的影响, 结果表明400 mg/L 下可显著增加心肌细胞缺氧复氧损伤所致的p-Akt 蛋白表达, 通过激活Akt 的磷酸化, 保护心肌缺血再灌注过程中心肌细胞的损伤[26]。
2.1.2 抗心律失常 心律失常是冠心病患者常见的一种并发症, 心肌梗死再灌注损伤也可引起心率失常。 郑珂等[27]选取缓慢性心律失常患者作为研究对象给予生脉注射液进行治疗, 结果表明生脉注射液可加强心肌收缩能力, 抗心肌缺血, 改善心功能, 从而增加冠脉流量, 从根本上改善缓慢性心律失常患者临床症状, 有效提升心率。 人参三醇型皂苷Rg1可对抗心肌缺血再灌注所致的心律失常, 降低室颤发生率[28]。
2.1.3 抗心肌纤维化 对异丙肾上腺素引起大鼠心肌纤维化的干预作用实验结果表明, 生脉注射液能明显改善心室重构和心肌纤维化, 其作用机制可能与其抗氧化、 抑制结缔组织生长因子(CTGF) 过度表达有关[29]。
2.1.4 抗心肌肥大 生脉注射液对慢性压力超负荷引起心肌肌浆网钙泵功能紊乱及钙超载有较好的防治作用, 可延缓心肌肥厚向心衰转化的进程[30]。 李铁成等[31]采用葡萄糖诱导心肌细胞肥大的体外培养模式实验结果表明, 人参皂苷Rg1对高糖诱导的心肌细胞肥大有一定的保护作用,这可能与抑制细胞内Ca2+有关。
2.1.5 调节血压 赵菁华等[32]临床研究表明生脉注射液对血压有双向调节作用, 小剂量缓慢静滴以升压, 大剂量快速静注则降压, 且不增加心率。 生脉注射液对血压正常患者的血压无明显影响, 而对高血压病患者可使其血压降低[33]。 生脉注射液在治疗心梗溶栓后缺血再灌注损伤性低血压中, 能够使血压回升[34]。
2.1.6 抗脑缺血 周代伟等[35]对采用线栓法对大鼠进行脑缺血制造大鼠局灶性大脑中动脉缺血再灌注模型, 研究生脉注射液对大鼠局灶性脑缺血再灌注损伤的影响, 结果表明生脉注射液预处理和后处理可减轻大鼠局灶性脑缺血再灌注损伤, 其机制与上调Bcl-2 表达、 下调Bax 表达, 从而降低细胞凋亡的发生有关, 且生脉注射液预处理较后处理效果更佳。 人参皂苷Rg1可以明显减少再灌注后的脑梗死面积和脑水肿程度, 减轻线粒体损伤, 提高包括SOD、GSH 在内的多种酶的活性, 降低MDA 含有量, 对脑缺血再灌注损伤起到明显的保护作用[36]。
2.1.7 抗凝血 血小板聚集可能导致动脉粥样硬化、 心肌梗死、 血液黏稠、 血栓等疾病, 人参皂苷Rg1可明显抑制二磷酸腺苷(ADP) 诱导的血小板聚集[37], 人参皂苷Rb3也可以明显抑制二磷酸腺苷诱导的血小板聚集[38]。
2.2 抗肿瘤活性 生脉注射液在抗肿瘤治疗上的使用量逐年呈递增趋势, 至今为止已在多种癌症的治疗中得到广泛应用, 其中包括胃癌、 结肠癌、 鼻咽癌、 乳腺癌、 膀胱癌等[39]。 有关研究表明生脉方3 味药成分均有抗肿瘤活性,因此有文献指出生脉方可作为肿瘤的辅助手段。 配方红参提取物主要由14 种人参皂苷, 能使人类HCC 细胞系对TRAIL 衍生的细胞死亡敏感, 可以与癌症治疗结合使用作为膳食补充剂[40]。 自噬是抗癌的有效手段, 人参皂苷Rg3、Rh2均有抗肿瘤活性, 但20 (R) -型的自噬作用的抗肿瘤活性强于20 (S) -型通过钙依赖性细胞凋亡活性[41]。 人参皂苷Rg3可促进小鼠脾细胞增值, 增加巨噬细胞碳颗粒吞噬指数并且口服给药抑制肿瘤生长, 且未引起不良反应[42]。
麦冬皂苷B 对胃癌细胞有抗增殖作用, 增加细胞凋亡,改变细胞形态。 在微观上, 麦冬皂苷B 促进caspase-3 和Bcl-2 相关的X 蛋白的蛋白表达水平, 且降低了Bcl-2 的表达水平、 细胞外信号通路的磷酸化水平, 呈正相关调节激酶1/2、 c-Jun N 末端激酶1/2, 表明麦冬皂苷可作为治疗胃癌的备选药物[43]。 麦冬皂苷B 还可作非小细胞肺癌的替代药物, 因其抑制非小细胞肺癌生长, 且诱导细胞自噬,其原因是抑制PI3K/Akt 信号通路[44]。 麦冬皂苷B 通过抑制Akt/mTOR 信号通路诱导人宫颈癌HeLa 细胞发生自噬,但对凋亡相关蛋白caspase-3 及PARP 的表达无明显影响[45]。 麦冬中高异黄酮类成分也有抗非小细胞肺癌细胞的作用, 6-甲酰基沿阶草酮甲、 甲基沿阶草酮甲、 沿阶草酮甲、 甲基沿阶草酮甲乙酸酯, 均具有较好的抗肺癌细胞A549 体外活性[46]。
北五味子总木脂素中的挥发性成分对抗烟草花叶病毒有较好抑制作用并具有一定抗肿瘤活性[47]。
2.3 免疫活性 提高机体免疫是中医思想体系重要部分,对疾病治疗和机体状态恢复起重要作用。 生脉方中3 味中药均具有一定免疫活性, 其中五味子木脂素、 麦冬皂苷作用较为明显。 麦冬皂苷初步纯化物具有显著的巨噬细胞活化能力, 促进一氧化氮和白细胞介素生成等免疫活性[48]。一些木脂素和三萜在抗HIV-1、 抗HBV、 神经退行性疾病和对T 淋巴细胞促进增殖方面有较强生物活性[49]。
3 药物代谢动力学
中药的疗效通过化学成分实现, 而化学成分中只有进入体内的成分才有可能成为药效成分, 有的成分本身具有药效作用。 而有些成分需经代谢后才能发挥作用, 研究化学成分在体内的吸收、 分布、 代谢、 排泄过程有助于了解中药中可被吸收的成分、 分布规律、 代谢规律及排泄途径,再辅以其他体内外药理、 毒理试验, 可快速发掘药效成分、潜在药效成分、 有害成分及潜在有害成分。
从药代动力学入手, 通过生脉、 参麦注射液中含有量较高的人参皂苷Rg1、 Rb1、 Re 在人体内代谢指标差异无统计学意义的结果, 可认为两药药代动力学行为相似, 而在体内、 体外研究发现生脉散中五味子木脂素显著增强人参皂苷的摄入。 木脂素在体外抑制细胞中人参皂苷外排;在体内增加人参皂苷血浆浓度时间范围, 不影响终端半衰期[50]。
生脉方中成分之间代谢方式各有差异。 人参皂苷在体内代谢方式因类型不同而不同, 原人参三醇型人参皂苷从血液到组织分布广泛而快速并通过胆汁、 尿液和粪便迅速消除; 原人参二醇型人参皂苷从血液迅速分布到所有组织,但在胆汁、 尿液中呈缓慢消除; 麦冬皂苷D 只以次级代谢物形式从胆汁排泄; 五味子木脂素迅速从血液分布到大多数组织并积累, 主要以代谢物形式从胆汁、 尿液和粪便排泄[51]。 目前, 5 种代表性木脂素的44 个代谢物主要代谢途径为去甲基化、 羟基化、 两者皆进行, 且雌性大鼠相对累积排泄显著低于雄性大鼠[52]。
Jiang 等[53]研 究 发 现 所 有 人 参 皂 苷 都 能 与 人 的OATP1B3 和大鼠的Oatp1b2 蛋白结合, 但仅运送20 (S) -原人参三醇型人参皂苷。 人类多药耐药相关蛋白(MRP)2 /乳腺癌耐药蛋白(BCRP) /胆汁盐出口泵(BSEP) /多药耐药蛋白-1 和大鼠Mrp2/ Bcrp / Bsep 也介导了20 (S) -原人参三醇型人参皂苷。 由于血浆蛋白结合的差异, 20(S) -原人参三醇型人参皂苷的肾小球滤过肾脏排泄量大于20 (S) -原人参二醇型对应物。
人参皂苷Rg1和Rb1在心肌缺血大鼠体内的药动学过程及其诱导体内NO 释放效应不同, 人参皂苷Rg1在体内表现出快消除的特点, 人参皂苷Rb1表现出慢消除的特点。生脉注射液诱导大鼠体内NO 释放效应与人参皂苷Rg1和Rb1的血药浓度不直接相关, 该效应滞后于血药浓度, 且与人参皂苷Rg1和Rb1的效应室浓度成良好的相关性[54]。
有研究表明[55]麦冬皂苷D′可被大鼠肠内菌群代谢, 且随着时间的延长, 代谢产物之一薯蓣皂苷元含有量增加并吸收入血。
4 不良反应
关于生脉方不良反应绝大多数集中于其注射剂, 生脉注射液引起的不良反应未见性别差异, ADR/ADE 在各年龄组段均有分布, 所致不良反应主要为发热伴全身性损害388 例(38.34%)、 皮肤及附件损害202 例(19.96%)、 心血管系统一般损害113 例(11.17%)、 胃肠系统损害70 例(6.92%), 不良反应主要表现为速发型, 应警惕过敏性休克[56]。
近年来, 随着吐温80 的研究不断深入, 发现其是导致不良反应的主要原因之一。 肥大细胞脱颗粒、 β-氨基己糖苷酶释放和组胺释放是过敏反应的重要特征, 研究结果显示吐温80 具有促使肥大细胞脱颗粒作用即具有潜在过敏源性质[57]。 据报道[58], 吐温80 可引起家兔红细胞溶血和形变, 0.01%、 0.1%、 1%体积分数下对蟾蜍心肌收缩力均有明显抑制作用[59]。 2015 版《中国药典》 已提高对吐温80的质量规定, 但其毒理尚需考察。
5 其他
相关研究[60]表明基于代谢组学的“七指标” 的质量标准有助于产品的质量控制, 这种基于代谢组学的方法以几种关键成分或其总含有量的浓度来补充目前的质量控制标准具有一定科学性。 Bai[61]采用HPLC 建立以人参皂苷Rb1、 Re、 Rg1和五味子醇甲为指标的生脉注射液分析方法, 并以该方法监测了生脉注射液的5 个样品和3 批原料药(红参、 五味子), 为过程质量控制提供一定参考。
6 讨论
生脉方历史悠久, 沿用至今, 通过现代医药科技的发展衍生出了多种剂型, 在众多剂型中, 生脉注射液和参麦注射液的不良反应或不良事件发生率较高。 因此, 将生脉方的化学成分、 药理活性、 代谢过程及不良反应进行归纳总结, 有助于建立更科学的质量控制方法, 尽可能避免或减少不良反应的发生。 生脉方在信号通路、 作用靶点、 成分相互作用、 潜在毒性、 量效关系等方面尚需深入研究,以明确药效、 毒性作用机制。
生脉方的化学成分及其对应的药理活性和药代动力学参数体现了中药多成分多靶点的特点, 将其归纳总结可为药物的质量控制、 生产过程和临床安全用药提供理论依据。对于生脉、 参麦注射液的质量控制, 课题组认为仅对某几个指标成分定上下限满足不了今后对注射液的质控要求,红参中可选取3 ~5 种指标成分, 麦冬选取1 ~2 种指标成分, 五味子选取2~3 种指标成分, 将这几种指标成分含有量加和的上下限结合指纹图谱的质控方法更具科学意义。
对生脉方更深入的研究可从以下几个方面考虑: ①药效物质基础, 单一成分或多种成分混合含有量或化学成分发生改变从而影响药效, 三药配伍各成分之间的相互作用较单一成分的药理活性差异影响药效; ②药物代谢动力学,药物可能在代谢过程中因成分改变或在体内滞留时间不同而产生药理活性差异; ③不良反应, 探寻产生不良反应的化学成分或辅料, 并考虑是否将其控制在安全的浓度范围内, 或者寻找其替代品。

