羊口疮病毒安徽株023基因的原核表达与生物信息学分析
张高峰,杨侃侃,张 谦,王元红,俞赵荣,张学琪,鲁智敏,刘自敏,李永东,王 勇,*
(1.安徽农业大学 动物科技学院,安徽 合肥 230036; 2.宁波市疾病预防控制中心,浙江 宁波 315010)
羊口疮(orf)是由羊口疮病毒(orf virus,ORFV)引起的急性接触性人兽共患传染病,主要感染绵羊、山羊和骆驼等。屠夫、饲养员和兽医等人群也有感染发病的报道[1-4]。该病临床表现以口唇、舌、乳房等部位形成丘疹、脓疱以及厚痂为主要特征[5]。各个年龄阶段的绵羊和山羊都可被感染,羔羊发病率较成年羊高。由于病变部位大多出现在口唇周围,严重影响了羔羊的吸吮和采食[6]。该病最早于1920年首次在欧洲出现,目前世界上所有养羊的地区均有该病的发生,我国也不例外,因此对畜牧业造成了严重的经济损失[7-8]。
ORFV属于痘病毒科、副痘病毒属的成员,为线性双链DNA病毒,基因组大小约138 kb,G+C含量约64%,编码132个基因。基因组的中央区域为高度保守的基因,在病毒复制时起重要作用,而末端区域的基因则在病毒毒力及致病机制中起关键作用[9-10]。目前为止,ORFV基因组大多数基因的功能还未研究,其中包括位于基因组保守区域的023基因,仅有研究人员预测该基因编码的蛋白可能为囊膜蛋白[11]。本试验拟克隆表达ORFV安徽株023基因,表达023蛋白并制备鼠源多抗血清,并预测该蛋白的基本特性,以期为进一步研究ORFV 023基因的生物学功能提供依据。
1 材料与方法
1.1 试验材料
ORFV AH-F10株[12]、pET-32a(+)菌种由本实验室保存。BALB/c小鼠购自安徽医科大学实验动物中心。pMDTM18-T载体购自TaKaRa公司。
1.2 主要试剂
病毒基因组DNA/RNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒;SolutionⅠ;DH5α和Rosseta感受态细胞;2×LA rTaq酶、限制性内切酶BamHⅠ和EcoRⅠ;质粒提取试剂盒;PBS缓冲液;SDS-PAGE凝胶配制试剂盒;DAB试剂盒;ECL试剂盒;抗His标签的鼠源一抗、HRP标签的羊抗鼠IgG购自北京中杉金桥生物技术有限公司;弗氏佐剂购自西格玛奥德里奇(上海)贸易有限公司。
1.3 试验方法
1.3.1 引物设计与基因扩增
按病毒基因组提取试剂盒说明书提取ORFV AH-F10株DNA。根据GenBank中发表的ORFV GO株基因序列,设计023基因特异性引物,上游引物:5′-CGGGATCCATGGTGGACAGCGGCACG-3′(下划线处为BamHⅠ酶切位点);下游引物:5′-GGAATTCCTACAGCAGCACCACGTTCTC-3′(下划线处为EcoRⅠ酶切位点)。
PCR反应体系(20 μL):2×LArTaq10 μL、ddH2O 7 μL、DNA模板1 μL,上下游引物各1 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸60 s,共30个循环;72 ℃再延伸10 min。PCR产物回收后克隆至pMDTM18-T载体,转化DH5α感受态细胞,涂布至氨苄抗性的固体培养基,隔天挑取阳性克隆提取质粒,命名为pMDTM18-T-023,送至上海迈浦生物科技有限公司测序。
1.3.2 重组质粒pET-32a(+)-023构建
将pMDTM18-T-023与pET-32a(+)空载体质粒经内切酶BamHⅠ和EcoRⅠ双酶切后电泳,产物回收后连接pET-32a(+)载体,转化DH5α感受态细胞,涂布至氨苄抗性的固体培养基,隔天挑取阳性菌落提质粒,命名为pET-32a(+)-023,双酶切鉴定后送到上海迈浦生物科技有限公司测序。
1.3.3 重组蛋白的诱导表达
将pET-32a(+)-023与pET-32a(+)空载体质粒分别转化Rosetta感受态细胞,接种至氨苄抗性的固体培养基,分别挑取单菌落至LB液体培养基。当D600值在0.6~0.8时,加入1 mmoL·L-1的IPTG于37 ℃、180 r·min-1诱导表达,取5 h样品SDS-PAGE电泳,考马斯亮蓝染色。对诱导成功的重组菌进行大量诱导,4 ℃离心收集样品于冰浴下超声裂解,分别收集上清和沉淀分析重组蛋白的可溶性。
1.3.4 重组蛋白的纯化
将收集的蛋白用PBS缓冲液重悬,随后4 500 r·min-1离心10 min,收集沉淀并用Tris缓冲液洗涤,4 ℃ 8 000 r· min-1离心10 min,弃上清。沉淀依次用含2、4、5和6 mol·L-1尿素的Tris缓冲液吹打洗涤,4 ℃ 8 000 r·min-1离心10 min,收集沉淀用含8 mol·L-1尿素的Tris缓冲液重悬,4 ℃静置过夜。12 000 r·min-1离心10 min收集上清至透析袋中,用含6、5、4、2和0 mol·L-1尿素的Tris缓冲液进行复性。蛋白复性后用蔗糖浓缩。
1.3.5 Western-blot检测
将纯化后的蛋白SDS-PAGE电泳后转膜至硝酸纤维素膜上,5%脱脂奶粉4 ℃封闭过夜,TBST洗涤3次;加入1∶200稀释的鼠源抗ORFV多抗血清作为一抗,37 ℃孵育1 h后TBST漂洗3次。再加入1∶1 000稀释的HRP标记的羊抗鼠IgG二抗,37 ℃孵育1 h后TBST漂洗3次。利用ECL发光试剂盒显色。
1.3.6 鼠源多抗血清的制备
纯化的蛋白50 μg·只-1免疫BALB/c雌性小鼠,过程如下:首次免疫时将蛋白与等体积完全佐剂混匀乳化后皮下注射;14 d后二免,二免时将蛋白与等体积不完全佐剂混匀乳化后皮下注射;二免后14 d和28 d进行三免和四免,方法同第二次。四免7 d后眼眶采血分离血清。
1.3.7 ORFV 023蛋白的生物信息学分析
利用ProtparamSOPMA在线程序分析该毒株023蛋白的理化性质;利用SOPMA在线程序分析该毒株023蛋白的二级结构;利用SingalP4.1在线程序预测该蛋白的信号肽;利用TMHMM2.0 Server在线程序预测该蛋白的跨膜结构域;利用NetPhos3.1 Server在线程序预测该蛋白的磷酸化位点;利用DNAStar的Protean程序预测023蛋白的B细胞表位;利用nHLAPred的ComPred在线服务器预测023蛋白的CTL表位;利用ProPred在线服务器预测023蛋白的Th表位。
2 结果与分析
2.1 023基因的扩增
经特异性引物扩增的023基因长约819 bp(图1),与预期结果相符,测序分析表明并未发生碱基突变或缺失。
2.2 重组质粒pET-32a(+)-023的双酶切鉴定
将pET-32a(+)-023重组质粒经内切酶BamHⅠ和EcoRⅠ双酶切后琼脂糖凝胶电泳,得到符合预期的条带(图2),测序表明成功构建重组质粒,碱基并未发生突变或缺失。
2.3 重组蛋白的SDS-PAGE分析
将pET-32a(+)-023质粒转化至Rosetta细胞内,成功表达约为42 ku的蛋白,与预期相符,SDS-PAGE结果显示蛋白主要以包涵体存在于沉淀中(图3)。
2.3 Western-blot鉴定
利用Western-blot对蛋白进行进一步分析,结果显示在硝酸纤维素膜上约42 ku处有一明显条带(图4),表明重组蛋白能成功被抗His标签的一抗识别,具有良好的反应原性。

M,DNA marker;1,阴性对照;2,023基因PCR产物。M, DNA marker; 1, Negative control; 2, 023 gene PCR product.图1 023基因扩增产物Fig.1 PCR product of 023 gene

M,DNA marker;1,pET-32a(+)-023重组质粒双酶切产物;2,pET-32a(+)空载体阴性对照。M, DNA marker; 1, pET-32a(+)-023 recombinant plasmid double digested product; 2, pET-32a(+)empty vector negative control.图2 重组质粒pET-32a(+)-023双酶切鉴定Fig.2 Identification of recombinant plasmid pET-32a(+)-023 by double enzyme digested

M,蛋白Marker;1,pET-32a(+)空载体经IPTG诱导;2,pET-32a(+)空载体未经IPTG诱导;3,pET-32a(+)-023重组质粒未经IPTG诱导;4,pET-32a(+)-023重组质粒经IPTG诱导;5,pET-32a(+)-023重组质粒诱导表达上清;6,pET-32a(+)-023重组质粒诱导表达沉淀。M, Protein marker; 1, pET-32a(+)empty vector was induced by IPTG; 2, pET-32a(+) empty vector was not induced by IPTG; 3, pET-32a(+)-023 recombinant plasmid was not induced by IPTG; 4, pET-32a(+)-023 recombinant plasmid was induced by IPTG; 5, pET-32a(+)-023 induced expression supernatant; 6, pET-32a(+)-023 induced expression precipitate.图3 pET-32a(+)-023蛋白产物SDS-PAGE电泳Fig.3 SDS-PAGE electrophoresis of the protein product of pET-32a(+)-023
2.4 鼠源多抗Western-blot鉴定
纯化蛋白以鼠源抗ORFV阳性血清为一抗,HRP标签的羊抗鼠IgG为二抗进行Western-blot鉴定,结果显示重组蛋白能够被抗ORFV阳性血清特异性识别(图5)。
2.5 理化性质分析
利用Protparam在线程序分析该毒株023蛋白的理化性质,结果显示,该蛋白由272个氨基酸组成,分子式为C1437H2157N357O399S7,相对分子质量为31 042.51 ku,理论pI(等电点)值为6.97,不稳定系数为37.08,平均亲水值(GRAVY)为-0.132,为亲水性稳定蛋白,带负电荷的氨基酸(Asp+Glu)和带正电荷的氨基酸(Arg+Lys)各26个,脂肪族系数为81.40。
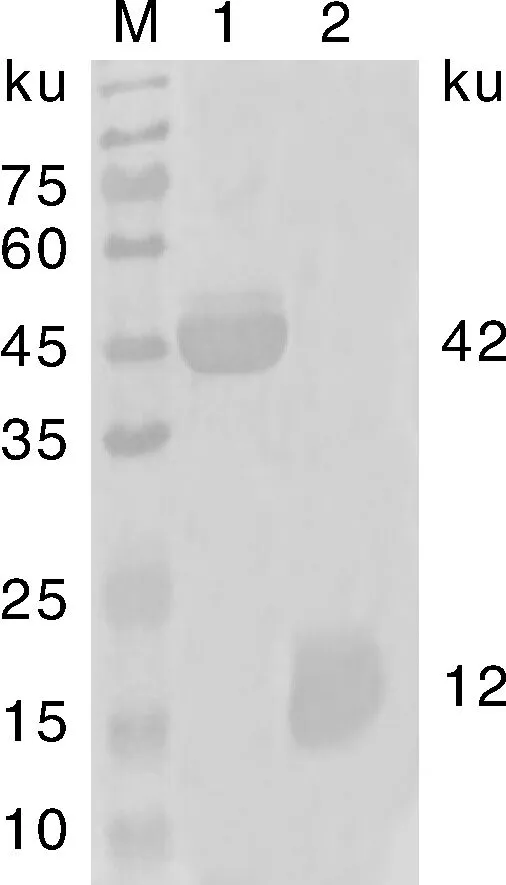
M,蛋白marker;1,pET-32a(+)-023重组质粒经IPTG诱导表达;2,pET-32a(+)空载体经IPTG诱导表达。M, Protein marker; 1, pET-32a(+)-023 recombinant vector induced by IPTG; 2, pET-32a(+)empty vector induced by IPTG.图5 多克隆抗体的鉴定Fig.5 Identification of polyclonal antibody

1,pET-32a(+)空载体经IPTG诱导表达;2,pET-32a(+)-023重组质粒经IPTG诱导表达。
1, pET-32a(+)empty vector induced by IPTG; 2, The recombinant plasmid pET-32a(+)-023 induced by IPTG.
图4 Western-blot鉴定023蛋白的体外表达
Fig.4 Western-blot identification of 023 proteininvitro
2.6 二级结构分析
利用SOPMA在线程序预测023蛋白的二级结构,结果显示,该蛋白二级结构包括α-螺旋(h,27.57%),延伸链(e,17.28%),β-转角(t,12.13%),无规则卷曲(c,43.01%)4种类型(图6)。
2.7 信号肽、跨膜结构域及磷酸化位点的预测分析
分别利用SingalP4.1和TMHMM2.0 Server在线程序预测该蛋白的信号肽和跨膜结构域,结果显示,023蛋白无信号肽区域和跨膜结构域(图7、图8);利用NetPhos3.1 Server在线程序预测023蛋白的磷酸化位点,结果显示,该蛋白共有30个磷酸化位点,其中丝氨酸位点13个,苏氨酸位点11个,酪氨酸位点6个(图9)。
2.8 B细胞抗原表位的预测分析
利用DNAStar的Protean程序预测023蛋白的B细胞抗原表位,结果显示,该蛋白亲水性位点主要位于第1~2、26~28、47~50、65~71、73~87、115~118、126~144、152~160、218~226、233~251、253~256、258~262、265~273处,含有柔韧性的区域主要位于第5~29、47~49、53~58、84~87、93~99、102~110、121~124、144~152、161~165、174~182、185~217、230~233、246~254、266~26处,抗原性和表面可及性程度较高。结合该蛋白的二级结构、亲水性、柔韧性、抗原性和表面可及性进行综合分析,该蛋白第26~28、84~87、144~146、246~254等处可能存在优势抗原表位(图10、表1)。

图6 羊口疮病毒AH-F10株023蛋白的二级结构Fig.6 Secondary structure of ORFV AH-F10 strain 023 protein

图7 羊口疮病毒AH-F10株023蛋白的信号肽预测Fig.7 Signal peptide prediction of ORFV AH-F10 strain 023 protein
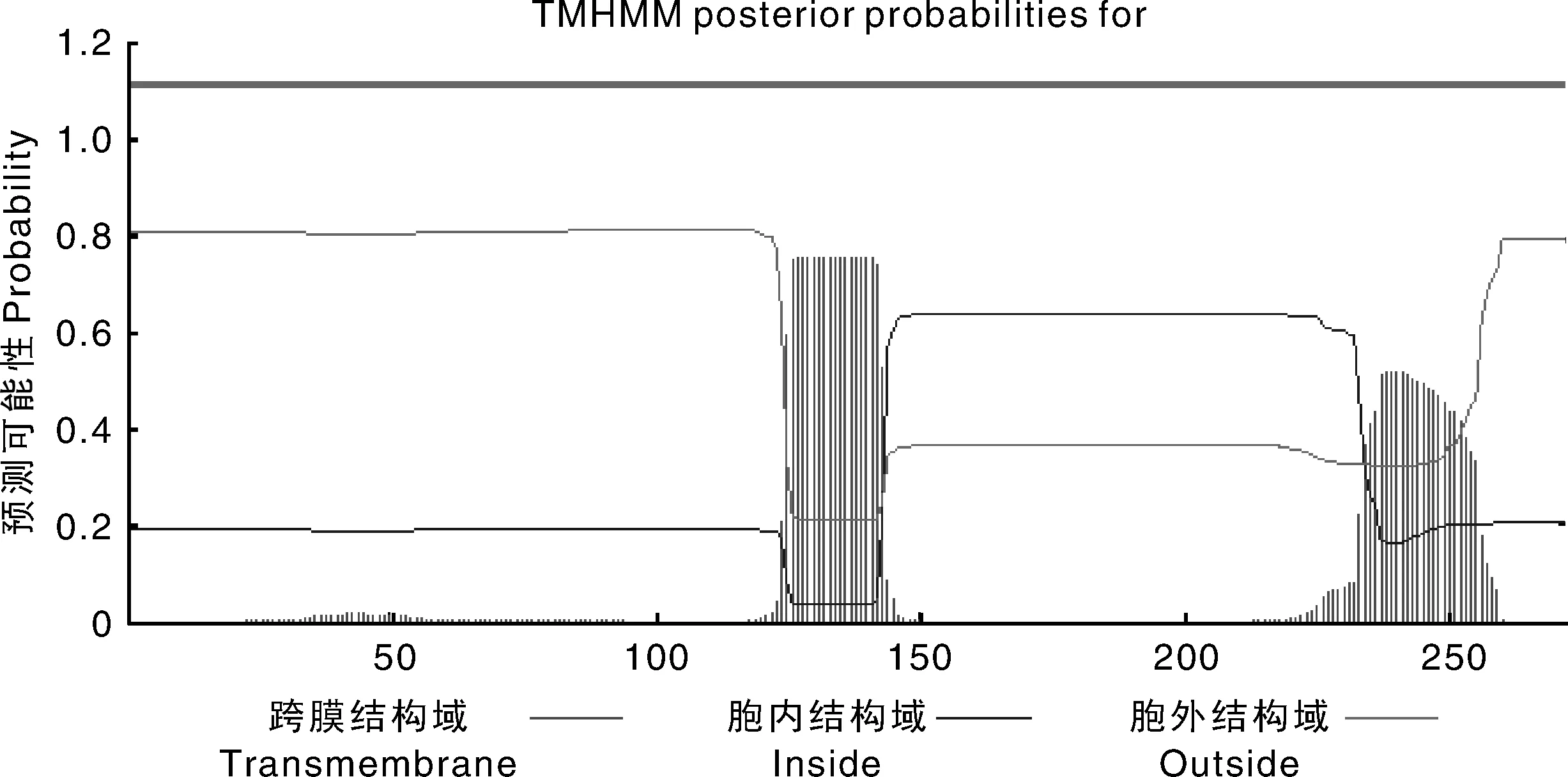
图8 羊口疮病毒AH-F10株023蛋白的跨膜结构域预测Fig.8 Transmembrane domain prediction of ORFV AH-F10 strain 023 protein
2.9 T细胞表位的预测分析

图9 羊口疮病毒AH-F10株023蛋白的磷酸化位点预测Fig.9 Phosphorylation site prediction of ORFV AH-F10 strain 023 protein
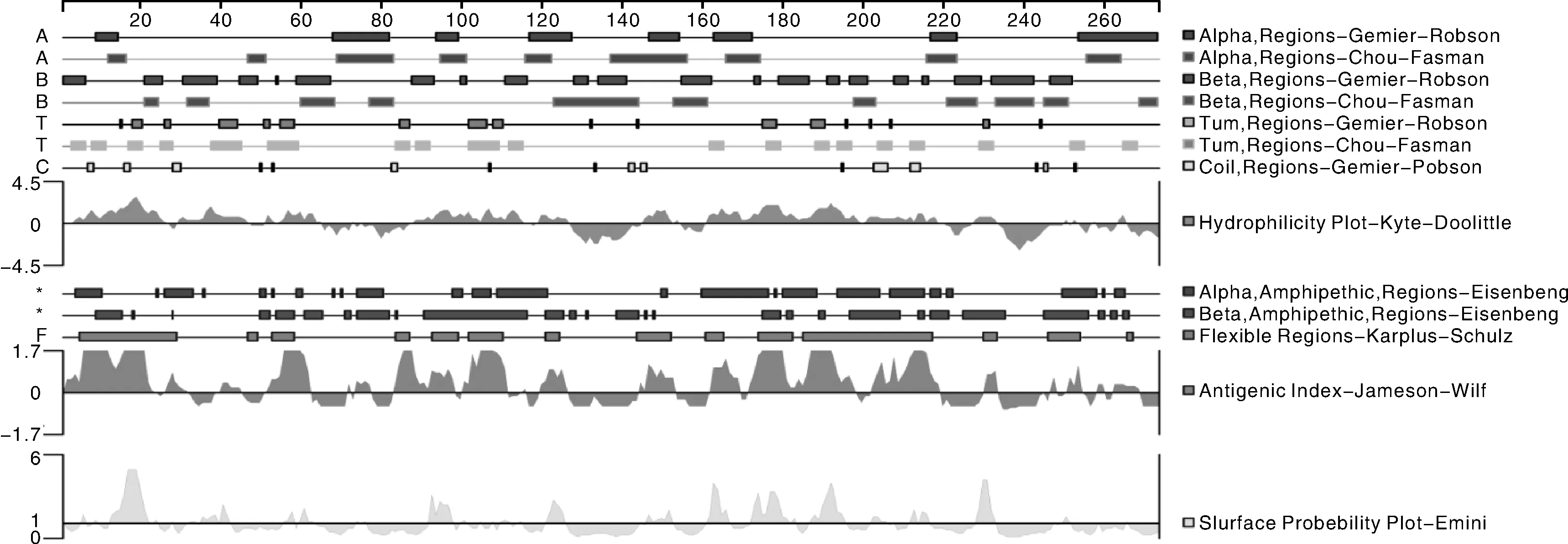
图10 羊口疮病毒AH-F10株023蛋白的B细胞表位预测Fig.10 Prediction of B cell epitopes of ORFV AH-F10 strain 023 protein
表1综合分析ORFV 023蛋白B细胞抗原表位的位置
Table1Analysis of the location of the ORFV 023 protein B cell epitopes in combination with different data

方法Method位置Position二级结构Secondary structure 7~8、15~20、26~30、40~44、83~87、102~110、132~133、142~146、175~178、187~190、195~196、202~207、212~214、230~231、243~246、253亲水性Hydrophilicity1~2、26~28、47~50、65~71、73~87、115~118、126~144、152~160、218~226、233~251、253~256、258~262、265~273柔韧性Flexibility5~29、47~49、53~58、84~87、93~99、102~110、121~124、144~152、161~165、174~182、185~217、230~233、246~254、266~26抗原性Antigenicity1~23、26~31、40~44、51~61、73~76、83~97、100~110、119~125、144~152、161~168、171~197、202~232、246~247、250~253表面可及性Surface probability1~272综合分析Parameter analysis26~28、84~87、144~146、246~254
2.9.1 CTL表位预测
利用nHLAPred的ComPred在线服务器,将阈值调节为0.5,分别预测HLA-A2、HLA-A*0201、HLA-A*0202、HLA-A*0203和HLA-A*0205五种不同分子的结合肽(表2),结果显示,第154~162位的SLLGAVYTT、230~234位的RYDPV和237~242位的FLVFYV可能存在023蛋白的CTL表位。
2.9.2 Th表位预测分析
利用ProPred在线服务器分别预测DRB1-0101、DRB1-0102、DRB1-0301的Th表位(表3),结果显示,第74~76位的FEF、128~135位的LLLSSVPI、237~244位的LVFYVPGI可能存在023蛋白的Th表位。
表2羊口疮病毒AH-F10株023蛋白的CTL细胞表位预测
Table2Prediction of CTL cell epitopes of ORFV AH-F10 strain 023 protein

等位片段Allele顺序Rank起始位置Start position序列SequenceHLA-A2127GLSPLMRHT273KKFEFMFSL3154SLLGAVYTT4226LYYTRYDPVHLA-A*0201134HTYIYNNYA248ETALWSSRL361VTDFYPISL4128FLLLSSVPIHLA-A*02021218TLANLSTIL2234VLCFLVFYV3237FLVFYVPGL4261KLSLAPENVHLA-A*0203148ETALWSSRL261VTDFYPISL3128FLLLSSVPI4231YDPVLCFLVHLA-A*02051178DYKPLFSRL2237FLVFYVPGL343YGWIPETAL4226LYYTRYDPV
3 讨论
ORFV广泛分布于全球养羊地区,且发生频率在世界范围内逐年上升。近年来,在我国黑龙江、河南、福建等地均有ORFV引发疾病的报道[13-15]。ORFV基因组较大,大多数基因的功能还未阐明。Friebe等[11]预测了ORFV 023基因可能编码囊膜蛋白,但未对该基因的结构和功能进行更深一步的研究。鉴于此,为了探索023基因的结构与功能,本试验首先通过原核表达获取023蛋白,同时结合生物信息学方法分析该蛋白分子特性。研究中所采用的生物信息学方法参照了王光祥等[16]的研究,同时制备了ORFV 023蛋白和鼠源多克隆抗体等珍贵的生物材料,为下一步深入研究该蛋白的结构与功能奠定了基础。
本研究采用PCR技术克隆ORFV 023基因,在大肠埃希菌中诱导表达融合蛋白。分析该蛋白的理化性质和疏水性发现该蛋白为亲水稳定蛋白,但SDS-PAGE检测发现融合蛋白既有少量存在于上清中,同时又主要以包涵体的形式存在于沉淀内,包涵体的形成不仅与外界因素有关,同时与蛋白内部是否存在信号肽等结构也有较大关系,有文献报道信号肽结构有利于提高蛋白质的可溶性[17],无信号肽结构的蛋白可能因可溶性较低而更易形成包涵体,生物信息学分析显示ORFV 023蛋白无信号肽结构,从侧面证明实验结果与预测结果相符。Western-blot结果显示,该蛋白能与鼠源抗ORFV血清发生特异性免疫反应,表明ORFV 023蛋白具有良好的特异性和抗原性。生物信息学分析结果显示,ORFV 023蛋白大小约42 ku,与SDS-PAGE结果相符,不存在跨膜结构域,有30个磷酸化位点,二级结构内无规则卷曲及α-螺旋结构较多,β-折叠较少。β-折叠和无规则卷曲区域的二级结构比较松散,稳定性差,更易于盘旋和扭曲,容易与抗体分子结合,因此该区域可能存在优势抗原表位。结合二级结构、亲水性、柔韧性、抗原性、表面可及性等参数预测该蛋白B细胞抗原表位,有效避免了因参数过少而导致结果误差较大,结果显示在第26~28、84~87、144~146、246~254位可能存在优势抗原表位。CTL表位是能与MHC-Ⅰ类分子结合从而诱导相应的CTL发生免疫应答的一类由8~10个连续氨基酸构成的短肽,其本质是抗原呈递细胞处理递呈的一种蛋白,能够活化并决定CTL的特异性杀伤能力[18]。利用nHLAPred的ComPred在线服务器预测CTL表位,结果显示在第154~162、230~234、237~242位可能存在CTL优势表位。Th细胞表位是识别加工后的外源蛋白与MHC-Ⅱ类分子结合的一类抗原表位,能够帮助激活Th细胞并刺激其释放细胞因子参与细胞免疫,同时帮助B细胞产生特异性抗体[16]。利用ProPred在线服务器分别预测DRB1-0101、DRB1-0102、DRB1-0301三种不同的Th表位,结果显示在第74~76、128~135、237~244位可能存在Th优势表位。
表3羊口疮病毒AH-F 10株023蛋白的Th细胞表位预测
Table3Th cell epitope prediction of ORFV AH-F10 strain 023 protein
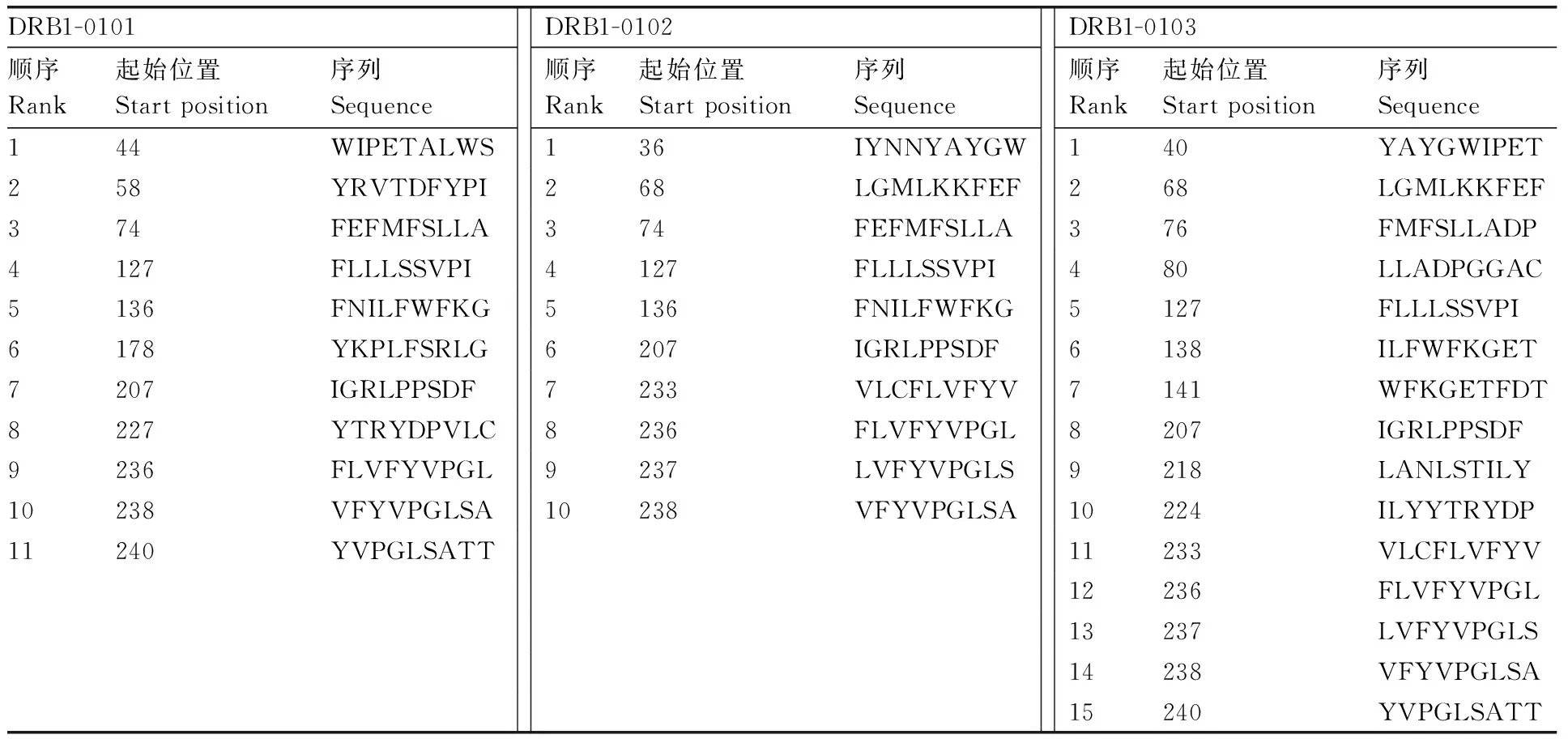
DRB1-0101顺序Rank起始位置Start position序列SequenceDRB1-0102顺序Rank起始位置Start position序列SequenceDRB1-0103顺序Rank起始位置Start position序列Sequence144WIPETALWS136IYNNYAYGW140YAYGWIPET258YRVTDFYPI268LGMLKKFEF268LGMLKKFEF374FEFMFSLLA374FEFMFSLLA376FMFSLLADP4127FLLLSSVPI4127FLLLSSVPI480LLADPGGAC5136FNILFWFKG5136FNILFWFKG5127FLLLSSVPI6178YKPLFSRLG6207IGRLPPSDF6138ILFWFKGET7207IGRLPPSDF7233VLCFLVFYV7141WFKGETFDT8227YTRYDPVLC8236FLVFYVPGL8207IGRLPPSDF9236FLVFYVPGL9237LVFYVPGLS9218LANLSTILY10238VFYVPGLSA10238VFYVPGLSA10224ILYYTRYDP11240YVPGLSATT11233VLCFLVFYV12236FLVFYVPGL13237LVFYVPGLS14238VFYVPGLSA15240YVPGLSATT
本研究首次通过生物信息学方法对ORFV 023蛋白进行生物信息学分析,初步预测023蛋白的结构和功能、潜在的B细胞抗原表位,HLA抗原肽和MHC抗原肽,这为该蛋白的深入研究以及后期建立快速准确的诊断方法奠定了理论基础。

