基于TaqMan PCR鉴定猪源性成分的引物和探针研发
郭 梁,李春冬,徐伟良,郭元晟
(1.锡林郭勒职业学院,内蒙古 锡林浩特 026000; 2.锡林郭勒生物工程研究院,内蒙古 锡林浩特 026000; 3.锡林郭勒食品检验检测和风险评估中心,内蒙古 锡林浩特 026000)
动物源性成分是指动物组织以及蛋和奶,包括肉类及其制品(含动物脏器)、水生动物产品等食品或饲料。动物源性检测是指从动物源性食品(肉制品、乳制品等)以及饲料中检测其源性成分的过程。动物肉类、乳制品为人类的生命活动提供了丰富的蛋白质、脂肪和B族维生素等,是人们生活的重要食品[1]。在利益的驱动下,食品加工、流通和餐饮领域中掺假事件时有发生,一些不法商贩、企业用低价肉或非肉成分经香精处理后冒充高价肉。这些掺杂使假行为不仅严重侵害了消费者利益,有时还会产生不良的社会影响,如果问题产品出口到国外更会损害我国食品企业的整体形象进而影响出口贸易[2]。还有一些商家厂家为牟取利益隐瞒或更改说明书成分甚至生产假冒伪劣产品[3]。动物源性检测可以有效保护消费者合法权利、民族利益、宗教信仰,还能防止牛海绵状脑病(BSE)、传染性海绵状脑病(TSE)、疯牛病(MCD)以及口蹄疫(FMD)等人畜传染病的传播[4-5]。目前,动物源性检测依赖TaKaRa(日资企业)所生产的试剂盒,缺乏自主性,作为肉类产品基地的锡林郭勒盟迫切需要研发具有自主知识产权的动物源性检测试剂盒。
近年来,随着社会经济的快速发展和人们生活水平的日益提高,一方面动物源性食品与人们日常生活的关系愈来愈密切,另一方面消费者对食品的卫生安全有了更高要求[6]。目前,动物源性成分检测技术大多数都是建立在对样品蛋白质、DNA、脂肪酸等分子结构、序列或组成特异性分析的基础上。涉及的技术手段包括酶联免疫(ELISA)、聚合酶链式反应(PCR)、电泳、色谱、生物传感分析等[7]。DNA是一种相当稳定的有机分子,在强烈的加热处理之后仍能保持其稳定性[8],因此,以DNA为基础的聚合酶链式反应(PCR)法的应用最为广泛。其中实时荧光PCR(real-time fluorescent polymerase chain reaction,RT-PCR)法,以它高通量、高效率等优点脱颖而出。RT-PCR技术是基于使用荧光染料(SYBR GreenⅠ)或探针(TaqMan),其能够通过对每个循环的扩增产物进行实时监测而实现对DNA模板进行相对定量。Walker等[9]用SYBR GreenⅠ PCR法检测了猪、鸡和牛等反刍动物DNA。Fajardo等[10]利用SYBR Green检测系统开发了快速实时聚合酶链式反应(PCR)技术,成功检测出肉类中的红鹿、小鹿和獐鹿源性成分。Zhang等[11]使用TaqMan实时PCR法来定量检测肉、牛奶和奶酪中的DNA。Pegels等[12]开发了一种TaqMan实时PCR方法,用于检测动物饲料中鸡、火鸡、鸭和鹅源性成分。TaqMan PCR方法具有特异性强、灵敏度高、可重复、快速等优点。
本研究计划通过比对猪、牛、羊、马、鸡、鸭、兔、鹅8种动物的线粒体基因组,筛选猪特异的引物和探针组合进行荧光定量PCR,研发具有高度特异性和灵敏度的引物和探针,以期为政府食药部门的检测和监管提供技术保障。
1 材料与方法
1.1 材料与仪器
新鲜的猪肉(1、2、3、4、5号样品分别来源于锡林浩特市本地5家商店),羊肉、牛肉、马肉、鸡肉、鸭肉、兔肉、鹅肉、猪肉火腿肠(双汇集团)购买于锡林浩特市本地农贸市场,各500 g。
Probe qPCR SuperMix(北京全式金生物技术有限公司);电泳上样缓冲液和琼脂糖(大连宝生物工程有限公司);凝胶成像系统和T100 PCR扩增仪(美国Bio-Rad公司);2000c Nanodrop 分光光度计(美国Thermo Fisher公司);7300plus实时荧光PCR扩增仪(美国ABI公司)。
1.2 方法
1.2.1 DNA提取
将8种动物的新鲜肉样用液氮研磨,利用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法提取其DNA,方法如下:称取适量研磨好的样品约50 mg,置于1.5 mL离心管中,加入DNA裂解液800 μL,旋涡混匀,在65 ℃金属浴30 min,期间不时振荡混匀;13 000 r·min-1离心5 min,转移上清于洁净离心管中,加入等体积三氯甲烷/异戊醇(体积比24∶1)混合液,充分混匀,13 000 r·min-1离心5 min,取上清液于新的离心管中加入等体积的异丙醇,充分混匀,13 000 r·min-1离心5 min,弃去上清,75%乙醇洗涤一次,晾干,加入适量的ddH2O溶解,通过2000c Nanodrop 分光光度计和琼脂糖凝胶电泳评价所提取DNA的浓度和质量,最终将母液稀释至100 ng·μL-1左右上样。
1.2.2 DNA含量的测定
对提取的DNA含量及纯度进行测定,用D260/D280的比值来进行质量评定,一般比值在1.8~2.0为模板质量较好,说明所提的DNA可以满足后续实验要求。
1.2.3 引物设计与合成
通过比对猪、牛、羊、马、鸡、鸭、兔、鹅8种动物的线粒体基因组,筛选猪特异的序列,利用Primer5软件进行正向引物(LP: 5′-AGAAATGGGCTACATT(T/C)TCT-3′)、反向引物(RP: 5′-TTTACTGCTAAATCCTCCTT-3′)和探针(5′-ROX-CATAAGAATACCCACCATACGAAAGTTTTTAT-BHQ2-3′)的设计。引物和探针由北京睿博兴科生物技术有限公司合成。
1.2.4 实时荧光PCR扩增反应体系
10 μL Probe qPCR SuperMix、正向引物LP和反向引物RP各1 μL(10 μmol·L-1)、探针1 μL、ddH2O 7 μL。反应条件:95 ℃预变性10 min;95 ℃变性5 s,60 ℃延伸31 s,40个循环。每个循环到退火阶段收集荧光信号,Ct值小于35且曲线有明显的对数增长,结果判定为有效数据,反之判定为无效数据。
1.2.5 引物和探针特异性验证
提取猪、牛、羊、马、鸡、鸭、兔、鹅8种动物的肌肉组织DNA,分别对其用荧光定量PCR的方法进行验证。根据各反应体系的Ct值来验证所设计的引物和探针的特异性。
1.2.6 定量检测标准曲线的构建
对提取的猪肉DNA模板进行梯度稀释,应用1.2.3节的引物和探针对其DNA进行荧光定量PCR反应,以Ct值作纵坐标,模板DNA的质量浓度作横坐标,建立回归方程。
1.2.7 检测灵敏度实验
将猪的肌肉基因组DNA分别稀释101~107(共10个模板浓度梯度),在荧光定量PCR检测反应的基础上分别以LP和RP为引物,以不同稀
释浓度的样品DNA为模板进行荧光定量PCR扩增反应程序,反应条件同1.2.4节,进行灵敏度的检测实验。
1.2.8 数据处理
利用7300plus实时荧光PCR扩增仪自带分析软件对结果进行扩增曲线和循环阈(cycle threshold,Ct)的分析。
2 结果与分析
2.1 荧光定量PCR猪特异性扩增结果
通过自主研发的猪特异性引物和探针对8种动物的肌肉基因组DNA(稀释液为模板)进行荧光定量PCR(TaqMan探针方法)扩增实验。由图1和表1可知,只有猪的5个肌肉样品出现典型扩增曲线,Ct值分别为13.32±0.36、13.84±0.79、14.23±1.50、14.10±1.01、14.26±0.92;其他7种动物的肌肉基因组DNA均未出现典型扩增曲线。

图1 利用TaqMan PCR对8种动物肌肉组织进行猪源性检测结果Fig.1 Identification of porcine-derived materials inferred from TaqMan PCR
表1八种动物肌肉基因组DNA的抽提评价以及荧光定量PCR的Ct值
Table1Evaluation of extraction of DNA and Ct values from eight kinds of meat
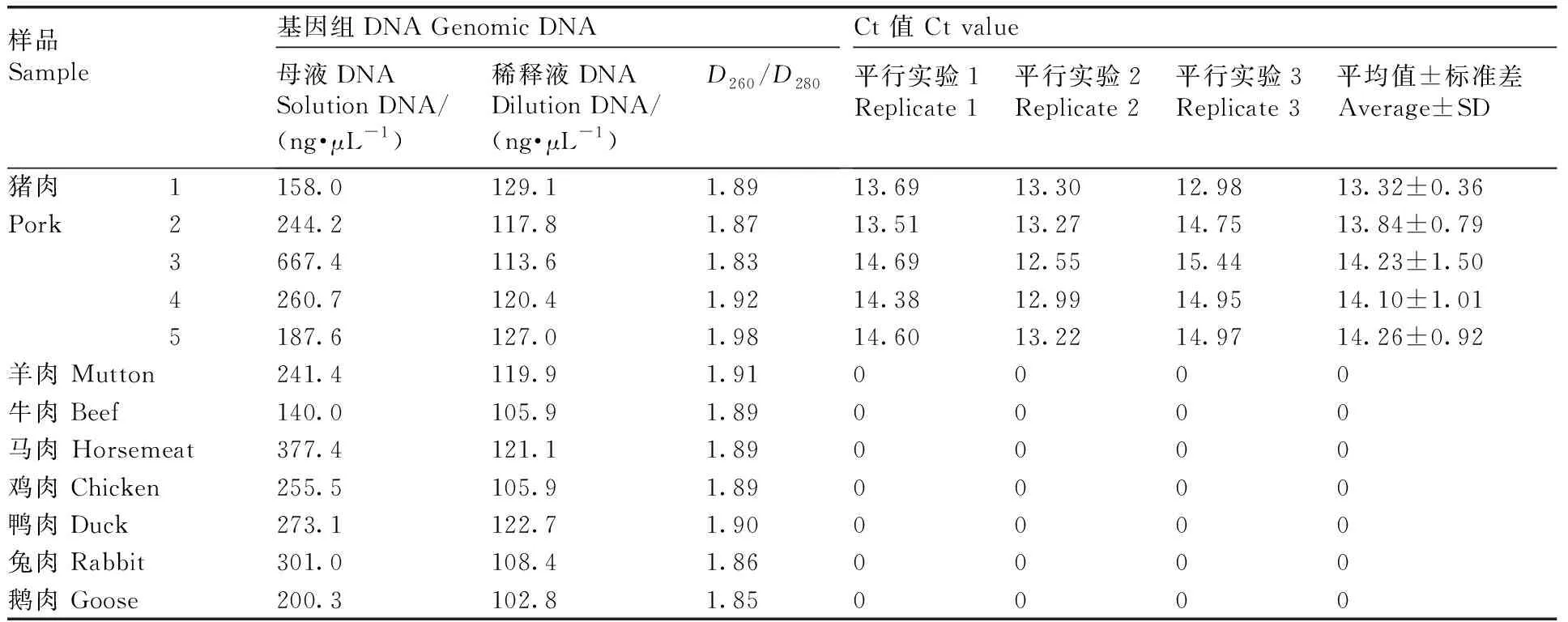
样品Sample基因组DNA Genomic DNA母液DNASolution DNA/(ng·μL-1)稀释液DNADilution DNA/(ng·μL-1)D260/D280Ct 值 Ct value平行实验1Replicate 1平行实验2Replicate 2平行实验3Replicate 3平均值±标准差Average±SD猪肉1158.0129.11.8913.6913.3012.9813.32±0.36Pork2244.2117.81.8713.5113.2714.7513.84±0.793667.4113.61.8314.6912.5515.4414.23±1.504260.7120.41.9214.3812.9914.9514.10±1.015187.6127.01.9814.6013.2214.9714.26±0.92羊肉 Mutton241.4119.91.910000牛肉 Beef140.0105.91.890000马肉 Horsemeat377.4121.11.890000鸡肉 Chicken255.5105.91.890000鸭肉 Duck273.1122.71.900000兔肉 Rabbit301.0108.41.860000鹅肉 Goose200.3102.81.850000
2.2 荧光定量PCR检测灵敏度扩增结果
将猪的肌肉基因组DNA分别稀释101~107(共10个模板浓度梯度)进行引物和探针的检测灵敏度扩增实验。由图2和表2可知,稀释105倍的猪基因组DNA样本出现典型扩增曲线,Ct值为33.43±0.34,小于35,此时稀释的猪基因组DNA的浓度是1 pg·μL-1;小于105稀释的样本均出现典型扩增曲线,而且随着模板稀释的进行,Ct值逐渐变大;当猪基因组DNA稀释至106倍时,虽然3个平行实验都出现典型扩增曲线,但是Ct值已经大于35;随着稀释至107,3个平行实验中有1个未出现扩增曲线,说明已经达到检测极限。综上,本研究自主研发的猪特异性引物和探针的检测灵敏度较高,可达到1 pg·μL-1。
2.3 猪源性成分定量检测结果
利用猪DNA做标准曲线定量检测肉制品中猪源性成分的含量。将猪DNA分别稀释101~107(共10个模板浓度梯度)进行引物和探针的
检测,制作猪源性定量检测标准曲线(图3)。通过将检测肉制品的相应源性的Ct值带入标准曲线中的公式可以得到肉制品中猪源性的定量检测结果。用实时荧光PCR检测加工肉制品(猪肉火腿肠)各5个样品,Ct值分别是15.05、14.79、15.74、15.57、15.56。通过猪的标准曲线计算相应的浓度值为141.25、165.96、91.2、102.33、102.33 ng·μL-1,与实际的浓度值100 ng·μL-1符合程度较高。以上结果说明所研发的动物源性检测的引物和探针具有较好的定量检测能力。

图2 猪源性检测的检测灵敏度结果Fig.2 Detection limit using the primers and probe for pork
表2不同稀释倍数猪DNA荧光定量PCR的Ct值
Table2Ct values for different diluted DNA from pork
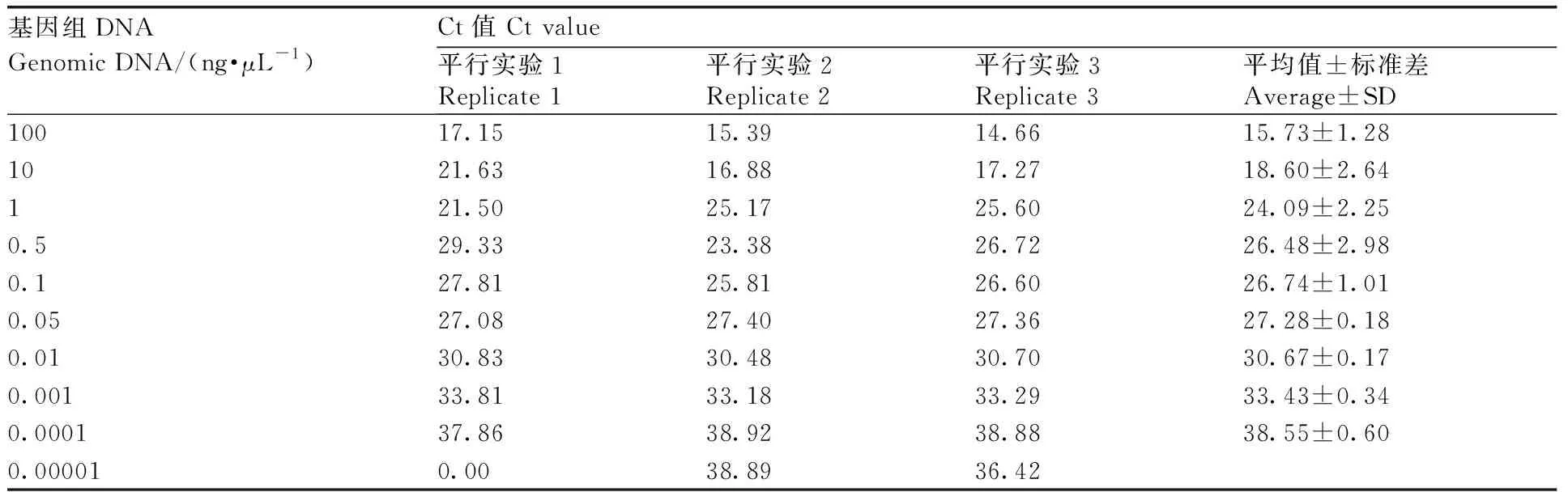
基因组DNAGenomic DNA/(ng·μL-1)Ct值 Ct value平行实验1Replicate 1平行实验2Replicate 2平行实验3Replicate 3平均值±标准差Average±SD10017.1515.3914.6615.73±1.281021.6316.8817.2718.60±2.64121.5025.1725.6024.09±2.250.529.3323.3826.7226.48±2.980.127.8125.8126.6026.74±1.010.0527.0827.4027.3627.28±0.180.0130.8330.4830.7030.67±0.170.00133.8133.1833.2933.43±0.340.000137.8638.9238.8838.55±0.600.000010.0038.8936.42

图3 猪源性定量检测标准曲线Fig.3 Standard curve for quantification of pork
3 结论与讨论
本研究通过比对猪、牛、羊、马、鸡、鸭、兔、鹅8种动物的线粒体基因组,筛选猪特异序列区域设计引物和探针组合,以8种动物的肌肉组织基因组DNA为模板进行荧光定量PCR。结果表明:所研发的针对猪源性检测的引物和探针具有高度的特异性,仅对猪相关DNA模板有典型扩增曲线,对其他动物来源的DNA模板无扩增反应。检测灵敏度实验表明,以引物和探针为基础的检测方法具有高度的灵敏性,可达1 pg级。肉制品中猪源性定量检测实验说明,此方法具有较好的定量检测能力。综上所述,以研发的引物和探针为基础的检测方法可为肉及肉制品中猪源性的检验检测提供技术保障。
在常规的PCR源性检测中,检测人员通常花大量的时间进行重复实验工作,而且每一个样品都需要进行一系列实验才能得出检测结果[13],且敏感性与特异性也比较低;而本实验建立的荧光定量PCR方法可以快速、准确、稳定地检测出动物源性成分,具有较高的特异性,优于李鑫等[14]基于普通PCR技术检测食品中猪源性成分的灵敏度(100 pg);与徐琼等[15]、王晶晶等[16]建立的TaqMan荧光PCR技术检测猪源性成分的灵敏度和特异性相比有一定的优越性。此外,本实验研发的检测猪源性的引物和探针在市售猪肉火腿肠中也能成功检测其源性,跟商品所标志的成分一致,证明本方法具有特异性和灵敏度较高及适用性广等优点。

