黄芪甲苷抑制U937巨噬细胞CCL18表达及其作用机制研究
底雪梅,袁曜晖,张 超,高 越
(1. 同济大学附属第一妇婴保健院,上海 201204;2. 山东中医药大学药学院,山东 济南 2503553;3. 海军军医大学药学院实验教学中心,上海 200433)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性进展性肺纤维化疾病。该病预后差,中位生存期3~5年[1]。其治疗手段有限,有待于有效药物的开发研制。研究发现,黄芪为君药的中药复方对IPF患者有较好的临床疗效[2-3]。黄芪甲苷(AS-Ⅳ)为黄芪中的主要活性成分,最近研究发现黄芪甲苷能通过抑制碱性成纤维细胞生长因子(bFGF)的表达,干预大鼠肺间质纤维化进程[4]。另有实验表明,黄芪甲苷抑制IPF大鼠肺纤维化与其抑制肺组织CD34的表达有关[5]。以上研究表明,黄芪甲苷确有抗肺纤维化作用,但其具体机制尚未被阐明,靶分子尚不明确。
近年来,一些与特发性肺纤维化有关的生物标志物被发现,如趋化因子CCL18。研究发现,IPF患者血清和支气管肺泡灌洗液(BALF)中CCL18含量明显高于健康人群[6-7],血清和BALF中的CCL18水平与肺功能呈负相关,如一氧化碳弥散量[8]。CCL18主要由呈递抗原细胞,如单核细胞、巨噬细胞和树突状细胞分泌[9-10]。在肺纤维化形成过程中,肺泡巨噬细胞被认为是CCL18的主要来源,且在肺纤维化病理中扮演重要角色[11]。关于黄芪甲苷对肺泡巨噬细胞及其CCL18分泌的作用尚未见报道,故本研究拟通过考察黄芪甲苷对CCL18表达的影响来探讨其抗IPF的作用机制。
1 材料与方法
1.1 主要试剂
RPMI1640培养基、青链霉素溶液、叠氮碘化丙锭(PMA)、重组人白细胞介素4(rhIL-4,GIBCO公司);胎牛血清(Biowest公司);吡非尼酮(Shionogi公司);STAT6抑制剂(AS1517499,Axon公司);二甲基亚砜(DMSO,Sigma公司);Cell Counting Kit-8试剂盒(Dojindo Molecular Technologies公司);ISOGEN (Nippon Gene公司);THUNDERBIRD Probe qPCR Mix试剂 (TOYOBO公司);CCL18和β-actin探针(Life Technologies公司);Cell-Based Elisa Kit试剂盒 (R&D Systems公司);Z″-LYTETM激酶检测试剂盒 (Life Technologies公司);各种抗体(BioLegend公司)。
1.2 细胞培养与分化
采用人单核细胞U937细胞株进行培养。培养液:RPMI1640(含10%小牛血清,100 U/ml青霉素、100 mg/ml链霉素);细胞浓度:1×106个/ml;培养环境:37℃,5%CO2,95%饱和湿度。巨噬细胞分化:用10 nmol/L PMA处理U937细胞株48 h,得到U937巨噬细胞。
1.3 细胞活力检测
采用CCK-8法检测细胞活力。主要步骤如下:调整U937巨噬细胞浓度为5×103个/ml(含),种于96孔板,加入rhIL-4(终浓度0.2 ng/ml)及不同浓度的黄芪甲苷溶液(0~800 μg/ml),孵育72 h,每孔加入10 μg/ml CCK-8溶液,37℃,5%CO2孵育1 h,在450 nm处用酶标仪测吸光度。
细胞活力=加药组吸光度(A)值/对照组(A)值×100%。
1.4 Real-time PCR检测基因表达
调整U937巨噬细胞浓度为1×106个/ml,种于6孔板,分别加入rhIL-4(终浓度0.2 ng/ml)及不同浓度的黄芪甲苷溶液(0~200 μg/ml)或20 nmol/L AS1517499,共孵育48 h,收集细胞,按照ISOGEN总RNA提取试剂盒描述的方法提取裂解细胞的总RNA。用ReverTra Ace qPCR RT Master Mix试剂盒进行逆转录,用THUNDERBIRD Probe qPCR Mix试剂盒和7500 FastReal Time PCR System检测CCL18 mRNA表达,所有操作严格按说明书程序进行。引物由生工生物工程(上海)股份有限公司设计并合成,引物序列见表1。以β-actin基因表达作为内参照物,反应条件:95℃,50 s;再95℃,10 s,60℃,30 s,共40个循环。用比较CT值法计算相对表达水平。

表1 Real-time PCR引物序列
1.5 Elisa法测CCL18水平
调整U937巨噬细胞浓度为1×106个/ml,种于6孔板,加入rhIL-4(终浓度0.2 ng/ml)及不同浓度的黄芪甲苷溶液(0~200 μg/ml)或20 nmol/L AS1517499,共孵育48 h,收集细胞,用RIPA缓冲液裂解。用Human CCL18/PARC Quantikine Elisa Kit试剂盒测定CCL18含量,操作严格按说明书程序进行。
1.6 STAT6磷酸化检测
用Cell-Based Elisa Kit试剂盒检测STAT6磷酸化。主要操作为:调整U937巨噬细胞浓度为1×104个/ml,种于96孔板,37℃,5%CO2,孵育过夜,加入rhIL-4(终浓度0.2 ng/ml),药物组加入黄芪甲苷(终浓度200 μg/ml),对照组用培养液补齐,分别孵育0、20、40、60 min。阳性对照组加入20 nmol/L AS1517499,孵育40 min。对所有细胞固定和通透,再依次与一抗(兔抗phospho-STAT6抗体和鼠抗total STAT6抗体)及二抗(HRP标记的抗兔IgG和AP标记的抗鼠IgG)共孵育。最后,分别加入HRP和AP的荧光探针底物,酶标仪检测荧光强度。
1.7 Z″-LYTETM激酶检测
Z″-LYTETM法是一种非细胞离体检测,是基于荧光共轭能量转移来检测多肽底物磷酸化程度,从而检测蛋白激酶的方法。本试验用Z″-LYTETM检测黄芪甲苷对Janus激酶(JAK)家族JAK1、JAK2、JAK3、TYK2的抑制活性,对每种激酶的抑制率按照操作说明以百分比表示。
1.8 参与CCL18表达的STAT6检测
IL-4与IL-4R结合可导致STAT6磷酸化而激活,为检测STAT6磷酸化是否参与CCL18,采用STAT6选择性抑制剂AS1517499,检测其对U937巨噬细胞CCL18表达的影响。
1.9 流式细胞仪检测IL-4R
调整U937巨噬细胞浓度为1×106个/ml,种于6孔板,加入rhIL-4 0.2 ng/ml,除对照组外,加入黄芪甲苷(终浓度200 μg/ml),孵育48 h。收集细胞,再加入Human BD Fc Block以阻断抗体与Fc受体的非特异性组合。然后分别加入PE和APC标记的抗体共孵育,使抗体分别与表面IL-4受体亚基IL-4Rα,common γ chain和IL-13Rα1相结合,所加抗体分别为:PE-抗-CD124 (IL-4Rα)、APC-抗-CD132 (common γ chain)、PE-抗-CD213 (IL-13Rα1)以及同型对照抗体。用流式细胞仪检测各亚基表达,Flowjo软件分析检测结果。
1.10 统计学分析
用SPSS 18.0统计软件完成,多组比较用one-way ANOVA分析,组间两两比较用Dunnett′s法或Tukey′s HSD法,以P<0.05为显著性差异。
2 结果
2.1 黄芪甲苷对细胞活力的影响
本研究采用CCK-8法考察黄芪甲苷的细胞毒作用。与对照组相比,400和800 μg/ml浓度的黄芪甲苷可以显著抑制U937巨噬细胞的细胞活力,细胞相对活力分别为60.8%(P<0.01)和25.7%(P<0.01),而0~200 μg/ml浓度组间比较,无显著性差异(图1)。因此,后续试验采用200 μg/ml及以下浓度进行。
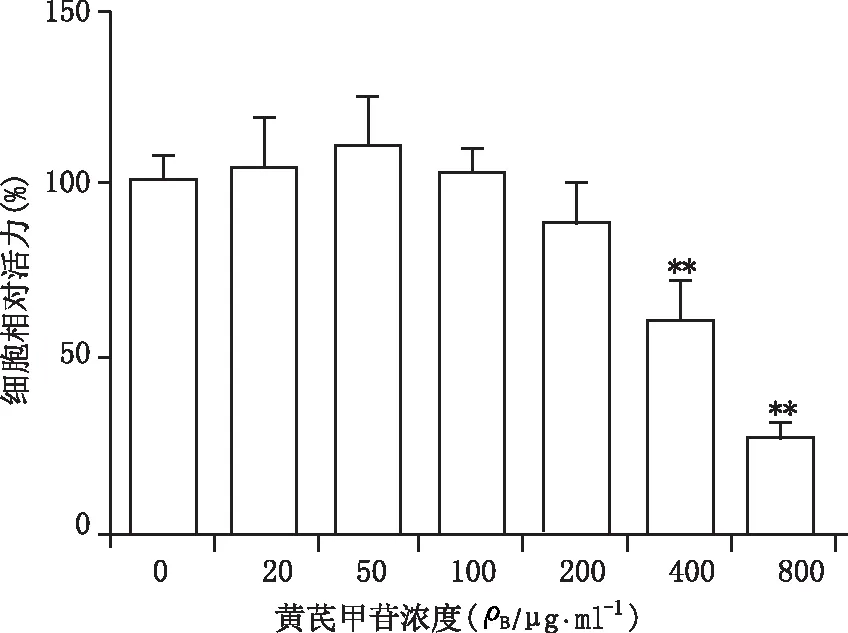
图1 黄芪甲苷对U937巨噬细胞活力的影响 **P<0.01,与对照组即黄芪甲苷0 μg/ml浓度组比较
2.2 黄芪甲苷对U937巨噬细胞CCL18 mRNA和蛋白表达的影响
U937巨噬细胞本身表达低水平的CCL18,而Th2细胞因子如IL-4可刺激巨噬细胞M2型极化,从而上调CCL18的表达。故本试验采用M2极化型U937巨噬细胞考察黄芪甲苷对CCL18表达的影响。试验结果表明,rhIL-4刺激后,CCL18 mRNA和蛋白表达均上调,而黄芪甲苷能显著抑制其上调,且呈明显的量效依赖性(图2)。

图2 黄芪甲苷不同浓度对U937巨噬细胞CCL18 mRNA(A)和蛋白(B)表达的影响 *P<0.05,与对照组比较;#P<0.05,与IL-4组比较
2.3 黄芪甲苷对IL-4R表达的影响
上述试验结果提示黄芪甲苷可能通过影响IL-4R或其下游途径因子的表达而抑制U937巨噬细胞CCL18表达。因此,本试验采用流式细胞仪考察黄芪甲苷对U937巨噬细胞表面IL-4Rα,common γ chain和IL-13Rα1表达的影响。结果显示黄芪甲苷对这些IL-4R组成亚基表达影响不显著(图3)。
2.4 STAT6对CCL18表达的影响
IL-4与IL-4R相结合可导致磷酸化STAT6而使其激活,因此本试验考察STAT6激活是否参与CCL18表达,采用STAT6的选择性抑制剂AS1517499来考察其对U937巨噬细胞CCL18表达的影响。结果显示,AS1517499可显著抑制CCL18 mRNA和蛋白表达,表明IL-4通过STAT6激活途径来促进U937巨噬细胞CCL18表达(图4)。因此,课题组又考察了黄芪甲苷对STAT6磷酸化的影响,结果显示,IL-4刺激可显著促进STAT6磷酸化,而用黄芪甲苷处理40 min可抑制该诱导作用,但AS1517499的抑制作用比黄芪甲苷更强(图5)。

图3 黄芪甲苷对IL-4R各亚基IL-4Rα、common γ chain、IL-13Rα1表达的影响 A.IL-4Rα;B.common γ chain;C.IL-13Rα1

图4 AS1517499对CCL18 mRNA(A)和蛋白(B)表达的影响 *P<0.05,与对照组比较;#P<0.05,与IL-4组比较

图5 黄芪甲苷对STAT6磷酸化的影响 *P<0.05,与40 minIL-4组比较;#P<0.05,分别与对照组、黄芪甲苷组、IL-4组、AS1517499组比较注:“—”表示未加入黄芪甲苷,“+”表示加入黄芪甲苷
2.5 黄芪甲苷对JAK激酶作用的影响
JAK家族如JAK1、JAK2、JAK3及TYK2在IL-4与IL-4R结合后参与STAT6磷酸化过程。Z″-LYTETM激酶检测试验结果表明,黄芪甲苷可显著抑制JAK1、JAK3、TYK2激酶的活性,且呈明显的量效依赖关系,而黄芪甲苷对JAK2激酶影响不明显(图6),提示黄芪甲苷是通过抑制JAK1、JAK3、TYK2激酶的活性来抑制STAT6磷酸化。
3 讨论
既往研究表明,IPF患者肺泡巨噬细胞选择性激活,生物标志物CD206和CCL18的表达上调[11]。巨噬细胞的选择性激活,主要由Th2细胞因子,如IL-4、IL-13诱导[12]。而IPF患者肺组织的细胞因子环境为Th2细胞因子主导[13-14],因此,Th2细胞因子可能涉及IPF的病理过程。CCL18对T细胞、B细胞和未成熟的树突状细胞具有趋化活性以及促纤维化活性[15]。离体试验表明,CCL18可刺激肺成纤维细胞的胶原生成[16]。在体试验表明,大鼠肺组织CCL18的过表达导致T细胞浸润和胶原沉着[17]。临床试验表明,血清CCL18的表达与患者肺功能和生存率呈相关性[6]。因此,CCL18被认为是肺纤维化的重要因子。

图6 黄芪甲苷对JAK激酶活性的影响 A.对JAK1的抑制率;B.对JAK2的抑制率;C.对JAK3的抑制率;D.对TYK2的抑制率*P<0.05,与对照组即黄芪甲苷0 μg/ml浓度组比较
课题组采用IL-4刺激U937巨噬细胞发生M2型极化,来考察黄芪甲苷对其CCL18表达的影响。结果发现,黄芪甲苷能显著抑制CCL18 mRNA和蛋白的表达水平,且呈明显的量效依赖性。为进一步考察其作用机制,考察了其对IL-4信号转导的影响。首先,考察黄芪甲苷是否导致细胞IL-4受体IL-4R表达下调。IL-4R分为Ⅰ型受体和Ⅱ型受体,Ⅰ型IL-4受体由IL-4Rα链与γc(common α)链组成,而Ⅱ型IL-4受体由IL-4Rα链与IL-13Rα1链组成[18]。流式细胞仪分析显示,黄芪甲苷对IL-4受体亚基IL-4Rα(CD124),common γ chain (CD132)和IL-13Rα1(CD213)的表达无显著影响,提示黄芪甲苷不会引起IL-4受体下调。
随后,课题组考察黄芪甲苷对与CCL18表达相关的IL-4受体下游信号因子STAT6的影响。首先,考察STAT6磷酸化抑制剂AS1517499对CCL18表达的影响,结果表明AS1517499显著抑制CCL18 mRNA及蛋白表达,其抑制水平达到未受IL-4刺激的状态,证明IL-4引起的CCL18表达是通过STAT6介导,磷酸化后的STAT6形成二聚体转移至细胞核而引起转录。STAT6磷酸化试验结果表明黄芪甲苷能抑制STAT6磷酸化,尽管抑制作用较AS1517499轻。因此,推测黄芪甲苷对CCL18表达的抑制作用在一定程度上是通过抑制STAT6磷酸化完成的。随之进一步探讨了黄芪甲苷抑制STAT6磷酸化的作用机制。IL-4 与其受体IL-4R结合激活STAT6磷酸化是通过JAK激酶完成。Z″-LYTETM激酶检测结果表明,黄芪甲苷能显著抑制JAK1、JAK3、TYK2激酶的活性,且呈量效依赖关系。
总之,黄芪甲苷可抑制IL-4引起的U937巨噬细胞CCL18的表达。其作用机制可能是通过抑制JAK激酶活性,引起STAT6的转录活性下调,从而抑制CCL18基因表达。然而,由于黄芪甲苷对STAT6磷酸化的抑制作用有限,因此推测只是其抑制CCL18表达的途径之一,是否还通过其他途径尚需要进一步的探讨。

