复方阿达帕林软膏的制备与稳定性研究
陶 春,杨慧丹,,黄爱文,陈珍珍,,张 倩,宋洪涛
(1.福建医科大学福总临床医学院(福州总医院)药学科,福建 福州 350025;2.福建医科大学药学院,福建 福州 350108)
痤疮是一好发于面部、严重者可累及胸背部的毛囊皮脂腺慢性炎症性疾病,多发于青少年,成人也有发生。其发病机制众多,主要包括雄性激素分泌过多、皮脂成分改变、毛囊皮脂腺导管堵塞、细菌感染、炎症因子诱发炎症反应、遗传因素、饮食、环境(温度、湿度、污染等)、生活方式等,且各种致病因素之间可发生相互影响,增加了痤疮的治疗难度[1-6]。
根据中国痤疮治疗指南,外用维A酸类药物是治疗轻度痤疮的一线用药,也是中度痤疮联合用药的首选药物。阿达帕林是第三代维A酸类药物,普遍用于轻-中度痤疮的治疗,可调节组织细胞的分化,防止毛囊上皮细胞过度角化,同时,通过下调鸟氨酸脱羧酶的活性,抑制皮脂腺细胞增生及皮脂过度分泌,具有明确的抗炎作用[7]。
另外,莫匹罗星是一种新型的局部外用抗生素,是荧光假单胞菌的代谢产物,可用于耐药金黄色葡萄球菌等细菌感染的治疗。莫匹罗星具有耐药率低且无交叉耐药的优势[8-10],原因在于莫匹罗星可与异亮氨酸的RNA合成酶特异性结合,从而阻断合成蛋白质所需的异亮氨酸,发挥抗菌作用[11]。
目前,上述两种药物的市售产品主要是阿达帕林凝胶和莫匹罗星软膏,均为单方制剂,两者交替使用较为不便,患者用药依从性差。若将这两种药物制成复方制剂,可使患者用药更加方便。因此,本研究拟制备阿达帕林和莫匹罗星的复方软膏,并对药物的稳定性进行考察和优化。
1 试剂与仪器
阿达帕林对照品、莫匹罗星对照品、糠酸莫米松对照品(中国食品药品检定研究院);阿达帕林原料药(武汉东康源科技有限公司),莫匹罗星原料药(孝感深渊化工有限公司);聚乙二醇400、聚乙二醇3350(中国医药对外贸易公司),三乙醇胺(北京慧立达化工有限公司);乙腈为色谱纯,其余试剂均为分析纯。
高效液相色谱仪(Agilent1200,美国Agilent公司),稳定性试验箱(SHH-SDT,重庆永生实验仪器厂)。
2 方法与结果
2.1 HPLC含量测定方法
色谱柱为Intersil ODS-3(250 mm × 4.6 mm,5 μm),柱温为30℃,流速为1 ml/min,进样量为10 μl。两种药物分别测定:阿达帕林的流动相为0.1%磷酸-乙腈(10∶90),检测波长为321 nm;莫匹罗星的流动相为0.1%磷酸-乙腈(62∶38),检测波长为220 nm。
专属性考察发现,阿达帕林和莫匹罗星峰形良好,对照品与供试品的保留时间基本一致,在阴性对照溶液的色谱图上,药物出峰相应位置未见色谱峰(图1)。
以浓度C(μg/ml)为横坐标,以峰面积A为纵坐标进行线性回归,得回归方程。阿达帕林的回归方程为A=3 171C-1.548,r=0.999 9,在0.044 8~0.896 mg/ml范围内线性关系良好。莫匹罗星的回归方程为A=14 446C-0.053,r=0.999 9,在0.010 8~0.432 mg/ml范围内线性关系良好。精密度的RSD<2%,且低、中、高浓度的平均回收率在95%~105%范围内,RSD<2%,表明精密度、回收率符合要求。

图1 专属性考察HPLC图 A.阿达帕林对照品溶液;B.阿达帕林供试品溶液;C.阿达帕林阴性溶液;D.莫匹罗星对照品溶液;E.莫匹罗星供试品溶液;F.莫匹罗星阴性溶液;1.阿达帕林;2.莫匹罗星
2.2 原料药考察
2.2.1溶解度
取过量的阿达帕林和莫匹罗星原料药,分别加入水、磷酸盐缓冲液(PBS,pH4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)、无水乙醇、1,2-丙二醇及PEG400中,制成过饱和溶液,于37℃、100 r/min恒温水浴摇床中振摇48 h后,将样品以10 000 r/min离心20 min,上清液经0.45 μm的微孔滤膜过滤,取续滤液进样,HPLC测定其中的药物含量,并计算相应的溶解度,结果如表1所示。
阿达帕林在水和不同pH PBS中未测得药物,在无水乙醇和1,2-丙二醇中的溶解度也较小,不足1 mg/ml,在PEG400中溶解度最高,为(4.30±0.05)mg/ml。莫匹罗星在水中的溶解度较小,但伴随pH增大,溶解度逐渐提高,在无水乙醇、1,2-丙二醇和PEG400中的溶解度显著改善。
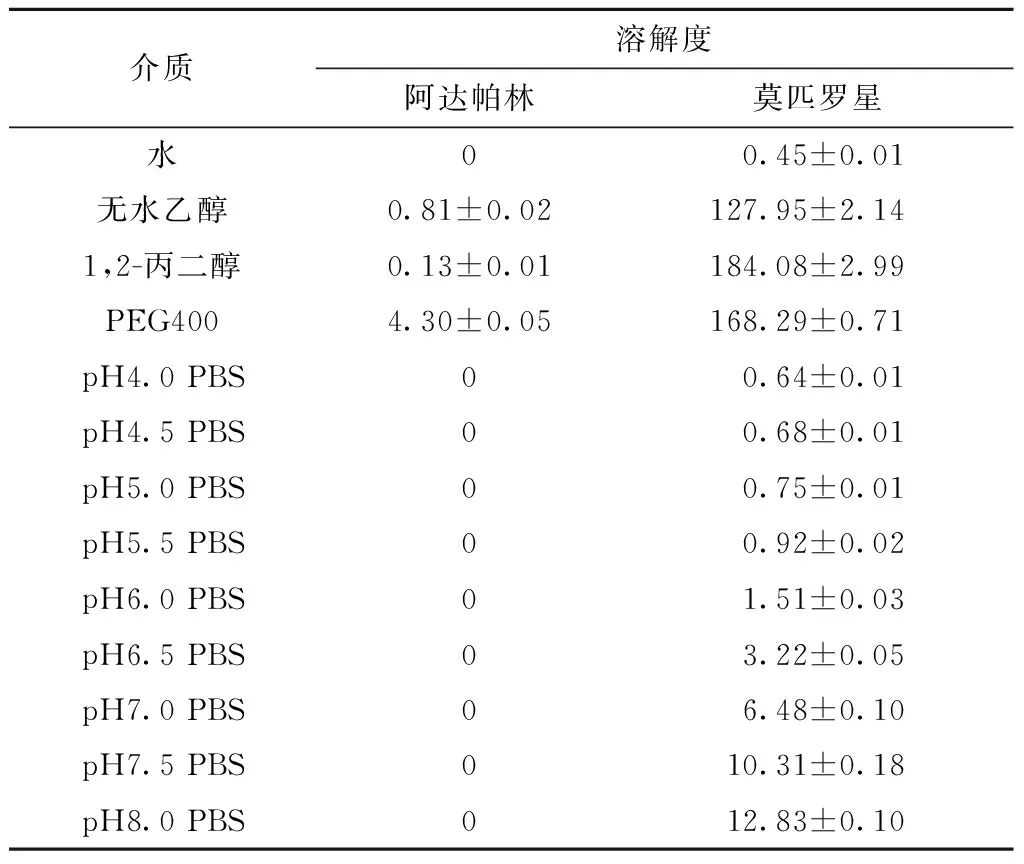
表1 不同介质中阿达帕林和莫匹罗星的溶解度(mg/ml)
2.2.2pH稳定性
取阿达帕林和莫匹罗星溶于PEG400溶液中,调节pH为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,在60℃条件下放置10 d,于0、5、10 d时取样,HPLC测定药物含量,并以0 d时的含量为100%计算。由图2可见,在pH4.0~7.0范围内,放置时间越长,阿达帕林和莫匹罗星的含量降低越显著,而在pH7.0~8.0范围内,两种药物均保持了较高的含量。具体来说,在10 d时,莫匹罗星的含量随pH的增大呈升高趋势,且在pH7.5时达到最大值,为(97.56±0.56)%。对阿达帕林,当pH<7时,含量变化不明显,10 d时的含量均低于60%。pH7.5时,阿达帕林含量迅速增加,并达到最大值,为(99.20±0.56)%。

图2 60℃条件下阿达帕林和莫匹罗星在PEG400溶液中的稳定性 A.5 d;B.10 d
2.2.3影响因素试验
取阿达帕林、莫匹罗星或两者的混合物(阿达帕林∶莫匹罗星=1∶20)置于洁净的表面皿中,放入稳定性试验箱,分别在高温(60℃)、高湿(相对湿度90%±5%)和强光照射试验(4 500 lx±500 lx)条件下放置10 d,于0、5、10 d时取样,HPLC法测定药物含量,并以0 d时的含量为100%计算。
60℃条件下,阿达帕林在5、10 d的含量分别为(98.11±1.27)%和(97.02±0.76)%,稳定性良好(图3A)。相同条件下,混合原料药中阿达帕林仍保持了较高的药物含量,均在95%以上。而莫匹罗星单独放置或在混合原料药中,其含量均显著降低,5 d时样品中莫匹罗星含量少于1%。
在高湿和强光照射条件下(图3B、图3C),阿达帕林与莫匹罗星单独或混合后放置,10 d时的含量均在97%以上,表明药物在高湿和强光照射条件下稳定性良好。
2.3 软膏的制备与优化
2.3.1软膏的制备
阿达帕林和莫匹罗星在PEG400溶液中均有相对较高的溶解度,因此参考市售莫匹罗星软膏(百多邦)的处方,采用PEG3350和PEG400为基质制备软膏。根据市售制剂的药物剂量,确定阿达帕林和莫匹罗星的含量分别为0.1%和2%。
称取PEG400,加入阿达帕林和莫匹罗星,40℃加热至溶解,再加至已在70℃条件下熔化的PEG3350中,在40℃水浴条件下搅拌10 min,冷却后即得。调整PEG400∶PEG3350为2∶1、3∶2、1∶1制备软膏,观察其外观和涂展性能。所得软膏呈白色,PEG400∶PEG3350为1∶1时,软膏黏度较大,不易涂抹;而两者比例为3∶1时,软膏过稀;当比例为2∶1时,软膏黏度适宜,易于涂抹,因此确定该比例用于软膏的制备。
2.3.2软膏的高温稳定性
以PEG400∶PEG3350=2∶1,阿达帕林和莫匹罗星的含量分别为0.1%和2%制备软膏,并在稳定性试验箱(60℃)中放置10 d,于0、5、10 d时取样,HPLC法测定药物含量。高温稳定性试验结果显示,软膏中的药物含量均有显著降低,5 d时阿达帕林和莫匹罗星的含量分别为(57.87±1.53)%和(97.10±0.31)%,10 d时分别为(9.33±2.87)%和(7.97±1.19)%。
2.3.3软膏的pH调节
取含0.1%阿达帕林和2%莫匹罗星的PEG400溶液,测定pH,结果显示PEG400的pH值为7.17,而含药PEG400的pH明显降低,pH值为6.32。因此,在原料药pH稳定性试验的基础上,在软膏中加入0.1%、0.2%和0.3%的三乙醇胺以调节pH,测定后发现pH值依次为(7.00±0.04)、(7.31±0.05)和(7.51±0.07)。
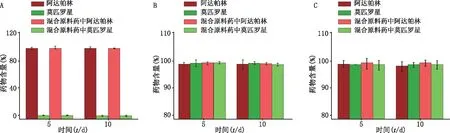
图3 不同条件下阿达帕林和莫匹罗星原料药的稳定性 A.高温(60℃);B.高湿(相对湿度90%±5%);C.强光照射(4 500 lx±500 lx)
将上述药物溶液于60℃放置10 d,于0、5、10 d时取样,HPLC法测定药物含量,并以0 d时的含量为100%计算。结果如图4所示,加入三乙醇胺后,阿达帕林和莫匹罗星的含量显著提高。3种比例的三乙醇胺中,0.2%的三乙醇胺对阿达帕林和莫匹罗星的稳定性有最佳的促进作用,10 d时的含量均达到96%以上,与市售制剂接近。因此,确定在处方中加入0.2%的三乙醇胺。

图4 60℃条件下含三乙醇胺的阿达帕林和莫匹罗星在PEG400溶液中的稳定性 A.阿达帕林;B.莫匹罗星
2.4 优选软膏的稳定性考察
2.4.1影响因素试验
制备3批含0.2%三乙醇胺的复方阿达帕林软膏置于稳定性试验箱中,分别进行高温(60℃)、高湿(相对湿度90%±5%)和强光照射试验(4 500 lx±500 lx),于0、5、10 d取样进行检测,并以0 d时的含量为100%计算。如图5所示,10 d时在高温、高湿、强光照射下,软膏中阿达帕林和莫匹罗星的含量均大于97%,表明软膏中的药物具有良好的稳定性。
2.4.2加速试验和长期试验
制备3批含0.2%三乙醇胺的复方阿达帕林软膏,装入铝塑管中,置稳定性试验箱中进行加速试验,温度为(30±2)℃,相对湿度为(65±5)%以及长期试验,温度为(25±2)℃,相对湿度为(60±10)%,放置6个月,定时取样观察软膏外观,同时测定阿达帕林和莫匹罗星的含量。在试验期间,软膏颜色(白色)无变化,无酸败、异臭、胀气。如表2、表3所示,6个月内,阿达帕林和莫匹罗星的含量均在95%以上。长期试验仍在进行中。
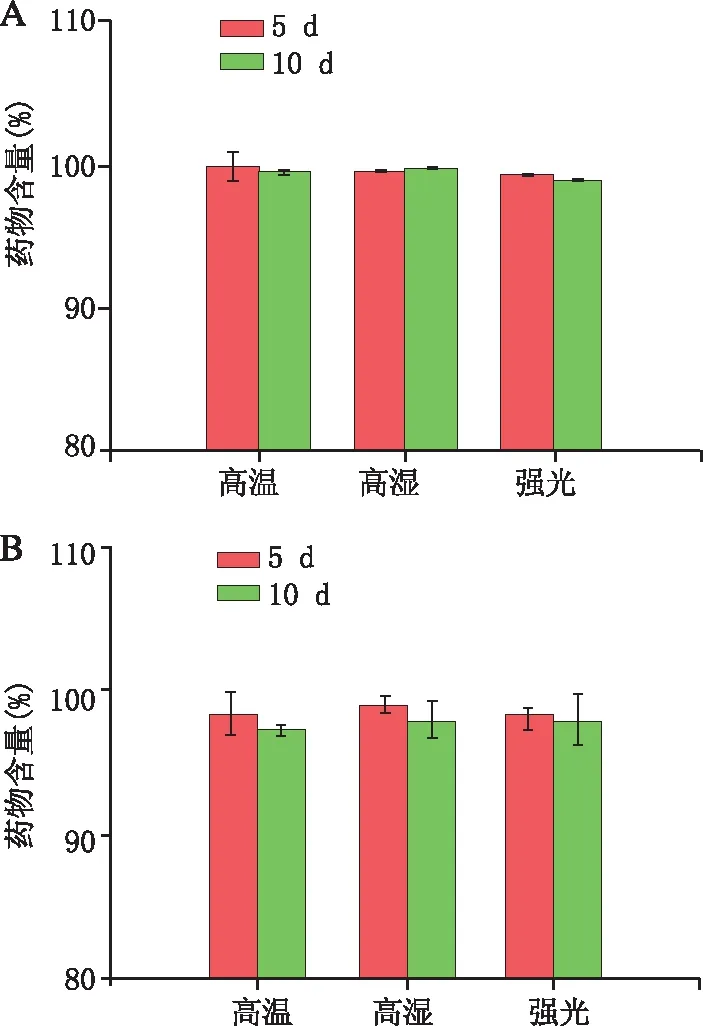
图5 不同条件下含0.2%三乙醇胺复方阿达帕林软膏中的药物稳定性 A.阿达帕林;B.莫匹罗星
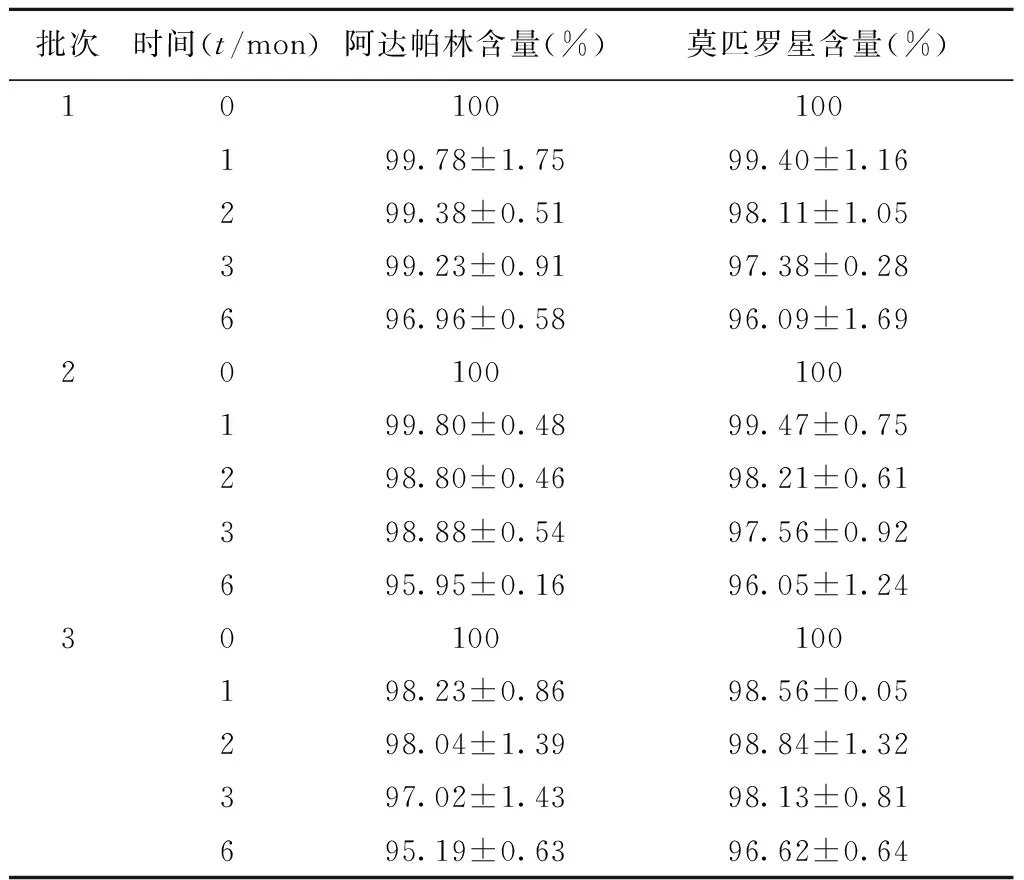
批次时间(t/mon)阿达帕林含量(%)莫匹罗星含量(%)10100100199.78±1.7599.40±1.16299.38±0.5198.11±1.05399.23±0.9197.38±0.28696.96±0.5896.09±1.6920100100199.80±0.4899.47±0.75298.80±0.4698.21±0.61398.88±0.5497.56±0.92695.95±0.1696.05±1.2430100100198.23±0.8698.56±0.05298.04±1.3998.84±1.32397.02±1.4398.13±0.81695.19±0.6396.62±0.64

表3 复方阿达帕林软膏长期试验结果
3 讨论
本研究制备了阿达帕林和莫匹罗星的复方软膏,提供一种用于轻-中度痤疮治疗的复方制剂,旨在解决单方制剂使用不便的问题。
莫匹罗星和阿达帕林的市售剂型分别为软膏和凝胶。其中,市售莫匹罗星软膏含莫匹罗星、PEG400和PEG3350,市售阿达帕林凝胶含阿达帕林、卡波姆、泊洛沙姆、乙二胺四乙酸二钠、对羟基苯甲酸甲酯、丙二醇、氢氧化钠和水等。可见以PEG为基质的软膏成分简单,而凝胶成分复杂。另外,阿达帕林和莫匹罗星在PEG400溶液中均有相对良好的溶解度(表1),因此本研究以PEG400和PEG3350为基质进行复方软膏的制备。
研究发现,在高温下软膏中的两种药物含量快速降低,主要原因是受pH的影响。在酸性条件下,阿达帕林中的金刚烷基发生断裂,导致药物分解[12]。同时,莫匹罗星中的环氧乙烷基团也易在酸性条件下发生开环而使药物含量降低[13]。因此,本研究通过加入三乙醇胺调节pH,有效改善了软膏中的药物稳定性。但笔者尚未开展软膏的经皮渗透研究,后期将考察处方中是否需要加入促渗剂。

