CA125抗原核酸适体的筛选及鉴定
黄百海,何 雷,李保林,修尘林,赵运旺
1燕山大学环境与化学工程学院,河北 秦皇岛 066004;2秦皇岛市第一医院,河北 秦皇岛 066000
碳水化合物抗原CA125作为上皮性卵巢癌肿瘤标志物[1],到目前为止已被广泛用于肝癌、肺癌、胃癌和乳腺癌的生物标志物[2-3]。人体血清内CA125的水平被认为是一种有效的生物标志物上皮细胞的诊断、治疗和监测的理想指标卵巢癌[4]。目前,检测CA125的方法主要包括酶联免疫分析[5]、化学发光-毛细管电泳(CL-CE)测定[6]、电化学发光(ECL)免疫传感器[7]和荧光免疫分析[8]等。这些CA125检测的方法仍然有如复杂的实验程序、灵敏度低、成本高、检测时间长等缺点,可能会限制检测效率和实用性。目前需要建立一种简单,低成本和高效的检测CA125方法。
核酸适体具有高亲和力、强特异性,其自身能折叠成特定的空间结构与靶标分子特异性结合,常被称为“化学抗体”[9-12]。与蛋白抗体相比,核酸适体具有特异性更高、亲和力更强、稳定性好、免疫原性和毒性低、易于合成、化学修饰及穿透肿瘤组织等优点[13-15]。然而目前核酸适体在肿瘤学检测方面仍处于研究阶段,目前研究未见报道CA125抗原核酸适体的筛选。本研究以CA125抗原为靶标分子,利用消减SELEX技术进行筛选出能与CA125抗原特异性结合的核酸适体,建立一种简单、快速的基于核酸适体检测肿瘤血清标志物CA125抗原的分析方法,也为靶向药物治疗研制提供一定的思路。
1 材料与方法
1.1 材料
ssDNA文库: 5’-GCAATGGTACGGTACTTCCN40-CAAAAGTGCACGCTACTTTGCTAA-3'(N=A、G、T、C);上游引物P7序列:5’-CTATAGCAATGG TACGGTACTTCC-3’(9.6nmol/L,A:2.0);下游引物P11序列:5’-TTAGCAAAGTAGCGTGCACTTTTG-3’(4.2 nmol/L,A:1.0)及Bio-P11(4.2 nmol/L,A:1.0)引物由上海生工合成。1×Binding buffer(137 mmol/L NaCl, 2.7 mmol/L KCl, 6.5 mmol/L Na2HPO4, 1.8 mmol/L NaH2PO4, 2.5 mmol/L MgCl2,1 mmol/L CaCl2)
1.2 CA125核酸适体筛选
取100 pmol的ssDNA文库,用1×Binding Buffer稀释到1 mL,充分混匀,95 ℃、10 min及4 ℃、10 min。将预处理好的ssDNA文库与CA199抗原-磁珠复合物孵育,37 ℃孵育1 h,分离磁珠,回收上清,将上清与CA125抗原-磁珠复合物孵育,37 ℃孵育1 h。1×Binding Buffer洗磁珠,加入200 μL纯水,95 ℃加热5 min,回收上清。
1.3 链霉亲和素磁珠法制备次级ssDNA
整个筛选过程中,PCR的控制特别关键。在PCR扩增过程中引入有生物素修饰的引物,通过对称PCR扩增每一轮的次级ssDNA文库获得量较大的标记有生物素的dsDNA产物。将扩增获得的的双链DNA产物通过链霉亲和素-生物素系统与磁珠特异性结合。经过5%甲酰胺37 ℃孵育5 min,洗去非特异结合的dsDNA。通过95 ℃热变性使双链DNA解旋实现其分离。再对其进行磁分离,收集上清液即获得次级ssDNA文库。
1.4 ELONA法实时监测筛选进程
按照链霉亲和素磁珠法制备次级ssDNA文库的方法,利用生物素标记的引物扩增获得标记有生物素的次级ssDNA文库。分别取50 μL磁珠于两个1.5 mLEP管中,分别标记为“1+”、“1-”;“1+”、“1-”EP管分别与200 μL CA125抗原、200 μL CA199抗原,37 ℃孵育1 h;投入每轮标记后的ssDNA文库,37 ℃孵育30 min,1×Binding Buffer洗3次,然后加入1∶1000稀释 的 HRP-labeled Streptavidin 37 ℃ 孵 育 30 min,1×Binding Buffer(含1.5% Tween-20)洗3次,200 μL TMB显色液,避光显色15 min,50 μL 1 mol/L H2SO4终止反应,置于酶标仪测定A450nm值。
1.5 二代测序及数据分析
二代测序文库送至上海生工生物工程有限公司进行二代测序。预计每个文库测序得到约10000条序列。
1.6 核酸适体的二级结构分析
二代测序结果进行生物信息学分析。采用Clustal X软件和DNAman软件分析二代测序结果,拷贝数>1000的核酸适体的保守序列。采用 mfold 软件(Version 3.2)分析核酸适配体的二级结构。
1.7 ELONA法测定核酸适体CA125抗原的特异性
将包被CA125抗原、CA199抗原、CA125抗体、CA199抗体的磁珠分别与标记有生物素的候选核酸适配体37 ℃孵育30 min,1×Binding Buffer(含1.5%Tween-20)洗3次,然后加入1∶1000稀释的HRP-labeled Streptavidin 37 ℃ 孵 育 30 min,1×Binding Buffer(含1.5% Tween-20)洗3次,200 μL TMB显色液,避光显色15 min,50 μL 1 mol/L H2SO4终止反应,置于酶标仪测定A450nm值。
1.8 核酸适体的解离常数检测
将包被CA125抗原的磁珠与不同浓度FAM标记的候选核酸适体避光37 ℃孵育1 h,1×Binding Buffer(含1.5% Tween-20)洗3次。用TBS-380荧光定量仪检测结合前后核酸适体的荧光强度变化,通过非线性回归分析得到相应核酸适体的解离常数Kd。
2 结果
2.1 每轮ssDNA文库的亲和力测定结果
采用消减SELEX技术循环筛选,利用生物素—链霉亲和素-辣根过氧化物酶系统检测1-6轮ssDNA文库与CA125抗原的亲和力。结果表明,亲和力在1~5轮明显上升,第5轮SELEX筛选以后达到饱和。因此在第6轮时终止筛选(图1)。
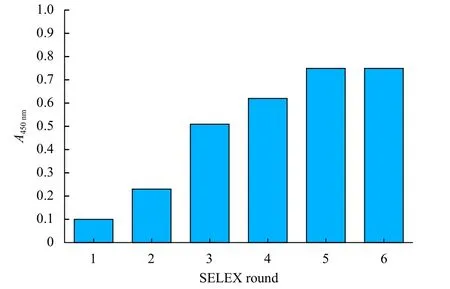
图1 1-6轮ssDNA文库亲和力测定结果
2.2 CA125抗原特异性核酸适体的筛选
以CA125抗原为筛选靶标,CA199抗原作为反筛选靶标,经过6轮SELEX筛选获得饱和的次级ssDNA文库。以每轮获得的次级ssDNA文库为模板通过对称PCR扩增,PCR产物经3%琼脂糖凝胶电泳检测,结果显示每一轮的PCR产物片段大小均在100 bp以下出现单一条带(片段大小为88 bp)(图2),与初始ssDNA文库片段大小吻合。第6轮SELEX筛选获得的次级ssDNA文库经对称PCR扩增获得的产物进行二代测序,测序数据经去掉两端引物序列和两端adapter,得到10000条序列,合成拷贝数>1000的核酸序列。最终经序列比对获得了3条与CA125抗原高特异性结合的核酸适体。表1为核酸适体测序结果。
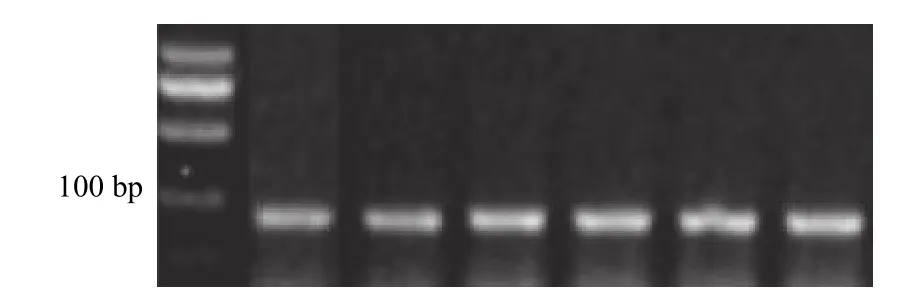
图2 1-6轮ssDNA PCR产物琼脂糖凝胶电泳检测结果
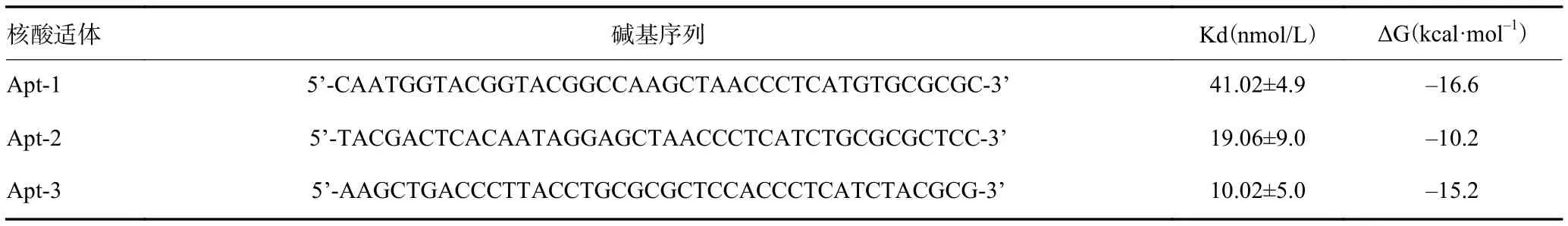
表1 核酸适体测序结果
2.3 核酸适体的同源性分析和二级结构预测结果
采用消减 SELEX 技术筛选核酸适体,通常对作用力达到饱和的核酸适体次级库进行二代测序,但是这个SELEX筛选的终止不能反映在筛选过程中DNA的定向进化趋势。随着筛选轮数的增多,会存在一些核酸序列减少,而一些核酸序列增加的趋势。所以将获得的核酸适体次级库进行高通量测序,从而系统分析在整个筛选流程中DNA的富集历程。随筛选轮数的增多,剩下来的核酸序列逐渐减少,到6轮时核酸适体序列数基本保持不变。
二代测序后,利用DNAman对3条核酸适体经多序列比对和同源性分析。图3所示代表性核酸适体中间区域之间的同源性,测序结果与预期长度一致,得到的核酸适配体中富含 G、C 碱基,其同源性达68.24%。同时,发现AGCT、ACCCCT和TGCGCG序列均在这3条核酸适体中存在,因此可以推断CA125抗原特异识别AGCT、ACCCCT和TGCGCG 3种保守DNA序列,而其余的序列则有一定的变化。
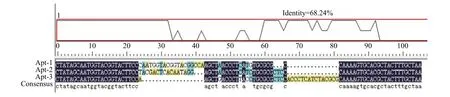
图3 核酸适体同源性分析结果
由于核酸适配体是利用其形成特殊的、稳定的二级结构去识别和结合靶标,因此我们对3条核酸适体的核酸序列进行了二级结构预测。3条核酸适体的二级结构绝大部分为茎环结构,环主要为凸环和圆环(图4)。提示,茎环可能就是核酸适体与CA125抗原结合的结构学基础,茎起到稳定支持适配体空间结构的作用,环通过碱基堆积、疏水相互作用和氢键作用等发生折叠形成高度结构化的与靶分子结合的位点,不同的结构具有不同的空间结合方式。
ssDNA二级结构其最低自由能代表了DNA空间结构的稳定性,其最低自由能越小,核酸适体所形成的二级结构越稳定。mfold软件计算的3条核酸适体的自由能(ΔG)最低能量值见表1。
2.4 核酸适体亲和力分析
对筛选得到的3条核酸适体(Apt-1、Apt-2、Apt-3)进行解离常数Kd的测定。荧光值在一定范围内与3条核酸适体的浓度呈正比关系(图5),说明3条核酸适体与CA125抗原具有较高的亲和力。用GraphPad Prism v5.0 拟合3条核酸适体的解离曲线,在3条核酸适体中Apt-3 Kd值最小(表1),亲和力最高。
2.5 特异性分析
CA199抗原、CA125抗体、CA199抗体对3条核酸适体与靶标分子的特异性结合均无明显干扰作用,以核酸适体与CA125抗原结合的荧光强度为对照。特异性最强的是核酸适体Apt-3,其次是核酸适体Apt-2(图6)。
3 讨论
核酸适体能与靶标分子高特异地结合,在一定情况下能发挥某些生物学效应,核酸适体在自诊断和治疗领域,将有望与传统抗体相媲美[9]。Ireson等[16]利用合成的DNA适体与荧光淬灭方法可以高通量地检测和区分体液中不同种类的蛋白质。CA125是最常见的一种肿瘤血清标志物,而本研究则利用消减SELEX技术,以磁珠为筛选介质,其分离效率高,一轮SELEX筛选过程为3 h,缩短了筛选周期。通过6轮快速筛选得到CA125抗原特异核酸适体。并利用该核酸适体建立一种快速检测CA125的方法。该实验耗时不足1 h,同时免去ELISA中的反复洗板过程,成为本研究的最大亮点。

图4 核酸适体二级结构预测结果

图5 核酸适体亲和力检测结果
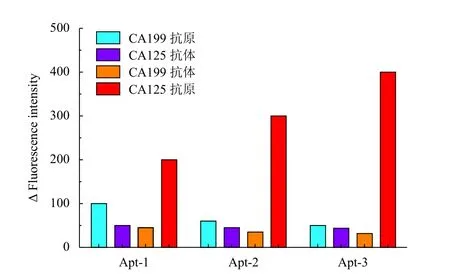
图6 3条核酸适体特异性分析结果
利用消减SELEX技术筛选核酸适体的方法,可将两个同源的复合靶标中共同分子的核酸适体序列先进行消减[17],进而快速、高效获得差异靶分子的特异核酸适体[18-20]。整个实验流程采用(次级)库结合磁珠,经孵育、洗脱、PCR扩增获得标记有生物素的dsDNA,链霉亲和素磁珠孵育制备次级ssDNA文库,免去不对称PCR制备过程中产生非特异ssDNA[21]。最后经高通量测序确认富集程度和准确获得较全面的富集核酸适体,避免了克隆后测序,造成核酸适体的丢失和不完整。其优点是成本较低、操作简单、快速、准确、全面等,并且能有效的消减去除非特异ssDNA的富集,筛选效率得到有效提高,筛选得到的核酸适体结构主要以茎环和凸环为主,提示可能是CA125与核酸适体结合的结构基础。另外,还可以通过筛选得到的高特异性的核酸适体组直接通过实时荧光定量-PCR检测待测样本血清,该实验过程耗时不足50 min。
本研究选用的文库是含40 nt的随机序列,总长为88 nt的DNA文库。通过严格的筛选条件(孵育时间,金属离子,洗脱时间,靶标分子浓度等)的优化,不断增加SELEX筛选中的筛选压力,采用ELONA法实时监测筛选进程,最终获得的Apt-3高特异性、高亲和力的核酸适体。后续的实验中将通过序列裁减和修饰优化,有利于进一步研究筛选得到的功能核酸适体与CA125抗原的结合位点,为肿瘤标志物的检测提供了一种有效的工具和手段。对抗原与核酸适体相互作用机理的研究提供了理论基础[22-23]。