慢性HBV感染患者血清白细胞介素-34水平及其与疾病关系的研究*
薛 红 邵建国 卞兆连&
南通大学附属第三人民医院肝病科1(226006) 南通大学附属第三人民医院消化内科 南通市肝病研究所2
背景:乙型肝炎病毒(HBV)感染是全球主要健康问题之一,其发病机制尚未完全明确,研究显示细胞因子介导的免疫应答在其中起关键作用。目的:检测慢性HBV感染患者的血清白细胞介素-34(IL-34)水平,探讨IL-34与疾病进程的相关性。方法:2015年8月—2016年8月在南通大学附属第三人民医院住院治疗的90例慢性HBV感染患者[慢性乙型肝炎(CHB) 60例,乙型肝炎相关肝硬化30例]纳入研究,30名同期健康体检者作为对照组。采用ELISA法检测血清IL-34水平,同时行血清生化和病毒学指标检测,分析IL-34与生化、病毒学指标的相关性。结果:与对照组相比,CHB组和肝硬化组血清IL-34水平明显升高(P<0.05),肝硬化组较CHB组升高更为显著(P<0.05)。Spearman相关系数分析显示,CHB组血清IL-34水平与ALT、AST水平呈显著正相关(rs=0.288,P=0.026; rs=0.385,P=0.002),与HBV DNA水平呈显著负相关(rs=-0.325,P=0.011)。结论:慢性HBV感染患者血清IL-34水平显著升高并与疾病进程相关。IL-34可能成为治疗慢性HBV感染的免疫学靶点。
乙型肝炎病毒(hepatitis B virus,HBV)感染目前仍然是全球主要健康问题之一,全球约有20亿人曾感染HBV,其中2.4亿人为慢性感染者[1],给个人和社会带来极大的经济负担,每年约有65万人死于HBV感染相关肝衰竭、肝硬化和肝细胞癌。HBV感染的发病机制迄今尚未完全明确,大量研究显示细胞因子介导的免疫应答在疾病进展和临床转归中起关键作用[2]。白细胞介素(interleukins,ILs)作为一类重要的细胞因子,在慢性HBV感染中的作用受到越来越多的关注。
IL-34于2008年首次被发现,其为集落刺激因子-1受体(colony stimulating factor-1 receptor,CSF-1R)的另一个配体,即与巨噬细胞集落刺激因子(macrophage-colony stimulating factor,M-CSF)拥有共同受体。IL-34与M-CSF具有相似的生物学功能,能诱导细胞因子或趋化因子分泌,调节机体免疫功能,参与机体免疫炎症反应,在各种炎症性和自身免疫性疾病中发挥重要作用[3-6]。既往研究发现,IL-34在类风湿关节炎患者中表达明显升高,并与疾病严重程度呈正相关[7];在丙型肝炎病毒(HCV)感染相关肝纤维化中,血清 IL-34水平与纤维化程度呈正相关[8];非酒精性脂肪性肝病(NAFLD)患者亦存在血清IL-34水平升高[9]。
2017年国内Cheng等[10]的研究首次发现慢性HBV感染患者血清IL-34水平和外周血单个核细胞中的IL-34 mRNA表达较健康人显著降低,且血清IL-34水平与病毒载量和肝功能指标呈显著负相关。本研究通过检测慢性乙型肝炎(chronic hepatitis B,CHB)和乙型肝炎相关肝硬化患者的外周血IL-34水平并分析其与患者临床参数的相关性,旨在进一步明确IL-34在慢性HBV感染患者中的表达情况及其与疾病进程的相关性。
对象与方法
一、研究对象
连续纳入2015年8月—2016年8月首次因CHB或乙型肝炎相关肝硬化在南通大学附属第三人民医院住院治疗的患者。诊断符合中华医学会肝病学分会、中华医学会感染病学分会于2015年修订的《慢性乙型肝炎防治指南》[1],并排除合并其他病毒性肝炎、人类免疫缺陷病毒感染以及自身免疫性疾病。正常对照组来自同期健康体检人群。研究方案经医院伦理委员会审核批准,标本采集取得受检者知情同意。
二、方法
采集入选CHB和肝硬化患者的病史资料。所有受检者晨起抽取静脉血5 mL,离心取血清,标本置于-20 ℃保存。采用ELISA法检测血清IL-34水平,试剂盒为R&D Systems产品,操作按试剂盒说明书进行。江苏鸿恩全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALB)、总胆红素(TBil)水平;迈瑞全自动血液细胞分析仪检测血小板计数(PLT);电化学发光法检测甲胎蛋白(AFP)水平;Real-time PCR检测HBV DNA水平。
三、统计学分析
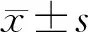
结 果
一、一般资料
研究共纳入120例受检者,其中CHB组60例,肝硬化组30例,对照组30例。三组间性别构成、年龄差异无统计学意义(P>0.05);与对照组相比,CHB组、肝硬化组血清ALT、AST、TBil水平明显升高,ALB水平降低,三组间总体差异均有统计学意义(P<0.05)(表1)。
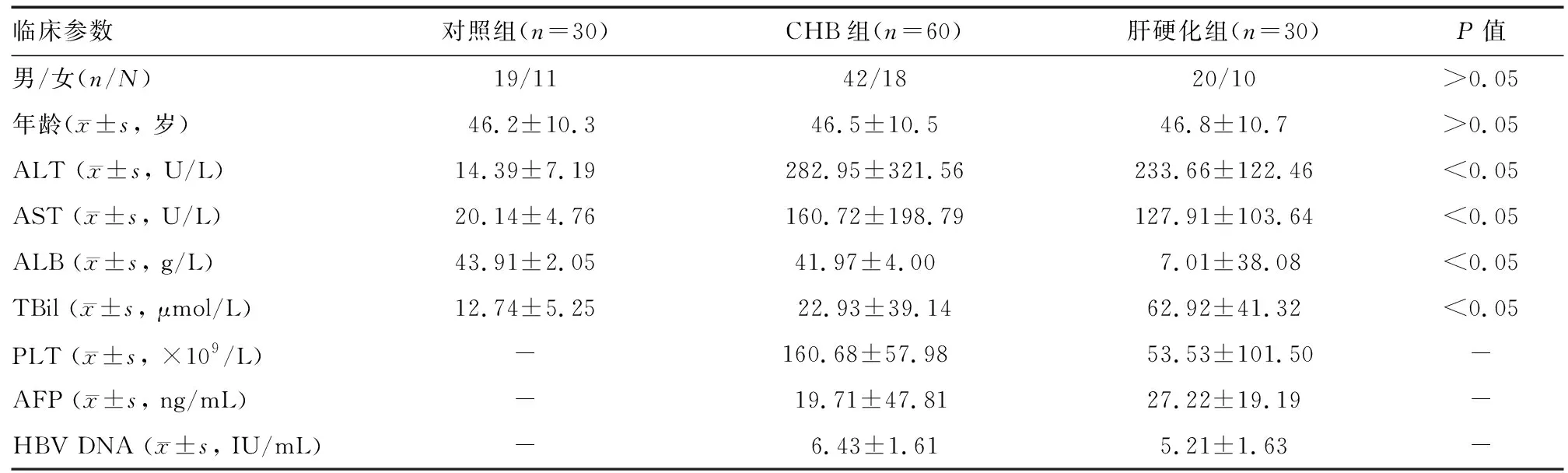
表1 CHB组、肝硬化组和对照组临床参数比较
二、血清IL-34水平
ELISA法检测显示,CHB组、肝硬化组血清IL-34水平分别为(10.32±6.74) pg/mL和(16.73±11.64) pg/mL,两组均明显高于对照组的(8.41±2.84) pg/mL,差异有统计学意义(P<0.001),以肝硬化组升高更为明显,与CHB组相比差异有统计学意义(P<0.001)(图1)。
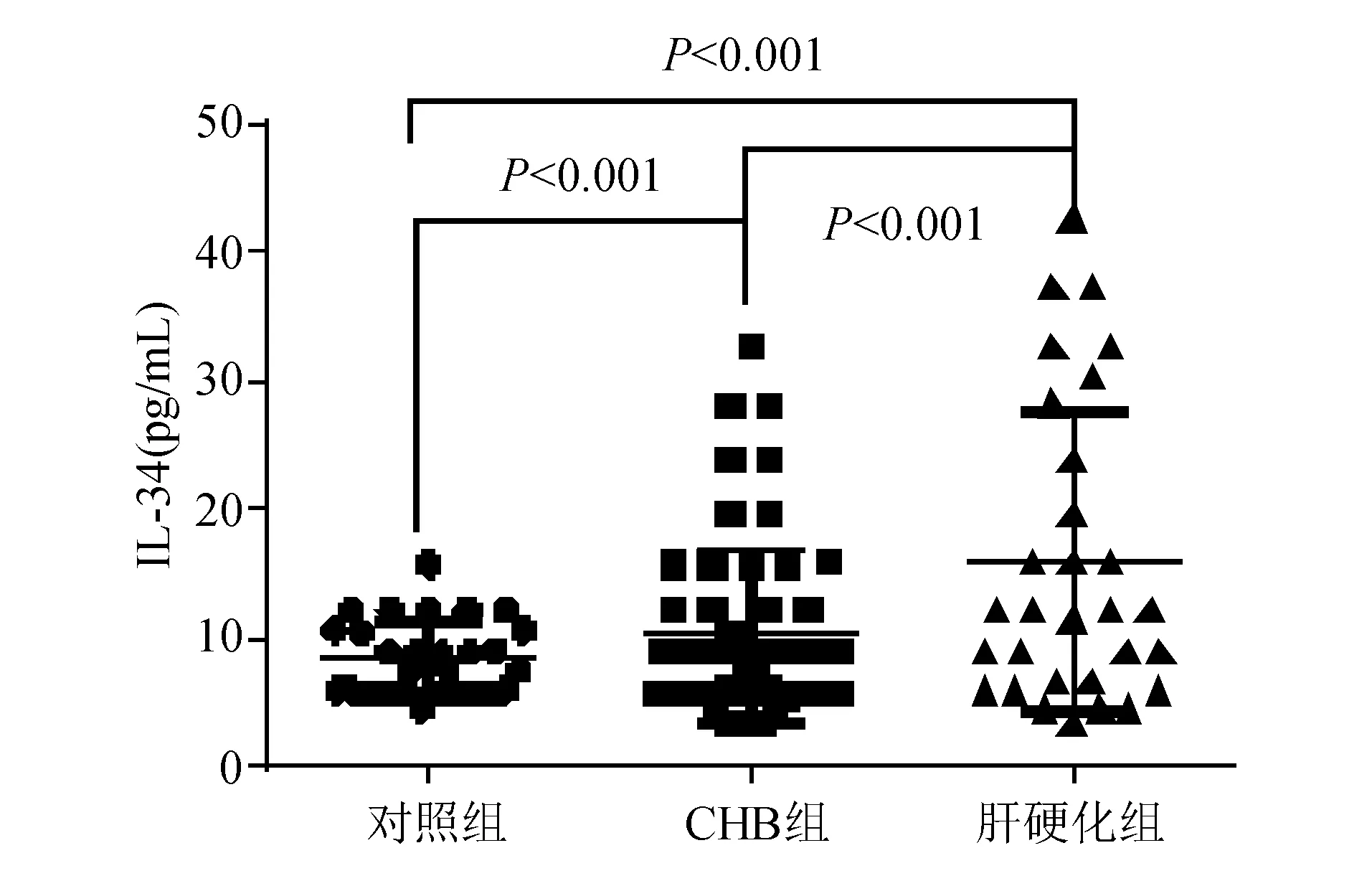
图1 CHB组、肝硬化组和对照组血清IL-34水平比较
三、CHB组血清IL-34水平与血生化、病毒学指标的相关性
Spearman相关系数分析显示,血清IL-34水平与肝功能指标ALT、AST水平呈显著正相关(rs=0.288,P=0.026;rs=0.385,P=0.002)(图2A、2B)。进一步分析IL-34水平与代表病毒复制的HBV DNA水平[log10(HBV DNA)]的相关性,发现两者间呈显著负相关(rs=-0.325,P=0.011)(图2C)。CHB组IL-34与ALB、TBil、AFP之间均无明显相关性。
讨 论
慢性HBV感染可导致包括肝炎、肝硬化、肝细胞癌等在内的一系列肝脏疾病[11],严重影响患者健康,甚至危及生命。已知HBV感染后肝脏炎症的发生并不是由病毒直接导致,而是由宿主免疫反应所引发[2]。越来越多的证据表明细胞因子介导的免疫应答在HBV感染中起重要作用。
IL-34是近年发现的与M-CSF拥有共同受体、参与单核巨噬细胞分化、存活的细胞因子。研究[8]显示在慢性HCV感染过程中,肝细胞产生的IL-34可介导单核细胞聚集并转化为具有促纤维化特性的巨噬细胞,进而激活肝星状细胞,诱导胶原合成,导致肝纤维化进展。而在非病毒性肝病的NAFLD患者中,血清IL-34水平亦随纤维化进展逐渐升高,是肝纤维化的独立影响因素[9]。本研究结果显示,慢性HBV感染患者血清IL-34水平较健康对照者明显升高,以肝硬化组升高更为显著,结合既往研究发现,提示IL-34可能参与了肝纤维化的进展,与慢性HBV感染的疾病进程相关。

图2 CHB组血清IL-34水平与ALT、AST、HBV DNA水平相关性分析
研究表明IL-34可通过与其受体CSF-1R结合,激活细胞合成、释放炎症因子,参与炎症反应,使炎症持续或加重。Eda等[6]发现经IL-34刺激的全血细胞可分泌促炎细胞因子IL-6以及趋化因子干扰素诱导蛋白-10(IP-10)/CXCL10、IL-8/CXCL8、单核细胞趋化蛋白-1(MCP-1)/CCL2。另有研究发现IL-34 在某些条件下可诱导单核细胞分化为具有免疫抑制和免疫调节特性的M2型巨噬细胞[3-4],后者可通过分泌细胞膜IL-1α(mIL-1α),介导记忆T细胞向Th17细胞转化,导致组织局部持续性低度炎症[3]。此外,IL-34还可诱导调节性T细胞(Treg细胞)分化、成熟,参与机体免疫耐受[12]。本研究中CHB患者血清IL-34水平与反映肝脏炎症损伤的ALT、AST水平呈显著正相关。推测在HBV感染过程中,IL-34可能通过诱导单核巨噬细胞增殖、分化,参与肝内炎症反应。本研究还发现,CHB患者血清IL-34水平与HBV DNA水平呈显著负相关,这与Cheng等[10]的研究结果相一致。Cheng等[10]通过体外和体内实验证实,在HBV感染过程中,IL-34对病毒复制具有抑制作用。本研究中CHB患者血清IL-34水平与病毒复制呈负相关,与肝内炎症呈正相关,提示在HBV感染过程中,IL-34表达异常及其引起的免疫功能紊乱参与了CHB的发生和进展。Cheng等[10]的研究发现慢性HBV感染患者血清IL-34 水平较健康人显著降低,与本研究结果存在差异,可能与不同研究中研究对象病程、病情严重程度的差异有关,亦提示IL-34在肝脏慢性炎症中可能发挥不同生物学作用。本研究中CHB患者血清IL-34水平与ALB、TBil、AFP之间均无明显相关性,提示IL-34与肝脏的合成功能和胆红素代谢能力无关。
综上所述,本研究发现慢性HBV感染患者血清IL-34水平较健康人显著升高,且与疾病进程相关。IL-34可能通过打破机体免疫平衡参与了CHB的发生和进展,可能成为治疗慢性HBV感染的免疫学靶点。

