肝细胞癌癌组织和癌旁肝组织Ep-CAM和C-Kit表达及其意义探讨*
陈永其,陈 前,袁春艳,刘 军,谢 蕴
近年来,流行病学调查显示肝细胞癌(hepatocellular carcinoma,HCC)的发生率明显上升,我国2010~2017年HCC平均发病率达到374~583/10 万[1,2]。C-Kit是重要的原癌基因,能够激活上皮细胞膜上的络氨酸受体,提高癌细胞内核转录水平,导致癌细胞DNA扩增和细胞持续增殖[3]。肿瘤干细胞标志上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)是肝脏祖细胞的重要标志物,EpCAM的上调能够通过影响多种肝脏肿瘤细胞的生物学特征,进而促进了HCC患者病情的进展[4]。本研究选择我院收集的手术后HCC组织标本90例,检测了癌组织和癌旁组织EpCAM和C-Kit表达情况,现将结果报道如下。
1 资料与方法
1.1 临床资料 2014年3月~2017年1月我院诊治的手术后HCC组织标本90例,男59例,女31例;年龄 46~69岁,平均年龄为(59.4±10.8)岁。HCC的诊断参考《原发性肝癌诊疗规范(2017年版)》的标准。其中单发病灶55例、多发病灶35例;组织学分级:Ⅰ级15例、Ⅱ级25例、Ⅲ级33例、Ⅳ级 17例;血清 AFP>400 ng/ml者 49例、≤400 ng/ml者41例。纳入标准:手术前患者未接受放疗、化疗或免疫治疗。排除标准:(1)未经病理学检查证实的诊断;(2)转移性肝癌;(3)伴有其他部位恶性肿瘤;(4)合并免疫系统疾病。
1.2 肝组织Ep-CAM蛋白和C-Kit蛋白检测 采用免疫组化法检测,所有组织标本经石蜡包埋后作连续切片,厚度约为4 μm,采用免疫组化链霉卵白素-生物素复合体 (strep avidin-biotin complex,sABC)法染色。抗Ep-CAM蛋白、抗C-Kit蛋白、通用型二抗、SP试剂盒和DAB显色盒均购自北京中杉金桥生物技术开发公司。以阳性片或PBS代替一抗,分别作为阳性或阴性对照,在高倍显微镜下观察Ep-CAM蛋白和C-Kit蛋白的表达情况。免疫组化结果判定:Ep-CAM蛋白和C-Kit蛋白的阳性着色表达于细胞浆或者细胞膜,呈黄色、棕黄色或褐色。
1.3 统计学方法 应用SPSS 16.0版软件,计量资料以(±s)表示,组间比较采用 t检验;计数资料的比较采用x2检验。P<0.05提示差异有统计学意义。
2 结果
2.1 HCC患者肝组织Ep-CAM蛋白和C-Kit蛋白表达情况 见图1、图2。

图1 HCC患者肝组织Ep-CAM蛋白表达情况(ABC,400×)
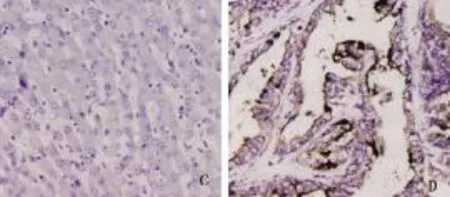
图2 HCC患者肝组织C-Kit蛋白表达情况
2.2 肝组织Ep-CAM蛋白和C-Kit蛋白表达阳性率情况 HCC组织Ep-CAM蛋白和C-Kit蛋白表达阳性率显著高于癌旁组织,差异具有统计学意义(P<0.05,表1)。
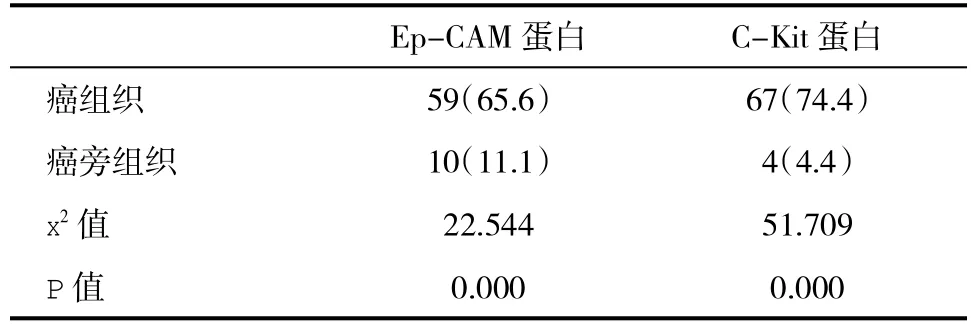
表1 90例HCC患者肝组织Ep-CAM蛋白和C-Kit蛋白阳性率(%)情况
2.3 不同肿瘤特征HCC组织Ep-CAM蛋白和C-Kit蛋白表达阳性率比较 Ⅲ级和Ⅳ级分化、术前 AFP>400 ng/ml、发生血管浸润的癌组织Ep-CAM蛋白和C-Kit蛋白表达阳性率均显著高于Ⅰ级和Ⅱ级、术前AFP≤400 ng/ml、未发生血管浸润的癌组织,差异均具有统计学意义(P<0.05,表2、表3)。
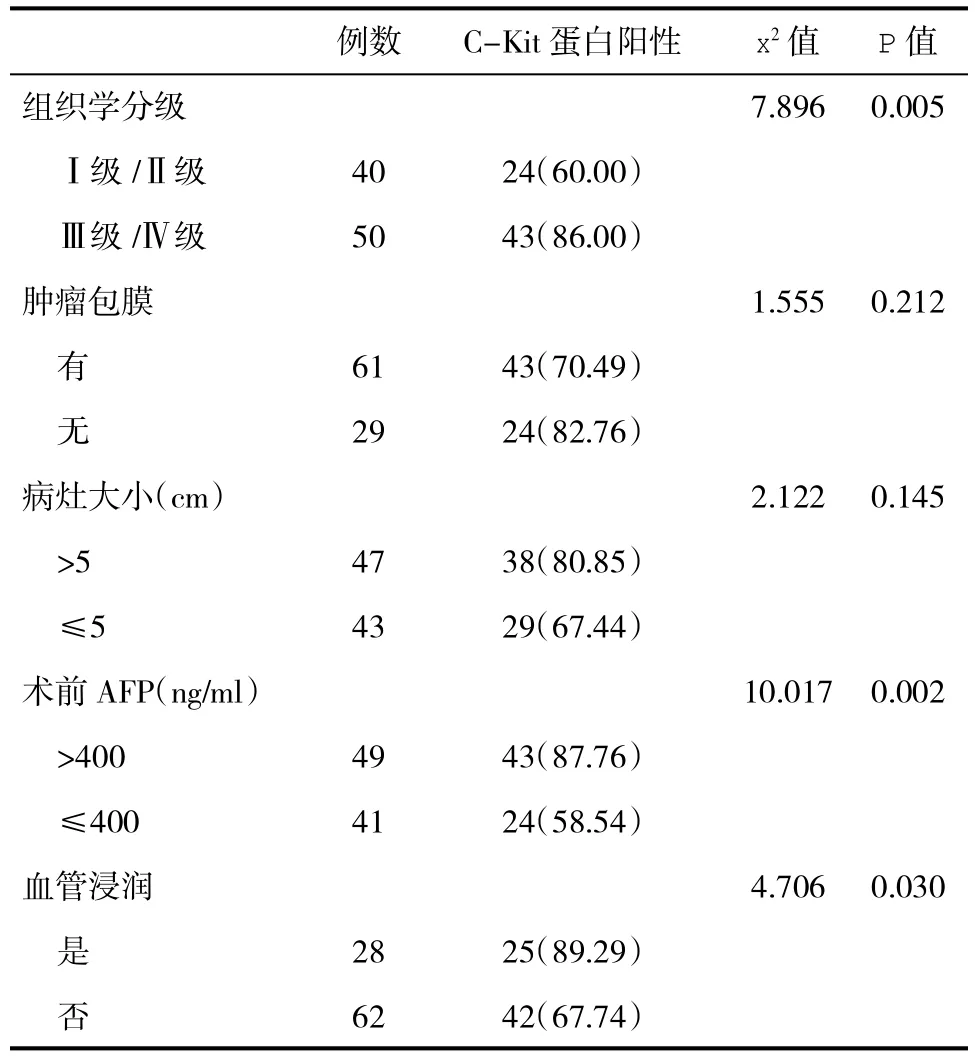
表3 不同肿瘤特征癌组织C-Kit蛋白表达阳性率(%)比较
3 讨论
C-Kit是重要的原癌基因家族成员,其结构上包括了跨膜的免疫球蛋白样的结合区域,以及近跨膜区域和络氨酸激酶区域[5~7]。C-Kit表达增强能够通过激活络氨酸激酶,促进癌细胞内上磷酸腺苷的活化,提高了络氨酸激酶信号通路的激活程度[8~10]。基础方面的研究认为,C-Kit与癌细胞膜表面配体的结合,能够显著提高癌细胞的增殖速度,抑制癌细胞的分化成熟[11]。Ep-CAM是肿瘤干细胞或者祖细胞的分子标志物,其能够通过影响上皮细胞的异型性,提高上皮细胞的持续自我增殖能力,参与到恶性肿瘤的早期发生过程。Ep-CAM的表达还能够激活癌细胞内的MAPK或者NOTCH信号通路,导致上皮细胞周期的紊乱,提高了癌细胞快速跨越静止期的能力[12]。部分研究者报道了C-Kit蛋白在肝癌组织中的表达情况,认为病理学分级程度高的癌组织C-Kit蛋白的表达增强[13],但对于Ep-CAM的分析研究还较少。
通过免疫组化检测结果可见,C-Kit和Ep-CAM在HCC患者癌组织中的表达阳性率均明显上升,显著高于癌旁肝组织,差异较为明显,提示C-Kit和Ep-CAM的高表达均能够影响到HCC的发生过程。通过复习有关研究结果,我们认为C-Kit和Ep-CAM在癌发生过程中可能有如下作用机制[14,15]:(1)C-Kit表达上调能够导致癌细胞内的络氨酸受体的激活,促进其诱导的癌细胞核周边转录基因的激活,导致癌细胞核分裂速度的加快;(2)Ep-CAM表达上调能够导致癌细胞内MAPK信号通路的激活,提高了癌细胞的变形能力,导致癌细胞对于肝脏基底膜组织和肝脏小叶组织的浸润能力增强。有研究者认为,在肝癌组织中,C-Kit蛋白表达阳性率可平均上调35%以上,同时在合并有明显的包膜组织浸润或者门静脉转移的肝细胞癌人群中,C-Kit蛋白的表达阳性率可进一步的上升[16]。免疫组化染色分析发现,C-Kit和Ep-CAM主要表达于肝脏上皮肿瘤细胞的核周边,特别是在细胞异型性较为明显的区域,C-Kit和Ep-CAM的染色强度更深,推测两者均可能影响到了肝脏上皮肿瘤细胞的生物学形态特征。就不同的临床和病理学特征分析发现,在组织学分级较差、术前血清甲胎蛋白水平较高或者发生了血管浸润的肝细胞癌患者,癌组织C-Kit和Ep-CAM表达阳性率均明显上调,提示C-Kit和Ep-CAM的表达与HCC患者临床和病理特征的关系,这主要是由于C-Kit在下列几个方面的作用有关:(1)C-Kit的表达上调能够导致患者肝脏上皮细胞排列极性的紊乱,导致组织学分型的改变,同时还能够提高癌细胞对于血管内皮细胞的粘附能力,提高癌细胞对于肝癌患者血管的浸润程度;(2)C-Kit的表达上调能够提高肝癌上皮细胞的纺锤体分离速度,导致在癌细胞线粒体损伤过程中释放的AFP明显上升,促进了术前AFP水平的上升。而不同临床和病理学特征的HCC患者癌组织Ep-CAM蛋白表达的变化,主要在于由于其能够提高肝癌祖细胞的活性并提高肿瘤细胞的侵袭能力,进而促进了癌细胞对于临近腹腔内病灶组织的浸润,增加了患者的临床分期进展和血管浸润程度[17,18]。但本研究并未发现Ep-CAM蛋白和C-Kit蛋白的表达与肝癌组织包膜浸润的关系,提示Ep-CAM蛋白和C-Kit蛋白的表达并不能提高癌细胞对于肝脏包膜组织的粘附能力,这主要是由于Ep-CAM蛋白和C-Kit蛋白的表达对于癌细胞的迁移能力影响较小,降低了癌细胞对于包膜内皮细胞的粘附过程。国外研究者认为,在肝癌患者,Ep-CAM蛋白的表达上调能够促进癌细胞的包膜转移,考虑可能与Ep-CAM蛋白检测灵敏度的差别或者肝癌患者基础病情差别较大有关[19]。同样,Ep-CAM蛋白和C-Kit蛋白的表达与肝癌患者的肿瘤病灶大小并无关系,不同肿瘤病灶大小癌组织Ep-CAM蛋白和C-Kit蛋白表达无显著相差,说明两种蛋白表达与肝细胞癌发生学、肿瘤分期和是否转移等的关系还不明确。

