对乙酰氨基酚诱导的急性肝损伤小鼠肝组织糖基转移酶Colgalt2表达的变化*
郭乐乐,张晓慧,张向颖,胡中杰,任 锋,张 晶
对乙酰氨基酚(acetaminophen,APAP)和含有APAP的药物是最常用的解热镇痛药,临床上主要用于普通感冒或流行性感冒引起的发热,以缓解轻至中度疼痛[1]。Schegg et al[2]发现Colgalt2为介导胶原Glcαl和2Galβl-糖基化修饰的糖基转移酶,但其在急性肝损伤中的作用尚不清楚。本研究采用APAP制备急性化学性肝损伤动物模型,通过研究Clogalt2基因及其蛋白的表达,以进一步探讨APAP的致病机制。
1 材料与方法
1.1 动物与试剂 健康SPF级雄性C57BL/6小鼠100只,8~12 w龄,由北京军事医学科学院提供,在首都医科大学附属北京佑安医院动物中心饲养1 w,自由进食水。APAP购于美国Sigma公司,将APAP溶于无菌1×PBS中,配置浓度为25 mg/ml,55℃水浴锅加热至完全溶解,现配现用;Trizol裂解液购自美国Invitrogen公司;PrimeScript 1st Strand cDNA Synthesis Kit和SYBR Premix Ex Taq购自日本TAKARA公司;PCR引物购自上海生物化工有限公司;兔抗人GLT25D2多克隆抗体、兔抗人β-actin单克隆抗体和HRP标记的山羊抗兔 IgG均购自Cell Signaling公司;增强化学发光(ECL)试剂盒购自Santa Cruz公司。
1.2 急性肝损伤模型的制备 APAP浓度梯度模型的制备:取C57BL/6小鼠50只,随机分为对照组和100 mg·kg-1、250 mg·kg-1、500 mg·kg-1和 1000 mg·kg-1APAP处理组。所有小鼠均禁食不禁水12 h。在对照组,给予1×PBS腹腔注射,在药物处理组,分别给予不同浓度的APAP腹腔注射,给药后继续禁食不禁水,8 h后急性肝损伤模型建模成功,收集血清和肝组织用于各项检测;APAP时间梯度模型制备:取C57BL/6小鼠50只,随机分为对照组、2 h、4 h、8 h和12 h APAP处理组,分别给予PBS 或者 APAP(25 mg/ml)500 mg·kg-1腹腔注射。给药后继续禁食不禁水,分别于相应时间点收集血清和肝组织,常规检测血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST);肝组织用于提取RNA、蛋白质,常规石蜡包埋,切片,HE染色,光学显微镜下观察肝组织损伤情况。
1.3 肝组织糖基转移酶Colgalt2 mRNA相对水平检测 采用qRT-PCR法,使用 TRIzol试剂提取肝组织总 RNA,测定总RNA浓度并配制等量总RNA溶液。Colgalt2引物:正向引物gcaatgattgaccgtcctcc,反向引物 tccacagcctcgacaatctt。使用 PrimeScript 1st Strand cDNA Synthesis Kit合成 cDNA第一链,行实时荧光定量PCR检测,PCR反应体系为20μl,热启动 95℃ 3 min;变性 95℃ 3 s、退火/延伸60℃延长 30 s,共 40个循环。应用 Biorad manager Systerm Software伯乐分析软件对PCR产物进行半定量分析,以次黄嘌呤磷酸核糖基转移酶(HPRT)作为内参基因。采用实时定量PCR的Ct(cycle threshold)均值来表示,相对定量采用 2-△△Ct来计算[3]。重复实验至少3次。
1.4 肝组织Colgalt2蛋白表达检测 采用Western blot法,取小鼠肝组织约30 mg,立即置于预冷的组织裂解液0.5 ml中,冰浴下充分匀浆,然后于冰上静置 30 min,4℃下12000 g离心5 min,采用Bio-RadDc蛋白分析微孔板法测定上清液蛋白浓度。取肝组织50μg上样,电泳开始为80 v,当蛋白Marker电泳至分离胶后调为 120 v,使蛋白充分分离,将蛋白转移至聚偏氟乙烯膜(300 mA),加入一抗(1:1000稀释)4 ℃孵育过夜,加二抗(1:2000稀释)室温孵育1 h,1×TBST漂洗3次,取等量的增强化学发光试剂A液和B液混匀后,孵育聚偏氟乙烯膜,暗室压片曝光。
1.5 统计学分析 应用SPSS 13.0软件进行数据处理,计量资料以(±s)表示,多组样本均数的两两比较采用One-way ANOVA分析(对方差齐性者用LSD-t检验,对方差不齐者用Games-Howell法),P<0.05表示差异有统计学意义。
2 结果
2.1 各组血清ALT和AST水平比较 见表1。在APAP浓度梯度模型,250 mg·kg-1APAP处理组动物血清ALT和AST水平显著升高(P<0.05);在APAP时间梯度模型,2 h APAP处理组动物血清ALT和AST水平显著升高(P<0.05)。随APAP干预剂量的增加和时间的延长,小鼠肝损伤逐渐加重。
2.2 各组肝组织病理学表现变化 在APAP浓度梯度模型动物,100 mg·kg-1APAP处理组肝小叶轮廓清楚,部分肝细胞轻度水肿,未见明显坏死灶;在250 mg·kg-1、500 mg·kg-1和 1000 mg·kg-1APAP处理组,随着APAP干预剂量的增大,肝小叶结构出现紊乱、肝细胞肿胀变性和坏死、炎症细胞浸润、出现片状坏死和桥接坏死(图1)。在APAP时间梯度模型动物,2 h APAP处理组可见肝小叶轮廓清楚,部分肝细胞轻度水肿及少量炎症细胞浸润;在4 h、8 h和12 h APAP处理组,肝小叶结构出现紊乱、肝细胞肿胀变性及坏死、大量炎症细胞浸润、大片状坏死和桥接坏死(图2)。
表1 各组血清ALT和AST水平(±s)比较

表1 各组血清ALT和AST水平(±s)比较
只 ALT(IU/L) AST(IU/L)对照组 10 28.6±5.3 130.7±24.0 APAP 100 mg·kg-1 10 33.6±4.1 144.6±17.3 250 mg·kg-1 10 1360.5±189.8 2147.1±133.4 500 mg·kg-1 10 3191.2±118.6 3628.8±107.9 1000 mg·kg-110 5022.7±234.6 5854.5±295.1对照组 10 26.7±4.6 107.8±24.0 APAP 2 h 10 80.7±8.0 247.1±23.9 4 h 10 694.1±63.5 857.5±69.2 8 h 10 1321.9±83.5 1658.5±109.5 12 h 10 3151.1±162.7 3395.2±620.6

图1 APAP浓度梯度模型动物肝组织病理学表现(HE,200×)

图2 APAP时间梯度模型动物肝组织病理学表现(HE,200×)
2.3 各组肝组织Colgalt2基因及其蛋白表达情况 见图3、图4。在 100 mg·kg-1和 250 mg·kg-1APAP 处理组肝组织Colgalt2基因水平显著低于对照组(P<0.05),而在 500 mg·kg-1和 1000 mg·kg-1APAP处理组,其水平显著升高(P<0.05);2 h、4 h、8 h 和12 h APAP处理组与对照组比,肝组织Colgalt2基因水平逐渐升高(P<0.05)。在浓度梯度模型,100 mg·kg-1APAP处理组肝组织 Colgalt2蛋白表达稍强于对照组,250 mg·kg-1、500 mg·kg-1和 1000 mg·kg-1APAP处理组Colgalt2蛋白表达呈现明显增强趋势;在时间梯度模型,随APAP干预时间的延长,肝组织Colgalt2蛋白表达呈逐渐增强趋势。
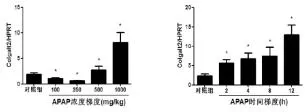
图3 两种模型动物肝组织Colgalt2基因水平变化
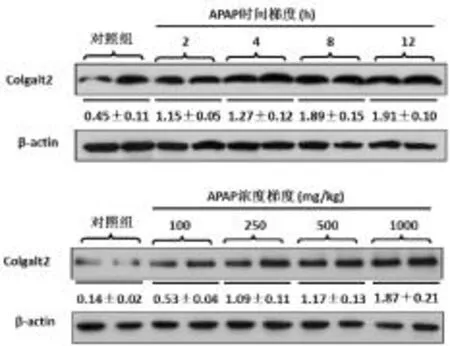
图4 两种模型动物肝组织Colgalt2蛋白表达变化
3 讨论
APAP和含有APAP的药物是最常用的解热镇痛药[3,4]。研究发现,APAP是引起急性肝衰竭最主要的原因[5,6]。APAP和含有APAP的药物过量或者不恰当服用,会导致严重的肝损伤,成人服用APAP最大日剂量不超过4 g[7],过量摄入将导致严重的肝损伤,甚至肝衰竭[8,9]。APAP毒性呈剂量依赖性,在特殊情况下如禁食时,细胞色素P450诱导的药物和酒精作用也会加重APAP引起的肝损伤[10],可能原因是N-乙酰对苯醌亚胺(NAPQI)生成过多和谷胱甘肽(GSH)降低,NAPQI通过芳基化或使GSH等酶蛋白过氧化失活,生成自由基,对细胞产生损伤[11],并且多余的NAPQI与胞内蛋白质结合形成复合物是线粒体氧化应激的最重要原因,同时也是肝细胞死亡最重要的起始事件[12]。
血清ALT和AST水平在一定程度上可以反映肝细胞损伤的程度[13]。本研究采用APAP诱导小鼠肝损伤模型,结果显示,动物血清ALT和AST水平随着干预时间和干预剂量的逐渐延长和增加而升高,肝组织学发生病理性改变,表明APAP可导致肝损伤,提示急性肝损伤模型制备成功。
蛋白质糖基化是真核细胞内分泌蛋白、膜锚定蛋白、糖脂及蛋白聚糖的常见的翻译后修饰过程,是指在肽链合成的同时或合成后,在酶的催化下糖链被接到肽链上的特定糖基化位点[14]。研究表明,蛋白质的糖基化修饰在肝病的不同发病阶段均发挥重要的作用[15]。蛋白质糖基化主要有N-糖基化、O-糖基化、C-糖基化和GPI锚定连接四类[16,17]。O-连接的糖基化修饰是蛋白质最丰富的翻译后修饰[18,O-糖基化主要包括粘蛋白型O-聚糖,即O-连接的-N-乙酰半乳糖胺[19]、O-连接的-N-乙酰葡萄糖胺[20]和修饰胶原蛋白的O-糖基化修饰[21]。Colgalt2编码的跨膜蛋白胶原β(1-O)半乳糖基转移酶介导胶原分子上的羟基赖氨酸Glcαl和2Galβl-糖基化修饰[2]。为明确小鼠肝组织 Colgalt2与小鼠急性药物性肝损伤之间的关系,本研究对APAP时间-效应和剂量-效应进行了研究,结果发现随着APAP干预时间逐渐延长,肝脏损伤逐渐加重,Colgalt2基因及其蛋白水平上调。与对照相比,小剂量APAP组肝脏损伤不明显,Colgalt2基因表达下调,Colgalt2蛋白水平略有升高,而在大剂量APAP组肝脏损伤非常明显,Colgalt2基因及其蛋白水平显著上调。

