剪切波弹性成像对食管静脉曲张的诊断价值
赵 玮,于 宁,种 静
(青岛大学附属医院超声科,山东 青岛 266003)
食管静脉曲张(esophageal varices, EV)破裂是肝硬化上消化道出血的最常见原因。肝硬化患者中,EV发病率达50%,EV破裂出血的死亡率为20%~35%,患者可因救治不及时而导致失血性休克乃至死亡[1-2]。早期发现、早期干预可减少EV破裂出血风险,降低死亡率。内镜是检查EV的金标准,但由于价格及其操作过程中可引起患者不适等,不能达到随诊要求。剪切波弹性成像(shear wave elastography, SWE)作为一种无创超声检查技术,具有安全、方便、准确等优点。既往研究[3-4]多以瞬时弹性成像(transient elastography, TE)、声脉冲辐射弹性成像(acoustic radiation force impulse imaging, ARFI)预测EV破裂。本研究探讨SWE对EV分级和破裂出血的预测价值。
1 资料与方法
1.1 一般资料 选取2017年2月—2018年2月我院临床确诊的肝硬化患者103例,男84例,女19例,中位年龄52.0岁。纳入标准:①采用SWE技术成功测量肝硬度(liver stiffness, LS)、脾硬度(spleen stiffness, SS)及其他参数;②接受实验室及内镜检查。排除标准:①肝、脾肿瘤及其他肿瘤;②门静脉血栓;③乙型病毒性肝炎外的其他类型肝硬化;④手术治疗门静脉高压史(包括脾栓塞术、经皮肝门体分流术及脾切除术等)。
1.2 仪器与方法
1.2.1 SWE检查 采用Supersonic imagine Aixplorer超声诊断仪,SC6-1凸阵探头,频率3.5 MHz,嘱患者仰卧,在B型超声的基础上行SWE检查,测量深度为肝包膜下1 cm,避开脉管系统。测量肝脏时,嘱患者上抬右上肢,以充分暴露肋间隙;将探头置于右侧第7~9肋间,由B型超声切换为SWE模式,嘱患者屏气,测量LS,重复5次,取其均值。测量脾脏时嘱患者上抬左上肢,将探头置于左侧第9~11肋间,测量脾长径,切换为SWE模式测量SS,重复5次,取均值。
1.2.2 实验室及胃镜检查 超声检查后进行实验室相关检查。由临床医师进行Child-Pugh分级,计算LS×脾长径与血小板计数的比值指数(LSPS)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST)与血小板计数的比值指数(aspartate aminotransferase and platelet count ratio index, APRI):LSPS=LS×脾长径/血小板计数,APRI=(AST/AST正常上限值×100)/血小板计数,AST正常上限值=40 U/L。由1名临床医师于完成超声及实验室相关检查后1周内行内镜检查。
采用文献[5]标准诊断EV,并将EV分为F1~F3,红色征是EV破裂出血的高危因素。低危EV定义为F1无红色征、无Child-Pugh C;高危EV定义为F2~F3、F1伴红色征或伴Child-Pugh C。
1.3 统计学分析 采用SPSS 21.0及MedCalc 15、Graphpad Prism 6统计分析软件,以中位数(上下四分位数)表示非正态分布计量资料。采用χ2检验比较有无EV、低危与高危EV、有无EV破裂出血患者间性别和Child-Pugh分级,对年龄、体质量指数(body mass index, BMI)、LSPS、APRI、LS、SS采用Mann-WhitneyU检验。将差异有统计学意义的参数纳入多因素Logistic回归方程。采用Spearman相关分析观察有无EV与Child-Pugh分级、LSPS、APRI、LS和SS的相关性(∣r∣≤0.40为相关性弱,0.40<∣r∣≤0.60为相关性中等,0.60<∣r∣≤0.80为相关性强,0.80<∣r∣≤1.0为相关性很强)。绘制SS诊断有无EV、低危与高危EV、有无EV破裂出血的ROC曲线,计算AUC、特异度、敏感度、约登指数、阳性似然比(positive likelihood ratio, +LR)和阴性似然比(negative likelihood ratio, -LR)。P<0.05为差异有统计学意义。
2 结果
103例患者中,28例无EV,75例有EV(43例低危EV、32例高危EV;58例无EV破裂出血,17例有EV破裂出血)。
有无EV患者的性别、年龄、BMI差异均无统计学意义(P均>0.05),Child-Pugh分级、LSPS、APRI、LS、SS差异均有统计学意义(P均<0.05),见表1和图1、2。LS(诊断比值比为1.98)、SS(诊断比值比为2.57)为预测EV的独立影响因素。
低危与高危EV患者Child-Pugh分级、LS、SS差异有统计学意义(P均<0.05),LSPS、APRI差异均无统计学意义(P均>0.05),见表2。有无EV破裂出血患者的SS差异有统计学意义(P<0.01),见表3;SS为预测低危与高危EV及有无EV破裂出血的独立影响因素(诊断比值比分别为2.16、2.37)。
ROC曲线分析结果显示的LSPS、APRI、LS、SS诊断EV的阈值及效能见表4和图3A。LS、SS诊断低危和高危EV的阈值及效能见表5和图3B。SS诊断有无EV破裂出血的AUC为0.93(P<0.01),阈值为39.30 kPa,特异度98.43%、敏感度76.74%,约登指数0.77,+LR 3.05,-LR 0.23。
Spearman相关性分析结果显示,有无EV与Child-Pugh分级相关性较弱(r=0.35,P<0.05),与LSPS、APRI、LS相关性中等(r=0.52、0.45、0.51,P均<0.05),与SS相关性强(r=0.61,P<0.05)。
3 讨论
超声弹性成像技术可客观、定量分析LS,目前应用较多的主要有TE、ARFI、SWE等技术。TE是较早用于临床的弹性成像技术[6],不仅用于肝纤维化分级的研究,还可用于预测EV及门静脉高压等[7-8]。但TE存在诸多局限性:肥胖、严重腹腔积液、肋间隙过窄常导致测量失败,且无二维成像功能。SWE较多用于判断肝纤维化分级[7,9]。本研究评价SWE及其他参数诊断EV严重程度及破裂出血的效能。
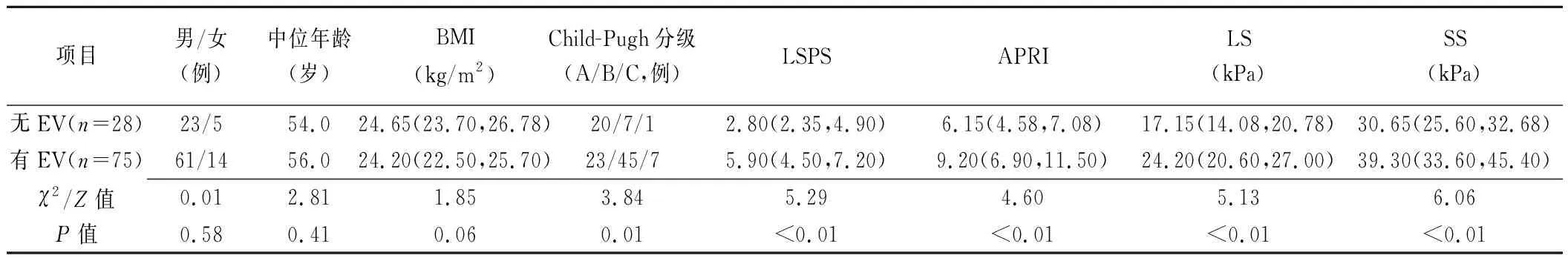
表1 有无EV患者各参数比较
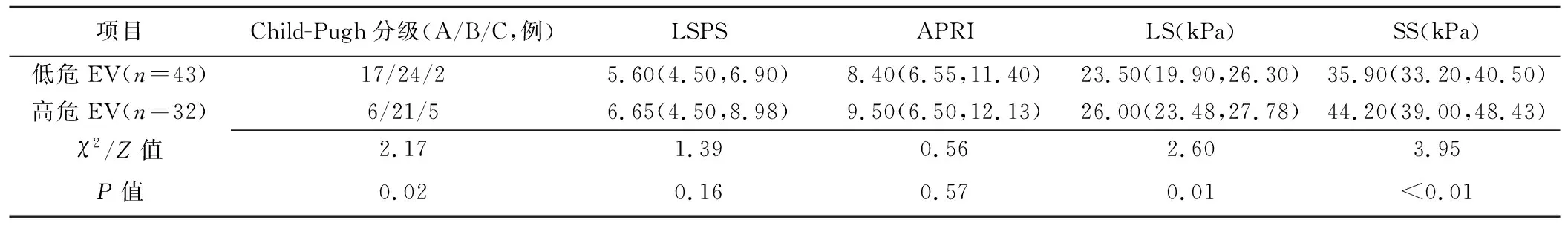
表2 低危与高危EV患者Child-Pugh分级、LSPS、APRI、LS、SS比较
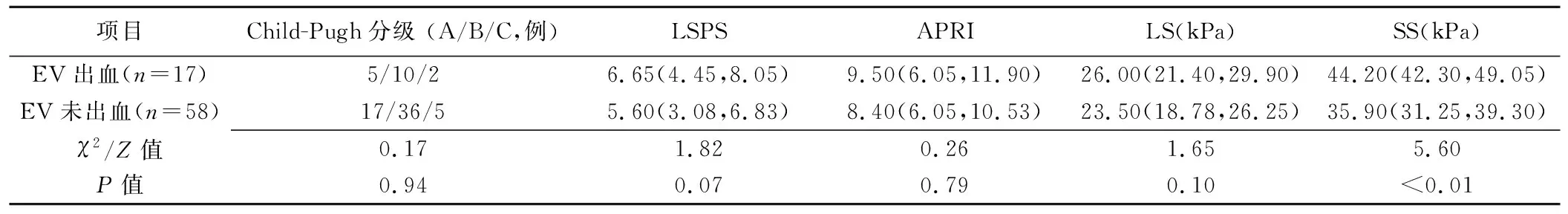
表3 有无EV出血患者Child-Pugh分级、LSPS、APRI、LS、SS比较

表4 LSPS、APRI、LS、SS诊断EV的效能

表5 LS、SS诊断低危与高危EV的效能
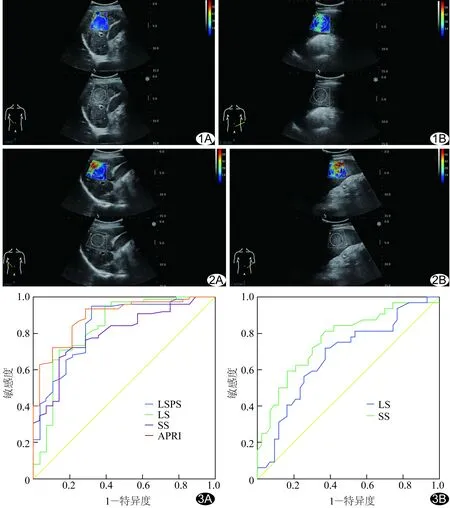
图1 肝硬化患者,男,56岁,无EV,SWE测量图 A.LS; B.SS 图2 肝硬化患者,男,47岁,有EV,SWE测量图 A.LS; B.SS 图3 ROC曲线 A.LSPS、APRI、LS、SS诊断EV; B.LS、SS诊断高危EV
门静脉高压是导致EV及破裂出血的主要危险因素。Egawa等[13]指出肝静脉压力梯度(hepatic venous pressure gradient, HVPG)>10 mmHg是EV破裂出血的重要危险因子,但测量HVPG为有创检查。本研究发现SS可预测EV破裂出血,且诊断效能较高(AUC=0.93),将39.30 kPa作为预测EV破裂出血的阈值,其特异度为98.43%,敏感度为76.74%。
本研究结果发现SWE对于EV分级及破裂出血的诊断效能较高,随着EV程度增加,LS、SS均增加,但SS诊断效能优于LS,考虑其原因在于LS的测量值不仅受肝脏炎症、淤血、胆汁淤积等影响,还受谷丙转氨酶及胆红素的影响。
本研究的不足:样本量有限,有关LS、SS对EV的诊断价值尚需进一步扩大样本量加以验证;为单中心、回顾性研究,所获结果尚需进行多中心研究证实。

