DNA疫苗对APP/PS1转基因鼠免疫反应类型及脑内炎症反应的影响
陈 新,吴慧颖,邢晓娜
(1.辽宁省人民医院;2.吉林大学第二医院;3.中国医科大学人民医院,辽宁 沈阳110015)
阿尔茨海默病(Alzheimer’s disease,AD)的病因及发病机制迄今尚不明确,已有证据表明β淀粉样蛋白(amyloid β-protein,Aβ)在AD的发病中起着至关重要的起始及枢纽作用[1],是各种原因诱发AD的共同通路。Aβ是老年斑的主要组成成分,Aβ聚集在导致老年斑形成、突触减少、神经功能失调、神经元死亡以及有临床症状的痴呆方面起关键作用[2]。本研究构建了DNA疫苗p(Aβ3-10)10-mIL-4,编码重复10次的Aβ3-10并且融入小鼠白细胞介素4(interleukin-4,IL-4)作为基因佐剂,探讨其免疫AD转基因鼠(APP/PS1)免疫反应类型、脑内老年斑及炎症反应的影响。
1 材料与方法
1.1实验动物与试剂8月龄APP/PS1转基因小鼠15只,购自中国医科大学实验动物部。质粒大量提取试剂盒(OMEGA);抗Aβ抗体6E10(Signet);Aβ42肽(AnaSpec);即用型SABC免疫组化试剂盒(武汉博士德);ECM830电穿孔仪(美国BTX)。
1.2p(Aβ3-10)10-mIL-4合成及提取[3]人工合成重复10次的Aβ3-10的基因片段,装载到puc57载体。双酶切(Aβ3-10)10基因片段和模板质粒pcDNA3.1(+)-mIL4。将(Aβ3-10)10基因片段克隆入pcDNA3.1(+)-mIL4质粒,合成重组质粒p(Aβ3-10)10-mIL-4。测序正确后用质粒大量提取试剂盒进行大量提取。
1.3动物免疫15只8月龄雌性APP/PS1转基因鼠随机分成3组,每组5只。p(Aβ3-10)10-mIL-4组(观察组):每只鼠免疫p(Aβ3-10)10-mIL-4,100 μg/次。pcDNA3.1(+)组(阴性对照组):每只鼠免疫pcDNA3.1(+),100 μg/次。两组小鼠注射质粒前腹腔注射10%水合氯醛,麻醉后在左后肢股四头肌肌肉注射质粒100 μg,之后用ECM830电穿孔仪进行电穿孔[4];Aβ42组(阳性对照组):每只鼠免疫Aβ42肽50 μg/次,左后肢股四头肌肌肉注射。第1次免疫后每2周免疫一次,第3次免疫后每1个月免疫一次,共免疫9次。
1.4脾细胞培养上清的细胞因子检测
1.4.1脾细胞培养 最后一次免疫2周后,每组选取2只小鼠。断颈处死小鼠,将小鼠脾脏置于100 μm孔径的尼龙网筛上,用镊子将脾捣碎并用注射器内柱轻轻研磨组织块。将所得溶液离心。将所得沉淀重悬于5 ml红细胞裂解液(ACK溶液)中,再次离心。将沉淀重悬于5 ml PBS中,离心。将悬液加入96孔培养板中每份悬液加8个孔,每孔加100 μl细胞悬液。分别在每一份悬液8个孔中的前2孔加入RPMI 1640培养液,100μl/孔;接着2个孔加入重组质粒p(Aβ3-10)10-mIL-4真核表达蛋白产物[4],100 μl/孔(10 μg/ml);接着2个孔加入Aβ42,100μl/孔(10μg/ml);最后2个孔加入ConA(伴刀豆凝集素A),100 μl/孔(2 μg/100 μl)。于37℃、5%CO2、90%湿度培养箱内连续培养72 h。将刺激物各孔上清小心吸出,-70℃冻存。
1.4.2细胞因子检测 ELISA试剂盒检测细胞因子IL-4及γ干扰素(IFN-γ)。步骤按试剂盒说明书进行。(1)IL-4测定:将标准品依次稀释为240 pg/ml,120 pg/ml,60 pg/ml,30 pg/ml,15 pg/ml。在酶标包被板上加样。封板后置37℃温育30 min。洗涤5次。每孔加入酶标试剂50 μl,空白孔除外。封板后置37℃温育30 min。洗涤5次。每孔先后加入显色剂A、B各 50 μl, 37℃避光显色15 min。终止反应。450 nm波长测量各孔的吸光度(OD值)。
(2)IFN-γ测定:标准品的稀释:将标准品依次稀释为800 pg/ml,400 pg/ml,200 pg/ml,100 pg/ml,50 pg/ml。其余步骤同IL-4测定步骤。
1.5免疫荧光检测老年斑及小胶质细胞APP/PSl转基因小鼠脑组织石蜡切片二甲苯脱蜡,梯度酒精脱二甲苯,PBS冲洗,微波煮沸抗原修复,自然冷却,PBS冲洗。经正常驴血清(normal donkey serum,NDS)(1∶20)室温预孵育1 h后,小鼠抗Aβ抗体6E10 (1∶1000)和兔Iba1抗体(1∶500)混合液室温孵育过夜,漂洗,FITC和TexasRed标记的荧光二抗混合液室温2 h孵育,漂洗,荧光封片剂封片,共聚焦激光扫描显微镜下观察并采集图像和分析。
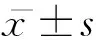
2 结果
2.1重组质粒p(Aβ3-10)10-mIL-4的构建目的基因(Aβ3-10)10片段成功合成并克隆入pcDNA3.1(+)-mIL-4质粒中。经酶切及测序证实质粒构建正确。
2.2ELISA方法检测脾细胞培养上清中的细胞因子水平在相应抗原刺激后的脾细胞培养上清中,Aβ42组(108.19±11.24 pg/ml)及p(Aβ3-10)10-mIL-4组(102.73±14.83 pg/ml)的IL-4的含量均明显高于pcDNA3.1(+)组(28.67±5.14 pg/ml)(P<0.01),但是两组比较无显著差异(P>0.05,图1A)。Aβ42组的IFN-γ的含量(263.34±29.3 pg/ml)明显高于p(Aβ3-10)10-mIL-4组(96.8±8.35 pg/ml)(P<0.01)及pcDNA3.1(+)组(80.66±12.45 pg/ml)(P<0.01)。而p(Aβ3-10)10-mIL-4组和pcDNA3.1(+)组的IFN-γ含量没有显著差别(P>0.05,图1B)。
2.3DNA疫苗p(Aβ3-10)10-mIL-4免疫对APP/PS1转基因鼠脑内老年斑及小胶质细胞的影响免疫荧光结果显示,pcDNA3.1(+)组APP/PS1转基因鼠脑内可见很多Iba1阳性细胞,尤其围绕在老年斑周围。Aβ42组及p(Aβ3-10)10-mIL-4组脑组织中的Iba1阳性细胞及老年斑与pcDNA3.1(+)组相比明显减少(图2)。

注:图1 A:脾细胞培养上清中细胞因子IL-4含量。**与pcDNA3.1(+)组经相应抗原(1640)刺激后IL-4含量比较,P<0.01,#Aβ42组及p(Aβ3-10)10-mIL-4组经相应抗原刺激后的IL-4含量比较,P>0.05。B:脾细胞培养上清中细胞因子IFN-γ含量。**与p(Aβ3-10)10-mIL-4组经相应抗原刺激后IFN-γ含量比较P<0.01,#与pcDNA3.1(+)组相应抗原刺激后IFN-γ含量比较,P>0.05。
图1脾细胞培养上清中细胞因子IL-4与IFN-γ含量
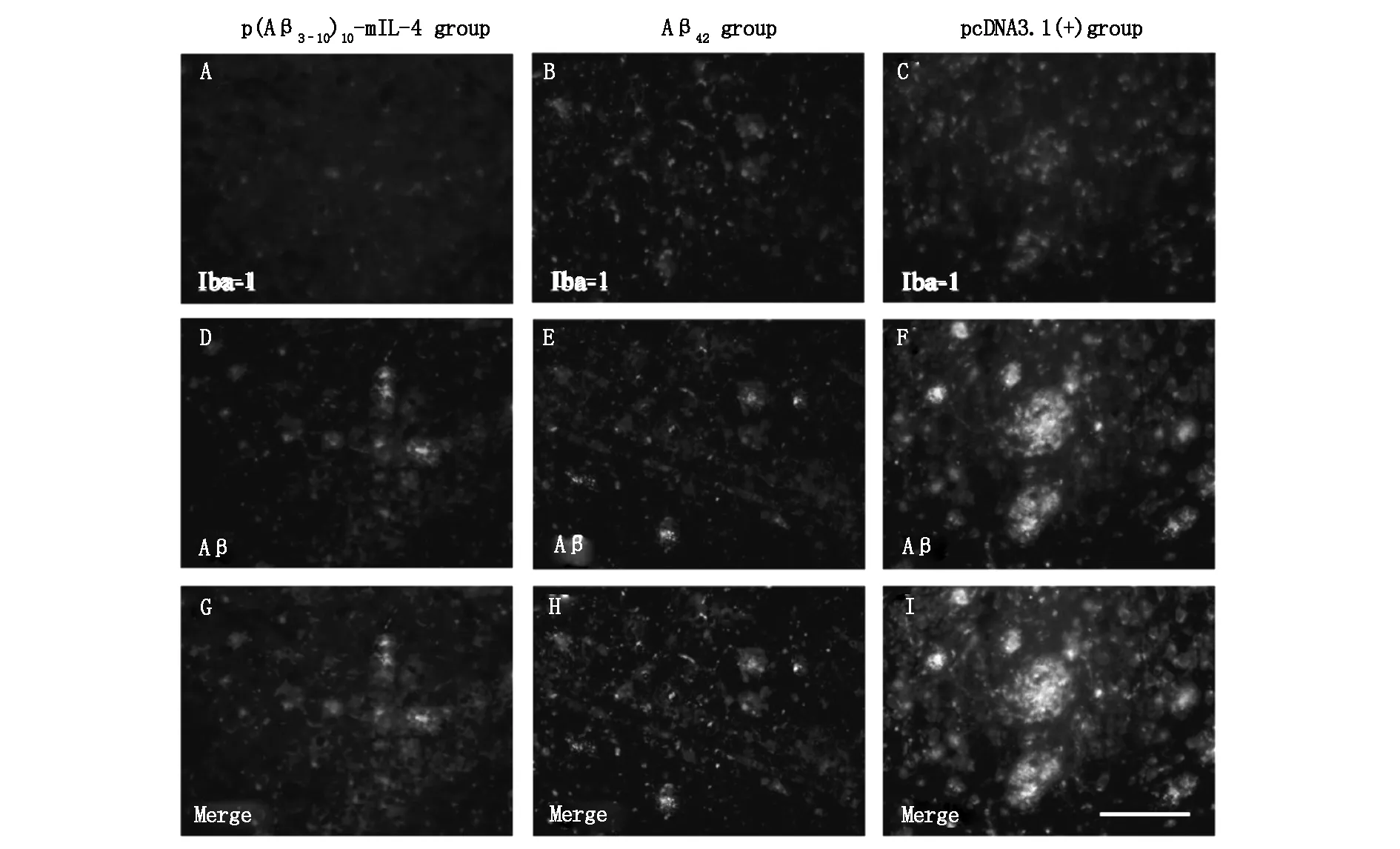
注:3组小胶质细胞免疫荧光结果(A,B,C);3组老年斑免疫荧光结果(D,E,F);3组小胶质细胞和老年斑双表达免疫荧光结果(G,H,I)。标尺=50 μm。
图2脑组织FITC和TexasRed荧光双标记小胶质细胞和老年斑结果
3 讨论
针对如何阻断和延迟AD早期Aβ的积聚以及如何消除已形成的Aβ斑块沉积已经成为近年来AD治疗的一个重要研究方向[2]。研究表明,用Aβ42肽免疫AD模型鼠时能够产生高滴度的抗Aβ抗体,减少鼠脑内Aβ的沉积,并能使鼠的学习和记忆功能得到改善[5,6]。Aβ42肽疫苗(AN1792)在Ⅱ期临床试验时,因为6%的病人出现了无菌性脑膜脑炎而被迫停止[7]。随后的研究认为无菌性脑膜脑炎由T细胞介导的自身免疫反应(Th1型免疫反应)引起[8]。为了建立一种能产生Th2型免疫反应的安全AD免疫,研究者进行了一些实验性免疫策略的探索。本研究选择Aβ3-10做为目的基因片段,已有研究证实Aβ1-15是诱导B细胞体液免疫的主要表位[9],选择该片段将避免产生T细胞介导的炎症反应。本研究选择了Th2型细胞因子IL-4作为佐剂[10],同时选择体内电穿孔作为基因递送途径[11],以增强p(Aβ3-10)10-mIL-4的免疫反应。
研究认为主要诱导Th2型免疫反应的免疫方式对于AD的预防和治疗是安全的。Th2型免疫反应通过产生IL-4、IL-5等细胞因子增强体液免疫反应;而Th1型免疫反应主要产生IFN-γ、IL-2等细胞因子诱导细胞介导的炎症反应[12]。本研究中,Aβ42疫苗免疫后,脾细胞体外培养,经自身抗原刺激,分泌的细胞因子IFN-γ和IL-4均较高。p(Aβ3-10)10-mIL-4疫苗免疫后,培养液中IL-4较高,而IFN-γ低。说明Aβ42疫苗引起的免疫反应既有Th1免疫反应,也有Th2 免疫反应,p(Aβ3-10)10-mIL-4疫苗免疫后产生的免疫反应类型为Th2型,这样就降低了发生炎症反应副作用的可能性。
阿尔茨海默病的神经炎症过程是脑内小胶质细胞所参与和介导的一种免疫反应。对AD的病理研究发现活化的小胶质细胞主要围绕在淀粉样斑块的周围[13],Aβ与胶质细胞受体结合而使其激活并表达细胞因子,活化的小胶质细胞一方面作为脑内的巨噬细胞可以吞噬沉积的Aβ,减少老年斑的形成;另一方面小胶质细胞激活后产生的大量炎性因子,如IL-6等,可以诱发脑内炎症反应,或直接损伤神经元[14]。本研究显示,Aβ42组及p(Aβ3-10)10-mIL-4组免疫后,鼠脑内皮层及海马的小胶质细胞较pcDNA3.1(+)组明显减少,与老年斑的减少相一致。说明疫苗免疫后转基因鼠脑内的胶质细胞活化减少,炎症反应情况得到了改善,从而可以改善神经炎性营养失调,避免神经元的损伤及死亡。
总之,DNA疫苗p(Aβ3-10)10-mIL-4免疫APP/PS1转基因鼠后能够产生Th2 免疫反应,减轻小鼠脑内Aβ沉积,同时可以改善鼠脑内的炎症反应。我们将在后续研究进一步探讨p(Aβ3-10)10-mIL-4疫苗的免疫效果及安全性,希望该疫苗能作为AD治疗的理想疫苗。

