基于超声图像的肝脏L1-RADS 分类标准规范化应用及关键技术的研究
贾 梅,张 梅,杨 兵,宫 兵*
(1.吉林市中心医院,吉林 吉林132011;2.吉林市中西医结合医院)
肝细胞癌(HCC)是最常见的原发性肝恶性肿瘤,无创成像特异性诊断对其治疗和预后评估是必不可少。2011年美国放射学会(ACR)发布的肝脏影像报告和数据系统(LI-RADS)是目前较多国医疗机构临床工作中使用的标准化的影像数据采集和诊断方法,但多在CT和 MRI检查中使用,超声检查中应用较少[1]。而超声造影(CEUS)是原发性肝癌诊断三大常规影像检查之一,在肝癌的早期诊断、分级以及治疗和预后中占有重要地位,但目前尚缺乏统一的诊断规范[2]。因此本研究构建了基于超声图像的肝脏LI-RADS分类的院内统一的、可重复的肝脏超声影像报告标准化模板,以提高对HCC的诊断效能,现将结果报告如下。
1 资料与方法
1.1一般资料从2014年11月至2017年8月期间在本院行腹部CEUS检查的患者中筛选出198例符合标准的患者,男127例,女71例,,年龄23-88岁,平均55.68岁,所有病例最终术后病理、穿刺活检或随访(随访时间≥6个月)证实(HCC诊断标准以2011年中国卫生部发布的《原发性肝癌诊断规范》为准,包括病理学和临床诊断标准)[3]。
1.2纳入标准与排除标准
1.2.1入组标准 具有HCC高危因素(肝硬化、慢性病毒性乙型和丙型肝炎、酒精性肝炎、自身免疫性肝炎、血色病、非酒精性脂肪肝和遗传性代谢病等);首次入院就诊;肝脏单发病灶;病灶长径>1 cm。
1.2.2排除标准 入院前肝脏病变已经过治疗或穿刺者;对超声造影剂过敏者。
1.3方法建立基于超声图像的肝脏LI-RADS 分类标准的工作流程,确定是否为适用对象,各种原因所致肝硬化,其他HCC高风险的人群确定是否为适用检查手段及是否符合技术要求,超声造影是否有异常发现。
1.3.1超声造影检查方法 将超声造影剂冻干粉用5 ml生理盐水溶解制备成混悬液。用20G的套管针经肘静脉团注2.4 ml的混悬液,随即注入5 ml生理盐水冲洗。使用仪器为Philips IU22。扫查前12 h清淡饮食,当天需空腹。操作方法:首先常规超声行全肝扫查,若发现可疑病灶,观察其大小、回声等,并用彩色多普勒超声全面评价病灶;随后进入超声造影软件中,选择最佳观察面,将聚焦点调节到最低,注射造影剂同时开始计时并持续观察,扫查切面中的微气泡消失时停止,储存图像。CEUS的时相参照 《肝超声造影应用指南(中国)》(2012年版),动脉期为注射造影剂后0-30 s,连续动态记录,门脉期为31-120 s,注射1 min后改为间歇观察,CEUS持续到注射后延迟期为121s-6 min,以观察晚期消退的病变。廓清开始时间:早廓清为开始注射后60 s以内,晚廓清为开始注射60 s及以后。
1.3.2图像评价方法 由两位经验丰富的超声科医师独立评价所有超声图像,意见不一致时由上级医师判定。按照本研究制定的CEUS LI-RADS分类标准评估、分类肝脏病灶超声造影表现。参照2011年中国卫生部发布的《原发性肝癌诊断规范》进行诊断(包括病理学和临床诊断标准)。
1.3.3建立LI-RADSv2014的分类[4]CEUS LR-1:明确良性,影像学检查明确良性/随访中消失的病灶;CEUS LR-2:可能良性,影像学检查提示良性,但不能明确诊断良性;CEUS LR-3:HCC与良性病变可能性相当,清楚的实性结节,不符合LR其它诊断标准;CEUS LR-4:清楚的实性结节,影像学检查提示HCC,但不能明确诊断HCC;CEUS LR-5:明确的肝细胞癌,清楚的实性结节,影像学检查明确HCCC;EUS LR-5V:静脉内有明显的癌栓。
1.3.4建立LI-RADS v2014的判断流程 本研究将CEUS的特征与LI-RADS的LI-RADS 3-5类病变的典型征象相对应, LR-3、LR-4及LR-5分类的主要征象,动脉期强化特征、直径、廓清表现、包膜表现、超阈值生长。判断流程如下:①发现异常:超声造影是否有异常发现。②判断是否为治疗后病灶:是:LR-Treated;否:进入下一步。治疗后病灶(LR-treated):经历了局部消融治疗的异常发现,无论其疗效,应被定为LR-treated:LR-treated并不反映治疗效果(残余、复发或完全坏死)。③判断是否良性病变:肯定良性(Definitely benign):LR-1,良性可能大(Probably benign):LR-2, 非LR-1或LR-2:进入下一步。判断是否为良性病灶(LR-1,LR-2):良性病灶异常发现为非肿瘤性病变,除了感染外不会转移到其它部位,也不会侵袭或破坏邻近组织。在肝硬化或HCC高风险病人常见的良性病变包括:囊肿、血管瘤、血管异常、灌注异常、肝脂肪沉积或肝岛、肥大性假肿块、融合性纤维化、局灶性瘢痕、未列入FNH、肝腺瘤、无肝硬化的再生结节(布加)等。LR-1:明确良性,基于影像表现有100%信心诊断为良性病灶,无治疗情况下随访自行消失;LR-2:可能良性,基于影像表现考虑为良性病灶,但没有100%的信心,LR2肝硬化相关结节,根据经验。④判断是否为HCC以外的其他恶性肿瘤,可能恶性但不符合HCC:LR-M;否:进入下一步。⑤判断有无明确的静脉内肿瘤 :有:LR-5V;无:进入下一步。⑥根据主要征象进行分类:LR-3、LR-4、LR-5不能明确分类,进入下一步。⑦根据辅助征象调整分类:上调1级或更多,但不能到LR-5。下调1级或更多,可以到LR-1仍不能确定分类,进入下一步。辅助征象应用总则:单独应用这些征象不能对异常发现做出可靠分类,倾向于恶性的辅助征象可使异常发现的分类上调1级或多级,但≤LR-4倾向于良性的辅助征象可使异常发现的分类下调1级或多级,直至LR-1。⑧根据破局原则最后确定分类。
1.4统计分析
使用SPSS20.0软件进行统计分析,LI-RADS(1+2)为良性,LI-RADS(4+5)为恶性,以病理诊断或随访结果为金标准,计算灵敏度(SEN)、特异度(SPE)。以P<0.05为差异有统计学意义。
2 结果
在198例患者中,病理检查或随访结果198例患者中,良性120例,HCC 62例,其他肿瘤16例,超声造影LI-RADS分级结果与病理或随访结果对应关系如表1,LR3级有9例的最终诊断为HCC,LR4级有2例的最终诊断为HCC,LR4和LR5中8例的最终诊断为良性。CEUS LI-RADS分级的灵敏度(SEN)为85.48%,特异度为(SPE)为90.41%。
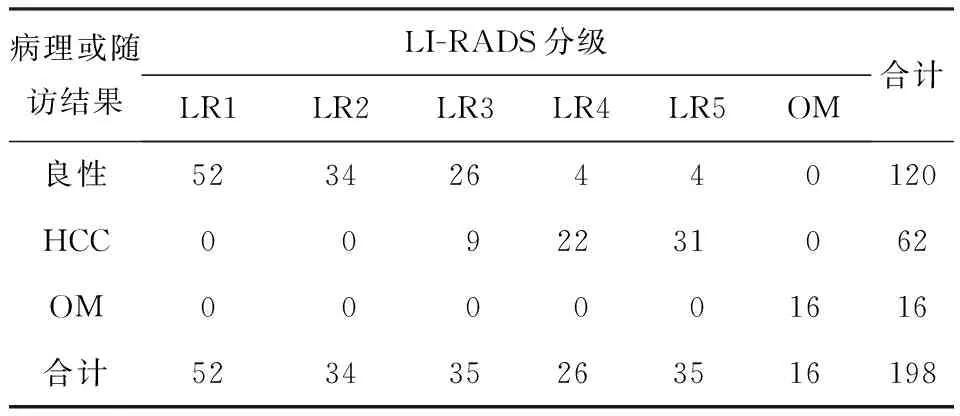
表1 超声LI-RADS分级结果与病理或随访结果对照
3 讨论
肝细胞肝癌(HCC)虽然是临床常见肝脏肿瘤,由于影像医师之间、医疗中心之间对疾病及征象的描述常常有所差别,没有统一的标准。对影像资料的分析差异化常常造成影像医师间、影像医师与临床医生间的沟通障碍,甚至分歧巨大,不利于病人的治疗。因此一个标准化、结构化的影像报告对于临床医师间交流与多科室合作尤为重要[5]。美国放射学会发布的肝脏影像报告和数据管理系统,使肝脏影像征象描述统一,推行标准化的诊断报告,便于影像科与临床科室的交流[6]。LI-RADS 是首个包涵HCC风险病人全谱病变的系统,对原发性肝癌高危人群的HCC诊断非常适合[7]。它根据HCC相对可能性概率,制定了详细的诊断规则流程图,据此将肝脏病变的影像特性分类,有利于临床医师根据LI-RADS分类以及其它临床情况来决定进一步的处理方法[8]。
2005年6月巴塞罗那全球肝癌专题会议将超声造影列为原发性肝癌诊断处理的三大常规影像检查之一, CEUS的应用使得肝脏肿瘤超声诊断的诊断进入了新阶段[9]。本研究基于超声图像建立肝脏LI-RADS分类,完善、反馈、更新超声图像下LI-RADS分类标准,同时使用统一术语减少图像解读的差异和错误,便于各学科沟通和交流,促进科研工作的发展。本研究显示CEUS LI-RADS分级的灵敏度(SEN)为85.48%,特异度为(SPE)为90.41%,与金标准吻合程度较高。该肝脏超声影像报告标准化模板,设定科学、内容全面,提高了对肝细胞癌的诊断效能,使临床可操作性更强,更加便捷,满足临床及影像医师之间的需求,从而提高超声科及临床医师的工作效率,对病人肝癌的诊断、治疗与评价预后产生积极的影响。该方法简单,便捷,可操作性强,更加满足临床及影像医师之间的需求,易于推广应用,对病人肝癌的诊断、治疗与评价预后产生积极的影响,具有良好的应用前景和社会效益。

