浆细胞性乳腺炎的超声分型及治疗初探
薛晓轩,刘艳(通讯作者),钟馨
(1北京中医药大学东方医院功能检查科 北京 100078)
(2北京中医药大学东方医院乳腺科 北京 100078)
浆细胞性乳腺炎(plasma cell mastitis,PCM)是一种好发于非哺乳期,以乳腺导管扩张和浆细胞浸润为主要病变基础的慢性非细菌性乳腺炎症。本病临床表现多样化,不同时期呈现出不同的特点,临床上易导致误诊误治,最终致乳房损毁,影响患者的身心健康[1]。本病治疗的关键是彻底根除病灶,防止其复发,并最大可能的保留乳房的外形[2]。超声检查在所有的辅助检查中是最常用、最方便的,可用于确定病灶的大小、位置等特征,且PCM不同的时期超声表现不同[3-4]。本研究回顾性分析了2002年5月-2015年8月诊治的179例PCM患者的超声图像特点,尝试结合声像图不同表现进行超声分型,为临床治疗提供更加准确地依据。
1 资料与方法
1.1 一般资料:
选择2002年5月—2015年8月我院诊治的179例浆细胞性乳腺炎患者,均为女性,年龄13~69岁,平均37岁。其中,未婚13例,已婚已育141例,已婚未育25例。单侧乳房163例,双侧16例。病程10天~24个月。就诊时有手术史者21例,其中18例1次手术史,3例2次手术史。均为非哺乳期发病。179例病例中175例乳头发育异常,其中乳头内陷者83例,乳头分裂者64例,乳头扁平、短小者28例。
1.2 仪器与方法
使用GE Vivid E95彩色多普勒超声诊断仪,探头频率12~14MHz。患者取仰卧位或侧卧位,充分暴露乳房及腋下,扫查乳房的四个象限,重点扫查乳头、乳晕后方及病灶区,多切面、全方位观察,应用二维超声观察病灶声像图特点。对于乳头溢液者,应注意寻找扩张的导管、导管扩张程度、管壁情况、管腔内容物情况,如管腔内有异常回声可适度加压探查是否有流动现象;对于肿块,重点观察和记录肿块回声、大小、形态、部位、深度、有无液化及钙化、局部CDFI表现;对于瘘口者,注意瘘管走行及其与乳头关系,瘘管与病灶间有无相连,瘘管内部回声;对于急性期伴有局部炎症者,应注意乳房皮下、脂肪层是否有增厚、水肿表现,病灶内部是否有低、无回声,并观察病灶的血流情况,对有血流显示区进行多普勒频谱取样,记录收缩期峰值流速、阻力指数。最后扫查腋窝淋巴结,观察淋巴结的形态大小,皮髓质厚度及淋巴门结构。
2 结果
2.1 超声声像图表现
根据二维超声声像图病灶内部不同表现,结合本病的自然病理过程,将179例PCM分为5型:单纯导管扩张型、囊肿型、实性肿块型、脓肿型、瘘管型。
(1)单纯导管扩张型:12例,超声表现腺体结构稍紊乱,导管不同程度扩张,直径3~8mm不等,多位于乳晕深方,横断面呈“蜂窝状”改变,部分管腔内可见细小弱回声;腺体内未见明确肿块影,CDFI(彩色多普勒表现):无血流信号。其中9例伴乳头溢液,探头加压乳头后方可见乳头溢液。(见图1)
(2)囊肿型:11例,超声表现为单个或多个无回声区,囊壁较厚,边界模糊不清,内透声欠佳,后方回声增强,无回声区两端可见扩张导管与之相通。CDFI:无血流信号。(见图2)
(3)实性肿块型:78例,超声表现多为乳头后方或乳晕周边肿块,形态不规则,边界欠清晰,毛糙或呈树枝状,无包膜,内部回声不均匀,可为弱回声或囊实性回声,亦或斑片状低回声,后方回声无增强及衰减。CDFI:在病变周边可检出点状或短棒样血流信号。(见图3)
(4)脓肿形成:44例,超声表现为边界不清,形态不规则的低无回声区,病灶范围较大,内部结构紊乱,可见密集光点,加压探头可见点状强回声漂浮。CDFI:病灶周边可检出明确血流信号。(见图4)
(5)瘘管形成:34例,超声表现乳晕瘘口处可见一“虫蚀状”低回声管道,管壁边界清晰,走行不规则,一端位于乳头后方,一端斜行开口于乳晕处,探头挤压乳头后方时,可见分泌物自瘘口溢出。CDFI:可检出少许血流信号。(见图5)

图1 单纯导管扩张型导管不同程度扩张,直径3~8mm,多位于乳晕深方

图2 囊肿型单个或多个无回声区,囊壁较厚,边界模糊不清,内透声欠佳,后方回声增强,无回声区两端可见扩张导管与之相通

图3 实性肿块型乳头后方或乳晕周边肿块,形态不规则,边界欠清晰,毛糙或呈树枝状,无包膜,内部回声不均匀,可为弱回声或囊实性回声,亦或斑片状低回声,后方回声无增强及衰减

图4 脓肿形成型表现为边界不清,形态不规则的低无回声区,内可见密集光点,加压探头可见点状强回声漂浮
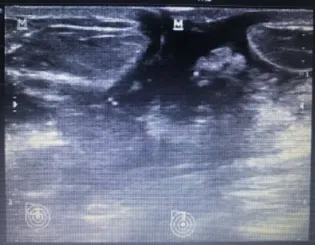
图5 瘘管形成型乳晕瘘口处可见一低回声管道,管壁边界清晰,走行不规则,一端位于乳头后方,一端斜行开口于乳晕处
2.2 治疗方案
2.2.1 结合超声声像图特点,按照上述超声的分型,将179例PCM病例进行临床分期,考虑超声囊肿型及实性肿块型在临床中均触诊呈肿块感合并成一型,故分为4型(见表1):
(1)导管炎期:12例,其中9例伴有乳头溢液,溢液多为黄色油状或脂质样,临床上可无症状,或仅有乳房胀痛感。这是本病的早期阶段,主要表现为导管上皮不规则增生,分泌功能失常,使乳头下的输乳管内有大量含脂质的分泌物积聚而引起导管扩张,此期没有明显的炎性反应。超声图像符合单纯导管扩张型。
(2)肿块期,89例,囊性包块11例,实性包块78例,主要表现为可触及的乳房肿块,伴局部红肿,疼痛明显,当肿块位于乳晕旁或乳头后方时,部分患者挤压肿块可见乳头异常溢液。此期为导管内脂质分泌物形成的化学刺激引起导管壁炎性浸润及纤维增生,进而刺激性物质穿破溢到管周和乳腺间质,使管周和间质发生炎症反应,管周小灶性脂肪坏死,伴大量浆细胞浸润,并形成肉芽肿。相当于超声分型的囊肿型和实性肿块型。
(3)脓肿期,44例;主要表现为乳房肿块红肿,并可触及波动感,疼痛较前略有减轻。本期是在前两期的基础上,严重的感染和炎症反应在病变局部形成脓肿。符合超声分型的脓肿型。
(4)瘘管期,34例;因脓肿自行破溃,或引流后瘘管未能正常愈合而形成的瘘管,挤压可见分泌物溢出。此期为分泌物进入乳腺间隙,形成窦道,侵及腺体及前、后脂肪层,并可在乳晕周边出现皮肤瘘口、排出分泌物。符合超声分型的瘘管型。

表1 179例PCM超声表现与临床分期
2.2.2 分期治疗
(1)导管炎期:3例单纯乳导管扩张未伴乳头溢液患者给予中药辨证内服治疗,病情稳定;9例导管扩张伴乳头溢液患者,采用乳管镜下导管反复冲洗疗法,辅以中药外敷和内服治疗,其中6例治愈,3例治疗后病情反复,后给予手术治疗(病变导管切除术+乳头成形术)。
(2)肿块期:11例囊性肿块,给予中药辨证内服及外敷治疗,病情稳定。78例实性肿块中60例呈现急性炎症期表现,给予中药辨证内服、外敷及抗生素抗感染治疗,其中12例炎症得到有效控制,肿块消失;48例经上述治疗肿块缩小、炎症控制后行根治性手术治疗(乳房区段病灶切除+乳头下病变导管切除+乳头成形术)。18例无痛性肿块直接行根治性手术治疗。
(3)脓肿期:44例均给予脓肿切开引流术,术后隔日换药,溃疡红油(我院自制)纱布填塞创腔,辅以中药辨证内服,直至创腔缩小,炎症控制,再行根治性手术治疗。
(4)瘘管期:34病例初起给予换药或引流手术,辅以中药辨证内服,在窦道内分泌物明显减少,炎症控制时行根治性手术治疗。
2.3 治疗结果
179 例PCM病例根据不同的病理阶段,结合超声图像特点进行临床分期,制定不同的分期治疗方法,最终均取得满意的治疗效果。全部病例治疗后随防1年,均无复发,治疗方式见表2。

表2 179例PCM治疗方式表
4 讨论
浆细胞性乳腺炎临床上常见于非哺乳期和非妊娠期妇女,是一种非感染性乳腺炎症,发病率约占乳腺良性疾病的1.4%~5.4%[5]。本病病程较长,临床表现复杂多样,易误诊误治,延误病情,最终导致乳房毁形。及时诊断仅仅是治疗浆细胞性乳腺炎的前提,而有效彻底的治疗才能从根本上解决患者的痛苦。超声检查不仅是诊断浆细胞性乳腺炎最重要及最常用的辅助检查手段[6],对本病临床治疗方案的制定亦提供着极为重要的参考。对于PCM的治疗,目前有学者根据炎症反应所累及的乳腺部位分为乳晕型、单象限型、多象限型及混合型[7]治疗,有根据病情进展情况分为急性期、亚急性期、慢性期治疗,这些分型分期方法在临床应用中仍存在不足。笔者根据PCM超声声像图特点,将其分为导管炎期、肿块期、脓肿期、瘘管期,在临床治疗中按该分期选择不同的治疗方案,对于导管炎期给予乳管冲洗及中药治疗,对于肿块期首先给予中药辨证治疗控制炎症再给予手术治疗,对于脓肿期给予分次手术治疗,对于瘘管期给予手术治疗,取得了满意的疗效。因此,超声分型在对本病分期治疗方案的选择提供了重要的依据,对于提高浆细胞性乳腺炎的治愈率,减少复发,至关重要。

