茯砖茶中金花菌菌落计数方法的优化
刘凯利,黄亚亚,万斌,梁艳,胡歆,*,纪晓明
(1.咸阳泾渭茯茶有限公司,陕西咸阳712044;2.陕西苍山秦茶集团有限公司,陕西西安710003)
茯砖茶内部或表面存在大量金黄色颗粒状物质,俗称“金花”;其数量的多少是判断茯砖茶品质好坏的重要指标[1]。由于地域的差异性,金花菌具有多样性[2-4],但大都以冠突散囊菌为主,还包括谢瓦式散囊菌、阿姆斯特丹散囊菌、间型散囊菌及肋状散囊菌等。其子囊果均为闭囊壳型[5],他们的共同特征是[6]:培养前期(5 d~6 d),菌落质地紧密,中心颜色为黄色或棕褐色,周边为浅黄色。目前,对金花菌的检测一般均采用GB/T 4789.15-2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》,该方法针对的是食品中霉菌和酵母菌的计数,而金花菌闭囊壳很难破裂[7-9],形成的菌落可能是2个~3个或更多个孢子生长发育而成,因此采用国标方法并不能准确地反映茯砖茶中金花菌的数量。本试验通过响应面法建立多元二次回归方程来拟合因素与响应值之间的函数关系,充分考虑各因素之间的影响,通过前处理条件使金花菌闭囊壳充分破裂释放子囊孢子,从而得到金花菌菌落总数计数的优化条件,为以后建立茯砖茶中金花菌标准计数方法提供试验依据。
1 材料与方法
1.1 材料与设备
原料:茯砖茶,由咸阳泾渭茯茶有限公司提供。
FW100高速万能粉碎机:天津泰斯特仪器有限公司;LDZX-50KBS立式压力蒸气灭菌锅:上海申安医疗器械有限公司;SW-CJ-ID单人单面净化工作台:上海树立仪器仪表有限公司;GHP-90隔水式恒温培养箱:上海一恒科技有限公司;HZQ-C双层空气浴振荡器:哈尔滨东联电子技术开发有限公司。
培养基:孟加拉红培养基,按GB/T 4789.15-2016配制。
1.2 方法
1.2.1 样品的准备
采用GB/T 8302-2013《茶取样》方法取样。将整块茶砖撬碎混匀,取部分混匀茶样粉碎后备用,部分不粉碎茶样作为对照样品。
1.2.2 菌落计数方法
采用GB/T 4789.15-2016方法。取已准备好的茶样25.00 g于装有无菌稀释液的三角瓶中(内含200颗玻璃珠[10]),经振摇后进行梯度稀释,孟加拉红培养基倾注平板,平板于(28±1)℃恒温培养箱培养,第5天计数并拍照记录。
1.2.3 单因素试验
1.2.3.1 筛子目数对金花菌菌落总数的影响
茶样粉碎,分别过筛 40、50、60、70、80、90 目,分别称取过筛后的茶样25.00 g于无菌蒸馏水中,振摇30 min(200 r/min)后进行梯度稀释,孟加拉红培养基倾注平板,(28±1)℃恒温培养箱培养,第5天计数。
1.2.3.2 无菌稀释液浓度对金花菌菌落总数的影响
称取过筛60目的茶样25.00 g,分别加入无菌的蒸馏水、0.45%NaCl、0.85%NaCl、1.25%NaCl、1.65%NaCl、磷酸缓冲溶液中稀释,振摇 30 min(200 r/min)后进行梯度稀释,孟加拉红培养基倾注平板,(28±1)℃恒温培养箱培养,第5天计数。
1.2.3.3 振摇时间对金花菌菌落总数的影响
称取过筛60目的茶样25.00 g于无菌蒸馏水中,在转速为 200 r/min 条件下,分别振摇 20、30、40、50、60、70 min后,进行梯度稀释,孟加拉红培养基倾注平板,(28±1)℃恒温培养箱培养,第5天计数。
1.2.4 响应面试验
在单因素试验基础上,以筛子目数、NaCl浓度、振摇时间为自变量,以金花菌菌落总数为响应值进行响应面试验,中心试验重复5次,共17个试验点,试验设计如表1所示。

表1 因素水平表Table 1 Factor level table
2 结果与分析
2.1 单因素试验结果
2.1.1 筛子目数对金花菌菌落总数的影响
筛子目数对金花菌菌落总数的影响见图1。
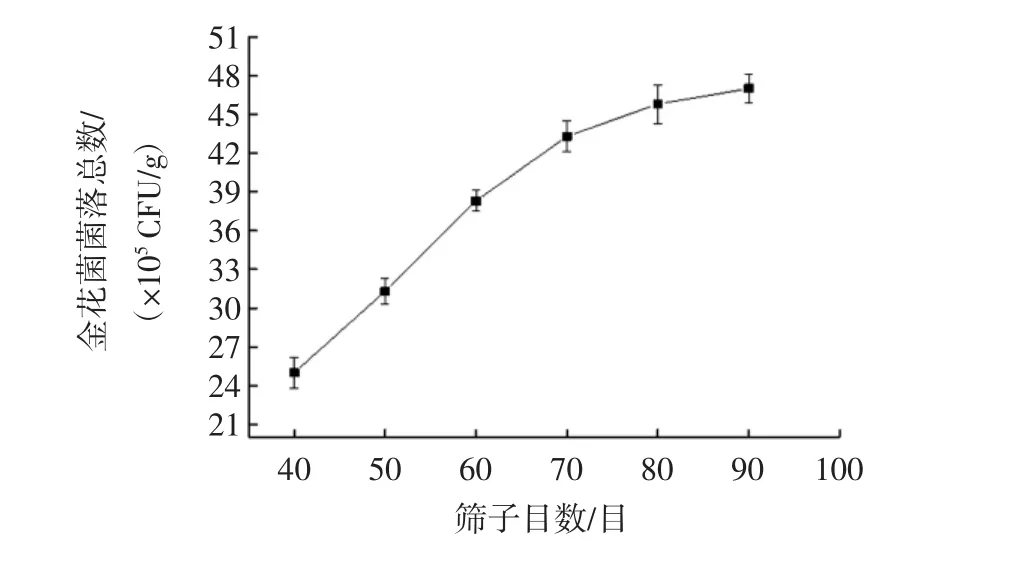
图1 筛子目数对金花菌菌落总数的影响Fig.1 Influence of mesh size on the total number of Jinhua fungus
由图1可知,筛子目数对金花菌菌落总数影响显著。随着筛子目数的减小,金花菌菌落总数呈增长趋势,筛子目数从40目至80目,金花菌菌落总数呈直线增长,筛子目数为80目时,其菌落总数为(45.8±1.5)×105CFU/g;80目至90目,金花菌菌落总数趋于平缓,原因可能是高速粉碎机在粉碎过程中高速撞击并产生热量,当粉碎时间过长时容易导致金花菌孢子结构被破坏而失活。因此,筛子目数选用80目。
2.1.2 无菌稀释液浓度对金花菌菌落总数的影响
无菌稀释液浓度对金花菌菌落总数的影响见图2。
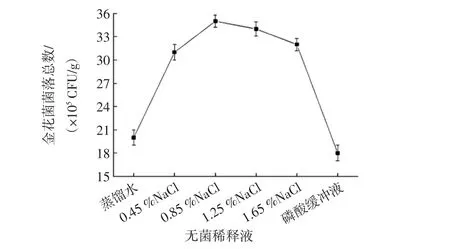
图2 无菌稀释液对金花菌菌落总数的影响Fig.2 Influence of sterile diluent on the total number of Jinhua fungus
由图2可知,磷酸缓冲溶液对金花菌孢子释放作用不明显,数量仅为(18.0±1.0)×105CFU/g。当稀释液中NaCl浓度为0.85%时,金花菌菌落总数最多,为(35.0±0.8)×105CFU/g。当渗透压过低时,过多的水分进入孢子,会使孢子膨胀或破裂而失活;当渗透压过高时,孢子失水收缩,细胞结构容易被破坏而失活。因此,无菌稀释液以0.85%NaCl溶液为宜。
2.1.3 振摇时间对金花菌菌落总数的影响
振摇时间对金花菌菌落总数的影响见图3。

图3 振摇时间对金花菌菌落总数的影响Fig.3 Influence of the shaking time on the total number of Jinhua fungus
金花菌菌落总数随振摇时间的延长而增加,表明物理振摇对金花菌子囊果破壁也有一定影响。当振摇时间为50 min时,金花菌菌落总数为(36.9±0.8)×105CFU/g;振摇50 min后金花菌菌落总数趋于平缓,因此振摇时间选择50 min。
2.2 响应面结果与分析
2.2.1 响应面试验设计及结果
以筛子目数、无菌稀释液浓度、振摇时间为自变量,以金花菌菌落总数为响应值,试验设计与结果见表2。零点为区域的中心点,零点试验重复5次,用以估计试验误差[11]。

表2 响应面设计方案及试验结果Table 2 Experimental design and results of response surface
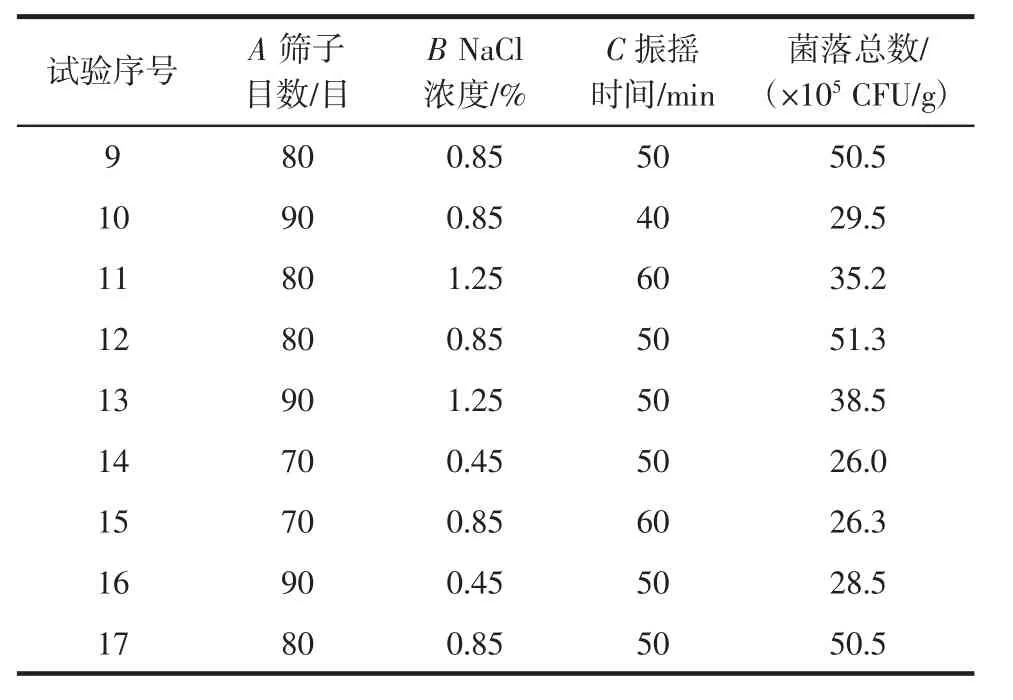
续表2 响应面设计方案及试验结果Continue table 2 Experimental design and results of response surface
2.2.2 模型建立与回归方程分析
采用Design-Expert.V8.0.6对试验数据进行多元线性拟合,得到以金花菌菌落总数为响应值的二次多项回归模型方程:Y=50.42-046A+0.54B+1.78C+0.65AB-0.075AC+2.63BC-8.94A2-10.88B2-14.41C2。对模型方程进行显著性检验,方差分析结果见表3。
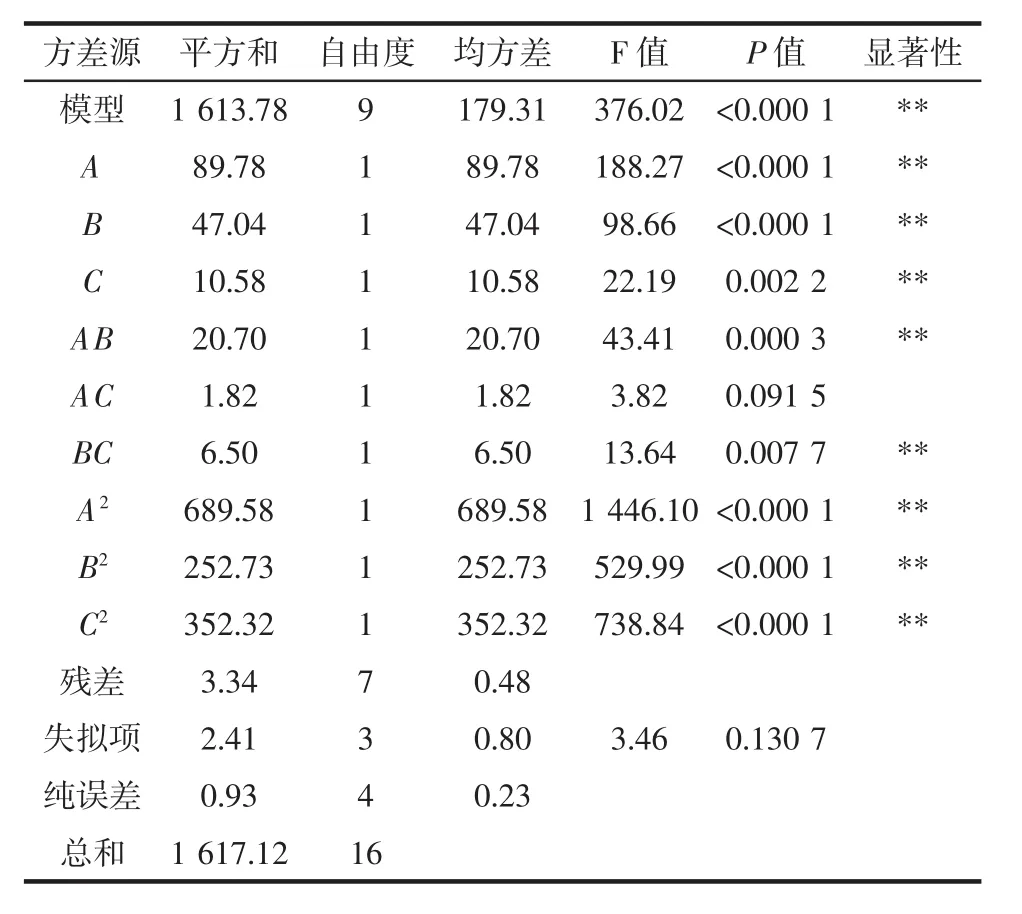
表3 平板计数法回归方程方差分析表Table 3 Analysis of variance of the regression equation of plate counting method
由表 3可知,模型差异性极显著(P<0.000 1),说明方程与实际情况拟合较好,能够反映金花菌菌落总数与各因素之间的关系;失拟项差异不显著(P>0.05),说明其他因素对试验影响很小,适用于茯砖茶中金花菌菌落计数方法的优化。
表3中F值的大小可以判断各因素对金花菌菌落总数影响的强弱。各个因素对金花菌菌落总数影响的程度大小的次序为筛子目数>NaCl浓度>振摇时间,数学模型的结果表明 A、B、C、AB、BC、A2、B2及 C2差异性达到极显著水平(P<0.01),表明各考察因素对金花菌菌落总数的影响具有交互作用,而不是简单的线性关系。可用该回归方程代替试验真实点对试验结果进行分析和预测。其相关系数R2=0.997 9,表明试验所选择的3个变量对响应值的影响已达99.79%,表示该模型条件能够很好地反映实际值。其他影响因素对菌落总数的影响可忽略不计。响应面试验得到的最优处理条件为:筛子目数79.74目、NaCl浓度0.86%、振荡时间50.49 min,模型预测的最佳菌落数为50.49×105CFU/g。
2.2.3 各因素之间的响应面结果分析
各因素交互作用对金花菌菌落总数影响的响应面和等高线图见图4。


图4 各因素交互作用对金花菌菌落总数影响的响应面和等高线图Fig.4 Response surface and contour map of the interaction of various factors on the total number of Jinhua fungus
响应面三维图中曲面的陡峭程度可以表明自变量对金花菌菌落总数的影响程度,曲面较陡表明影响较大,反之则较小;而等高线图反映了因素间交互作用的强弱大小,椭圆形表示交互作用显著,圆形表示交互作用不显著[12]。结合本研究中的二次回归方程及表3可知,二次项AB、BC具有极显著的交互作用(P<0.01),即筛子目数与NaCl浓度、NaCl浓度与振摇时间每两个因素间均具有显著的交互作用。由图4可知筛子目数与NaCl浓度、NaCl浓度与振摇时间、筛子目数与振摇时间对菌落总数的影响先升高后降低,响应值呈抛物线形趋势,因此回归方程有极大值。
2.2.4 模型的验证试验结果
为了检验响应面方法的可靠性,本研究按照模型得到的金花菌菌落总数最佳计数条件进行试验操作验证,结合试验的可行性,得到最终优化条件为筛子目数80目、稀释液为0.85%NaCl溶液、振摇时间50 min,平行6次试验,得到金花菌菌落总数为(50.75±1.1)×105CFU/g,与模型预测的数值进行比较分析,菌落数的RSD值为1.1%,其RSD值远远小于3%,因此,可以选择以上条件作为茯砖茶中金花菌菌落总数的最佳优化参数。
2.3 方法验证
采用上述优化方法与国标方法进行金花菌菌落总数的对比,结果见表4。

表4 国标方法和优化方法对不同茯砖茶的计数结果Table 4 Counting results of different Fu brick tea by GB method and optimization method
结果显示,优化方法得到的金花菌菌落总数是国标方法的5倍左右。
3 结论
目前关于金花菌菌落计数方法及破壁方法的研究较少,本研究在国标方法的基础上对样品前处理条件进行优化,取样时将整块茶砖撬碎混匀,茶样粉碎过筛80目、稀释液为0.85%NaCl溶液,振摇时间50min(转速为200 r/min),该条件下,优化方法得到的金花菌菌落总数均在107CFU/g以上,相比国标方法提高了5倍左右,优化效果明显,为确定金花菌标准计数方法提供了试验依据。

