曲妥珠单抗联合伊立替康+顺铂化疗对Her-2阳性的局部进展期胃癌的疗效及安全性
张念波,刘志娟
胃癌是全球范围内的高发恶性肿瘤之一,我国的胃癌发病率、病死率更是居于所有恶性肿瘤的前列,严重威胁国民健康及生命安全。胃癌并无早期典型症状,诊断难度较大,多数患者进展至中晚期方才确诊,已错过最佳手术切除时间,即使行手术切除,其术后复发转移率也高达40%~60%,而放疗、化疗的效果也均不够理想,预后较差[1]。 研究表明[2-4],胃癌组织中可见Her-2蛋白的过表达,且其过表达与胃癌患者预后呈正相关;而IP化疗方案在目前宫颈癌、食管癌、小细胞癌及非小细胞癌的临床治疗中应用广泛,疗效较为满意。基于此,该研究旨在探讨单纯IP方案与曲妥珠单抗联合IP方案治疗Her-2阳性局部进展期胃癌患者的疗效和安全性。现报告如下。
1 资料与方法
1.1 一般资料 选择2013年1月—2016年5月笔者所在医院收治的Her-2阳性进展期胃癌患者86例,该研究经医院伦理委员会批准,所有患者均经病理学或细胞学检测确诊为胃癌晚期,且经检测确定为Her-2阳性。纳入标准:(1)预计生存期≥3个月;(2)KPS 评分>60 分;(3) 心肝肾等脏器功能正常;(4)签署知情同意书。排除已行手术治疗、合并其他恶性肿瘤、合并自身免疫性疾病及转院等原因无法完成随访者,依照入院顺序将86例患者分为对照组与观察组,每组43例。其中对照组男24例,女 19 例;年龄 47~69 岁,平均(59.43±4.74)岁;分化程度:低分化癌22例,中高分化癌21例;KPS评分61~97 分,平均(75.30±5.96)分。 观察组男 27 例,女16 例;年龄 50~67 岁,平均(60.18±4.59)岁;分化程度:低分化癌20例,中高分化癌23例;KPS评分60~100 分,平均(74.76±6.12)分。 两组基本资料比较,差异无统计学意义(P>0.05),有可比性。
1.2 方法 对照组行IP方案化疗:治疗第1~3天给予注射用顺铂(通化茂祥制药有限公司,国药准字 H22022236,规格:20 mg/支)30 mg/m2静脉滴注;治疗第1天、第8天静脉滴注盐酸伊立替康(海南锦瑞制药有限公司,国药准字H20143127,规格:2 ml:40 mg)60 mg/m2。观察组于 IP 方案基础上在治疗第1天给予曲妥珠单抗(Genentech Inc.注册证号S20060026,规格:440 mg)8 mg/kg,静脉滴注;之后每个治疗周期的第1天静脉注射曲妥珠单抗6 mg/kg。两组均接受相应治疗21 d为一个周期,连续给药6个周期。
1.3 观察指标 (1)肿瘤标志物:治疗1 W前、治疗4个周期时取两组空腹静脉血,以离心半径16 cm、速度3000 r/min处理10 min,采用电化学发光法测定CA199、CA724及CEA水平。(2)近期疗效:参照WHO关于实体肿瘤近期疗效标准[5],以肿瘤消失时间>1个月为完全缓解 (CR);以肿瘤体积缩小>50%,且持续时间>1个月为部分缓解(PR);肿瘤体积缩小≤50%或增大≤25%,持续时间>1个月为稳定(SD);出现新病灶或肿瘤体积增大>25%为进展(PD)。 控制率=(CR+PR+SD)/总例数×100%; 有效率=(CR+PR)/总例数×100%。 (3)远期疗效:进行为期2年的随访,观察患者疾病发展及生存情况,记录中位生存时间及无进展生存时间,其中中位生存时间指接受治疗至死亡时间,无进展生存时间指接受治疗至疾病进展时间。(4)不良反应:观察两组用药期间恶心呕吐、骨髓抑制等发生情况。
1.4 统计学分析 采用SPSS 20.0统计学软件进行数据分析,计量资料以±s表示,组间比较采用t检验;计数资料以百分数表示,组间比较采用χ2检验;P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后血清肿瘤标志物含量比较 治疗前两组血清肿瘤标志物含量对比,差异无统计学意义(P>0.05);治疗后两组血清肿瘤标志物水平均较治疗前下降,且观察组低于对照组,差异有统计学意义(P<0.05)。 见表 1。
2.2 两组近期疗效比较 观察组总控制率及总有效率均明显优于对照组,差异有统计学意义 (P<0.05)。 见表 2。
2.3 两组远期疗效比较 观察组中位生存时间、无进展生存时间均优于对照组,差异有统计学意义(P<0.05)。 见表 3。
2.4 两组不良反应发生情况 两组不良反应主要为Ⅰ、Ⅱ级恶心呕吐、骨髓抑制、肝功能损害及手足综合征等,两组间对比差异无统计学意义(P>0.05)。见表4。
表1 两组治疗前后血清肿瘤标志物含量对比(±s)

表1 两组治疗前后血清肿瘤标志物含量对比(±s)
注:与同组治疗前比较,*P<0.05。
组别 n CA199(U/ml)CA724(U/ml)CEA(ng/L)治疗前 治疗前 治疗前 治疗后对照组 43 90.15±10.07 55.02±6.24 48.03±2.30 18.96±2.00*观察组 43 89.56±9.60 53.87±5.75 48.55±2.48 13.61±1.82*治疗后55.48±6.02*37.89±4.45*治疗后37.20±4.46*24.48±2.95*
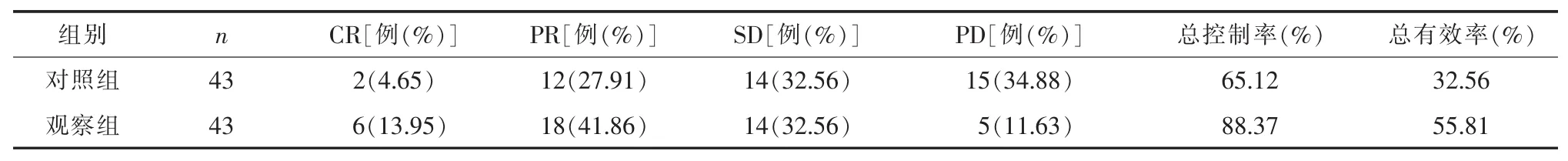
表2 两组近期疗效对比
表3 两组远期疗效对比(±s)

表3 两组远期疗效对比(±s)
组别 n 中位生存时间(月)无进展生存时间(月)对照组 43 9.48±0.93 4.65±0.58观察组 43 12.65±1.52 7.63±0.87

表4 两组不良反应发生情况对比[例(%)]
3 讨论
曲妥珠单抗属人源化单克隆抗体,其对Her-2所介导的生物学功能有较强的拮抗作用,可发挥抑制细胞增殖、诱发细胞凋亡、控制细胞周期发展及减缓肿瘤局部新生血管形成等作用,临床最初将其与常规化疗法案联合以治疗Her-2阳性表达的乳腺癌患者,结果证实其对于抑制乳腺癌的发展及化疗效果的优化有积极作用[6]。
近年来关于分子生物学的研究不断深入,有报道指出曲妥珠单抗抑制癌细胞增殖的机制与降低细胞周期蛋白A、D1及E的表达,从而停滞细胞周期;限制核因子(NF)-κB 的核转位、抑制 Her-2/蛋白酶B/磷脂酰肌醇3-激酶信号通路的激活等有关。有学者认为单一靶向用药的疗效有限,而联合化疗药物又将影响给药顺序和时间,但支持曲妥珠单抗联合化疗治疗Her-2阳性胃癌晚期患者可有效发挥其对Her-2介导生物学效应的抑制作用,胃癌细胞杀伤效果更优这一观点的学者更多[7,8]。该研究结果显示,观察组总控制率为88.37%、总有效率为55.81%,均显著高于对照组的65.12%、32.56%;其中位生存时间、无进展生存时间也显著优于对照组,与李新等[9]报道基本相一致,表明曲妥珠单抗联合化疗的近期疗效更为理想,患者无瘤生存及总生存时间得到延长。血清肿瘤标志物CA199、CA724、CEA等浓度能够有效反应胃癌细胞的活力及胃癌的恶性程度,其中CA199多用于临床筛查胃肠道癌症;CA724则是在胃癌诊断中有较高的灵敏度和特异性的高分子质量糖蛋白;CEA是最早用于诊断恶性肿瘤的标志性抗原分子[10];该研究中观察组患者血清CA199、CA724、CEA水平显著低于对照组,提示联合用药方案对于杀伤肿瘤细胞从而抑制胃癌进展的效用显著。该研究中两组患者均发生了不同程度的恶心呕吐、骨髓抑制、肝功能损害及手足综合征发生,虽两组对比无显著差异,但两组恶心呕吐的发生率均在90%左右,其一提示如何降低不良反应仍为所应重点关注的问题,其二表明联合用药并未增加不良反应发生概率。
综上所述,曲妥珠单抗联合伊立替康+顺铂化疗能够显著降低Her-2阳性局部进展期胃癌患者血清CA199、CA724及CEA等肿瘤标志物水平,较单一化疗方案可在不增加不良反应的前提下优化近期及远期疗效。但该研究样本来源较为单一、数量较少,安全性与治疗效果仍需大样本、前瞻性研究证实。

