基于GFP观察鼠伤寒沙门氏菌HilD介导ssrAB表达的初探
, ,,, ,
沙门氏菌(Salmonella)是一种重要的人兽共患病原菌,在医学、兽医学和公共卫生方面均具有重要意义。该菌为兼性胞内寄生菌,其致病性主要与基因组上成簇分布的编码致病相关基因的特定区域—毒力岛(Salmonellapathogenicity island,SPI)有关。目前在沙门氏菌基因组上发现了约39个SPI,分别以SPI-1~SPI-39表示,其中SPI-1和SPI-2与致病性密切相关[1-2]。有研究报道,位于SPI-1上hilD基因编码的HilD在体外环境下,能对SPI-1的基因表达起调控作用,并且可以与位于SPI-2上的ssrAB启动子区域结合,诱导SPI-2上基因的表达,实现调控沙门氏菌SPI-1和SPI-2的作用[3-4]。然而,有关在体内环境中HilD对ssrAB表达调控的研究尚未见报道。
绿色荧光蛋白(green fluorescent protein, GFP)因具有无细胞毒性、荧光性质稳定、分子量小、操作简单等特点,作为分子标记被广泛用于研究特定的环境下生物体的基因表达和蛋白定位监控等[5-6]。本试验以鼠伤寒沙门氏菌(Salmonellatyphimurium)为研究对象,秀丽隐杆线虫为模式生物,通过同源重组技术将编码绿色荧光蛋白的基因(gfp)插入pMD19-ssrAB质粒中构建pMD19-ssrAB-gfp重组质粒,再转入pWM91自杀质粒中构建pWM91-ssrAB-gfp重组自杀质粒,最终分别转入鼠伤寒沙门氏菌亲本株空质粒菌S.Typhi(pcDNA3.1)、hilD基因回补株S.Typhi(ΔhilD+pcDNA3.1-hilD)和hilD基因缺失株空质粒菌S.Typhi(ΔhilD+pcDNA3.1)中,经含有100 g/mL链霉素-氨苄青霉素的双抗LB琼脂培养基上筛选鉴定后,获得能够稳定表达GFP的标记菌株。将构建的带有GFP分子的标记菌株饲喂秀丽隐杆线虫,利用荧光显微镜观察在线虫体内标记菌株GFP表达和绿色荧光强度及其在线虫体内定殖和分布情况,初步探究体内环境下HilD与ssrAB表达之间的相互关系,为深入探究沙门氏菌HilD介导ssrAB表达调控奠定基础。
1 材料与方法
1.1菌株、质粒和模式生物 鼠伤寒沙门氏菌(Salmonellatyphimurium,S.Typhi)标准株CMCC50115购自广东省微生物研究所菌种保藏中心;亲本株空质粒菌S.Typhi(pcDNA3.1)、hilD基因回补株S.Typhi(ΔhilD+pcDNA3.1-hilD)及hilD基因缺失株空质粒菌S.Typhi(ΔhilD+pcDNA3.1)、pMD19-ssrAB重组质粒均由安徽农业大学动物传染病实验室构建和保存;pEGFP质粒及pWM91自杀质粒购自TAKARA公司;大肠杆菌OP50(E.coliOP50)及秀丽隐杆线虫由安徽农业大学李琳博士馈赠。
1.2主要试剂和仪器 琼脂糖凝胶DNA回收试剂盒(TIANGEN公司),M9培养基(上海羽朵生物科技有限公司),S.Medium培养基(北京普博斯生物科技有限公司),NGM琼脂平板(英国OXIOD公司),聚乙二醇辛基苯基醚Triton-X100(上海生工生物工程股份有限公司),BamhI、HpaI、NotI、XhoI、T4 DNA连接酶均购自于TAKARA生物科技有限公司。荧光显微镜(日本TOKYO公司),Eon全自动酶标仪(美国Bio Tek公司)。
1.3 GFP标记菌株的构建与表达
1.3.1GFP标记菌株的构建与鉴定 根据gfp基因序列(Gene ID:DQ399411.1)设计1对引物,酶切位点分别是BamhI和HpaI(下划线标出),上游引物:5′-ATAGGATCCATGGTGAGCAAGGGCGA-GGA-3′;下游引物:5′-GCGGTTAACTTACTTGTACAGCTCGTCCA-3′,由南京金斯瑞生物公司合成。以pEGFP为模板,PCR扩增得到约700 bpgfp片段。参考文献[7-9],用BamhI和HpaI分别双酶切gfp片段和pMD19-ssrAB载体质粒,按1∶4摩尔比混合,T4 DNA连接酶16 ℃连接12 h。连接产物pMD19-ssrAB-gfp和自杀质粒pWM91分别用NotI和XhoI双酶切,将ssrAB-gfp片段插入pWM91自杀质粒中,提取质粒DNA,PCR鉴定阳性克隆,重组质粒命名为pWM91-ssrAB-gfp。采用固相滤膜杂交法,分别将宿主菌S.Typhi(pcDNA3.1)、S.Typhi(ΔhilD+pcDNA3.1-hilD)和S.Typhi(ΔhilD+pcDNA3.1)与pWM91-ssrAB-gfp进行固相结合,涂布于100 g/mL链霉素-氨苄青霉素双抗LB平板,挑取单克隆,经菌液PCR和双酶切初步鉴定后,送南京金斯瑞生物公司测序验证。
1.3.2GFP标记菌株的表达 将S.Typhi(ssrAB-gfp+pcDNA3.1)、S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)、S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1) 3株标记菌分别接种5 mL含0.04%组氨酸的M9培养基,培养至菌液浑浊,置4 ℃冰箱3 d。分别将诱导表达的标记菌离心后取沉淀,PBS洗涤3次,取10 μL涂于载玻片,石蜡封片,经荧光显微镜观察,同时以未转入pWM91-ssrAB-gfp质粒的S.Typhi(pcDNA3.1)为对照,确认GFP表达与否。
1.4 标记菌株在秀丽隐杆线虫体内的定殖观察
1.4.1线虫同期化培养 参考文献[10-11],将含秀丽隐杆线虫虫卵的S.Medium培养基置20 ℃培养10 h,1 500 r/min离心 3 min,收集幼虫,转至含E.coliOP50的 NGM平板,继续培养48~60 h获L4期幼虫。PBS洗下平板上线虫,洗涤3次收集幼虫,分装于含2 mL S.Medium培养基的12孔板里(每孔大约15~20只虫体),静止培养过夜。
1.4.2标记菌株前处理 将3株标记菌分别接种5 mL LB液体培养基,培养过夜,以S.Typhi(pcDNA3.1)为对照组。分别取培养的标记菌离心后收集沉淀,用S.Medium培养基洗涤2次并重悬菌体,测定标记菌株OD600,调至所需浓度,备用。
1.4.3标记菌株饲喂线虫 将同期化线虫分别涂于含3株标记菌的NGM平板,以S.Typhi(pcDNA3.1)为对照组,20 ℃孵育10 h。
1.4.4线虫体内GFP的显微观察 用PBS洗下NGM平板上线虫,清洗3次,分别放入含有1% Triton-X100的M9培养基,15 ℃培养2 h。PBS洗涤3次收集菌体,取5%琼脂溶解后滴加于载玻片,立刻轻轻用盖玻片压平,形成约0.4 mm 厚的琼脂圈,待琼脂冷却后,移去盖玻片,滴加20 μL 10 mmol/L的NaN3于凝固的琼脂圈上,取线虫置琼脂圈的表面,待线虫定型后盖上玻片,荧光显微镜下观察标记菌在线虫口咽部和肠道内的分布情况。
1.4.5统计学分析 利用ImegJ软件对拍摄的荧光图片半定量分析,并采用Prism软件作图。本研究统计分析均采用SPSS 19.0软件分析,P<0.05为有统计学意义。
2 结 果
2.1GFP标记菌株的构建 将gfp基因克隆于pMD19-ssrAB重组质粒载体上,PCR鉴定,由图1-A可知,扩增片段大小为2 081 bp(ssrAB-gfp),与预期结果一致;提取阳性重组质粒pMD19-ssrAB-gfp双酶切鉴定,由图1-B及测序结果可知,双酶切片段大小分别为2 081 bp(ssrAB-gfp)、2 692 bp(pMD19),与预期结果一致;将ssrAB-gfp基因克隆于pWM91自杀质粒载体上,提取阳性重组质粒pWM91-ssrAB-gfp双酶切鉴定,由图1-C及测序结果可知,双酶切片段大小分别为2 081 bp(ssrAB-gfp)、8 423bp(pWM91),与预期结果一致;通过固相结合方法,将ssrAB-gfp分别转化到S.Typhi(pcDNA3.1)、S.Typhi(ΔhilD+pcDNA3.1-hilD)和S.Typhi(ΔhilD+pcDNA3.1)中,由图1-D及测序结果可知,扩增片段大小2 081 bp(ssrAB-gfp)、274 bp(pcDNA3.1)、965bp(pcDNA3.1-hilD),与预期结果一致。成功构建了3株标记菌S.Typhi(ssrAB-gfp+pcDNA3.1)、S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)、S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)。
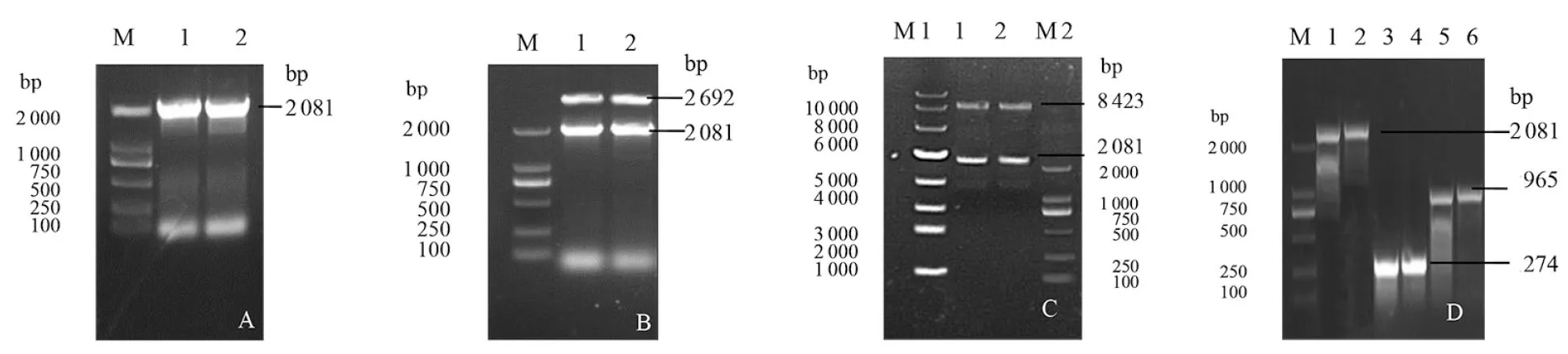
A:M: DNA Marker DL2000;1-2: ssrAB-gfp基因PCR扩增产物;B:M: DNA Marker DL2000;1-2:pMD19-ssrAB-gfp双酶切鉴定;C:M1: DNA Marker DL10000;M2: DNA Marker DL2000;1-2:pWM91-ssrAB-gfp双酶切鉴定;D:M: DNA Marker DL2000;1-2:ssrAB-gfp基因PCR扩增产物;3-4:pcDNA3.1 PCR扩增产物;5-6: pcDNA3.1-hilD PCR扩增产物;图1 PCR扩增及重组质粒酶切鉴定Fig.1 Amplification of PCR and the enzymes digestion of the recombinant plasmids
2.2标记菌株GFP的荧光观察 以未插入gfp基因的S.Typhi(pcDNA3.1)为对照,利用荧光显微镜观察3株标记菌中GFP的表达情况。对照组S.Typhi(pcDNA3.1)未见绿色荧光(图2-A),而3株标记菌均可见绿色荧光(图2-B、图2-C、图2-D),显示标记菌已成功表达了外源GFP,且荧光强度存在明显差异。由图2-E可知,S.Typhi(ssrAB-gfp+pcDNA3.1)的荧光强度显著高于S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)(t=3.513,P<0.05)和S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)(t=6.722,P<0.05),且S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)荧光强度高于S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1) (t=3.980,P<0.05)。

A:荧光显微镜下S.typhi(pcDNA3.1) 的表达;B:荧光显微镜下S.typhi(ssrAB-gfp+pcDNA3.1) 的表达;C:荧光显微镜下S.typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD) 的表达;D:荧光显微镜下S.typhi(ΔhilD+ssrAB-gfp+pcDNA3.1) 的表达 图2 GFP在标记菌株中的表达差异Fig.2 Differences of expression of GFP in tagged strains
2.3标记菌株在秀丽隐杆线虫体内的定殖显微观察 将3株标记菌和对照菌S.Typhi(pcDNA3.1)饲喂感染线虫,利用荧光显微镜观察GFP在线虫体内的表达及分布情况。由图3-A可知,对照组未见绿色荧光,但3株标记菌在线虫体内可见分布不均的绿色荧光,主要分布在口咽部和肠道内(图3-B、图3-C、图3-D),且荧光强度均为口咽部较肠道的高(tA=2.796;tB=2.785;tC=0.099,P<0.05,)(图3-E),显示标记菌可在线虫体内定殖并成功表达GFP。通过ImegJ软件比较绿色荧光强度,由图3-F可以看出,3株标记菌的荧光强度由强到弱依次为S.Typhi(ssrAB-gfp+pcDNA3.1)>S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)>S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)。其中,S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)荧光强度显著低于S.Typhi(ssrAB-gfp+pcDNA3.1)(t=10.370,P<0.05)和S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)(t=8.477,P<0.05),且S.Typhi(ssrAB-gfp+pcDNA3.1)与S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)之间荧光强度差异有统计学意义 (t=3.554,P<0.05)。
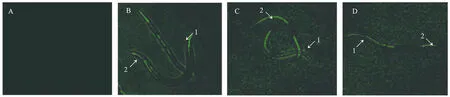

1:口咽部;2:肠道A:线虫体内S.typhi(pcDNA3.1)的表达;B:线虫体内S.typhi(ssrAB-gfp+pcDNA3.1)的表达;C:线虫体内S.typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)的表达;D:线虫体内S.typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)的表达;E:标记菌在线虫体内分布情况;F:标记菌在线虫体内荧光强度对比图3 标记菌株在线虫体内定殖情况Fig.3 Colonization of tagged strains in vivo of Caenorhabditis elegans
2.4标记菌株在线虫体内外环境下荧光强度比较通过ImegJ软件比较3株标记菌和对照菌的绿色荧光强度,由图4可知,在线虫体内和体外环境下,S.Typhi(ssrAB-gfp+pcDNA3.1)与S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)之间荧光强度无明显差异(tA=0.595;tB=0.719;P>0.05),而S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)在体内的荧光强度明显弱于体外(t=7.091,P<0.05)。

图4 3株标记菌在线虫体内与体外的荧光强度比较Fig.4 Comparison of the fluorescence intensity of three tagged strains in vivo and in vitro of Caenorhabditis elegans
3 讨 论
鼠伤寒沙门氏菌(Salmonellatyphimurium)属于沙门氏菌属B群,是一群宿主非特异性肠道致病菌,具有广泛的宿主谱和致病性,能致各种动物及人的副伤寒,常引起人类食物中毒和其他疾病。近年来,该菌是世界各国分离率最高的沙门氏菌菌型之一[12-13],在医学、兽医学和公共卫生方面的重要性均十分显著。
目前,关于沙门氏菌毒力岛调控的研究已经成为探究该菌致病机理的重要方面。SPI-1和SPI-2是感染、侵袭、定殖于宿主的关键因子[14-17]。位于SPI-1上的调节子HilD不仅能调控SPI-1上基因表达,而且HilD可通过结合于SPI-2上ssrAB二元调控系统调节SPI-2上基因的表达。Martínez和Bustamante等研究发现体外环境下HilD调控SPI-2的机制与SPI-2上ssrAB基因启动子有关,HilD可结合到ssrAB的启动子上,招募OmpR蛋白,通过蛋白相互作用,将阻遏蛋白HS-N从ssrAB基因启动子上替换下来,使SPI-2上其他毒力基因得到表达。体外环境下HilD能够介导ssrAB的表达[4,18],但迄今尚未有文献报道体内环境中HilD对ssrAB表达的调控作用。
秀丽隐杆线虫因体小、通体透明、生长周期短、基因组信息明确、实验室条件下易于培养及观察等优势,而作为经典的模式生物[19]。1994年Chalfie等首次报道以秀丽隐杆线虫为模型,通过观察原核细胞或真核细胞中GFP的发光强弱,研究单个细胞基因表达和蛋白定位[20]。现已报道感染线虫的致病菌有沙门氏菌、铜绿假单胞菌、粪肠球菌等,其中鼠伤寒沙门氏菌是细菌中已发现的唯一感染秀丽隐杆线虫的胞内菌[21-22]。
本试验首先成功构建携带gfp基因的3株标记菌S.Typhi(ssrAB-gfp+pcDNA3.1)、S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)和S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1),以未携带gfp基因的S.Typhi(pcDNA3.1) 菌株为对照,通过荧光显微镜观察到3株标记菌均呈现绿色荧光,对照菌则无荧光,表明外源GFP在标记菌中得到表达。继而重要的是将上述3株标记菌和对照菌饲喂感染秀丽隐杆线虫后,以荧光显微镜仍可直接观察到3株标记菌的绿色荧光,而对照菌无荧光,表明携带gfp基因的标记菌在线虫体内也获得了GFP的表达。ImegJ软件半定量测定的结果显示,标记菌的绿色荧光强度存在差异。在体外环境下,虽然S.Typhi(ssrAB-gfp+pcDNA3.1)的荧光显著强于S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)(P<0.05),这可能由于hilD基因缺失株回复时转入了hilD基因过表达质粒,使HilD表达量下降,进而引起ssrAB表达水平低[23-24];但S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)与S.Typhi(ssrAB-gfp+pcDNA3.1)和S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD) 之间的差异有统计学意义。在秀丽隐杆线虫体内呈现了同样情况,S.Typhi(ssrAB-gfp+pcDNA3.1)的荧光显著强于S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)(P<0.05)及S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)(P<0.05),且S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)与S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD) 之间的差异有统计学意义。不仅证实了体外环境下鼠伤寒沙门氏菌HilD正调控ssrAB,也表明了体内环境中HilD对ssrAB的调控具有相同作用。然而HilD并非单一介导ssrAB的表达调控,尚存在其他调控因子的参与。有研究表明,体外环境下ssrAB的表达既受HilD的调控,又能够通过EnvZ/OmpR、PhoP/Q双组份系统以及转录调控因子SlyA等参与调控[25-28]。由此推断在体内环境中,HilD介导ssrAB表达的调控机制可能与体外环境下的相似。
比较标记菌株在秀丽隐杆线虫体内外的绿色荧光强度,S.Typhi(ssrAB-gfp+pcDNA3.1)与S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1-hilD)之间无明显差异,但S.Typhi(ΔhilD+ssrAB-gfp+pcDNA3.1)在线虫体内的荧光强度明显弱于体外,其原因可能是:①标记菌株gfp-ssrAB在线虫体内的表达量较低;②在不同生长条件下,沙门氏菌的HilD表达水平存在显著差异,从而导致ssrAB表达量的变化[29-30];③HilD与宿主间的相互作用也可能影响其对ssrAB表达的调控,López-Garrido证实hilD基因的mRNA的3′端未翻译区存在一些符合真核生物的特征序列,预测宿主体内的某些基因可能影响了hilD对ssrAB表达的调控[31]。此外,本试验结果显示,3株标记菌在线虫体内分布不均,主要定殖在口咽部和肠道中,且其荧光强度为口咽部较肠道高,这可能与线虫口咽部和肠道的结构及其分泌的效应因子有关。Sulston[32]发现线虫的口咽部是由20个肌肉细胞、20个神经细胞和18个上皮细胞形成的3条辐射状结构,肠道则是由20个上皮细胞组成的简单线性结构,口咽部黏膜面积大于肠道黏膜面积,有利于标记菌在该处定殖。Berman[33]研究表明线虫表达的抗菌肽ABF在口咽部和肠道中均能发挥抑菌活性,同时肠道分泌的3种溶菌酶lys-1、lys-7、lys-8也具有杀菌作用,能够有效抑制标记菌在其内定殖。由此也可初步推断出鼠伤寒沙门氏菌对秀丽隐杆线虫的侵染路线。
本试验成功在鼠伤寒沙门氏菌中稳定表达了gfp基因,利用秀丽隐杆线虫作为模式生物,使GFP在其口咽部和肠道的黏膜表面得到表达,首次进行了体内环境中HilD介导ssrAB表达的初探,为进一步开展HilD与ssrAB基因结合位点的确立,深入探究沙门氏菌HilD介导ssrAB表达调控奠定基础。

