双响应脂质体纳米凝胶的构建及性能
董岸杰,于立霞,马金凤,邓联东,张建华, 3
双响应脂质体纳米凝胶的构建及性能
董岸杰1, 2,于立霞1,马金凤1,邓联东1,张建华1, 3
(1. 天津大学化工学院,天津 300072;2. 天津化学化工协同创新中心,天津 300072;3. 天津大学天津膜科学与海水淡化技术重点实验室,天津 300072)
针对抗癌药物难以在肿瘤部位精准控制释放的问题,设计了一种双重响应脂质体纳米凝胶载体.通过模板原位聚合方法,本文构建了pH和还原双敏感的脂质体纳米凝胶(pH/R-lipogels),其中包括pH敏感的脂质体膜和二硫键交联的氧化还原敏感纳米凝胶内核.通过激光粒度仪和透射电镜研究了pH/R-lipogels的粒径分布和形貌,结果证明pH/R-lipogels粒径分布较窄且呈现出规则的球形结构.体外药物释放实验结果表明,载药双敏感脂质体纳米凝胶(DOX@pH/R-lipogels)能够快速响应pH值和GSH浓度的变化,提高阿霉素盐酸盐(DOX)的释放速率.体外细胞实验显示,DOX@pH/R-lipogels在肿瘤细胞微环境的刺激下,DOX能够被有效地释放进而促进4T1细胞凋亡.这些结果表明脂质体纳米凝胶在药物递送系统中具有很大的潜力并为膜材料的研究奠定了基础.
脂质体;纳米凝胶;双敏感;药物递送
由于良好的生物相容性和多功能性,脂质体作为有效的药物递送纳米系统被广泛用于生物医药领域.然而,脂质体的应用由于其存储稳定性差,药物提前泄漏和药物释放不受控制等缺点而受到限制[1].功能化的脂质体磷脂双分子层膜可对各种物理和化学刺激做出响应,包括温度、pH值和离子等,可以有效解决药物在体内循环过程中提前泄露的问题[2-3].
随着纳米载体的发展,纳米凝胶由于其良好的生物相容性、机械稳定性以及易修饰性受到研究者们的广泛关注[4-6].尤其是改性后具有刺激响应性的纳米凝胶,能够响应周围环境如pH、温度的变化,实现药物的控制释放,从而提高对癌症的治疗效果.
谷胱甘肽(GSH)作为体内重要的还原剂,可以破坏二硫键.研究发现,肿瘤细胞与正常细胞的微环境有显著差异,肿瘤细胞内的GSH浓度为0.5~10,mmol/L,远远高于肿瘤外的GSH浓度(2~20,μmol/L).同时,肿瘤细胞周围组织液的pH值(6.8~7.2)及肿瘤细胞内的pH值(4~6)与正常细胞内外的pH值(7.4)也存在一定的差异.基于肿瘤细胞相比于正常细胞而显示出来的特异性,构建一种可响应肿瘤微环境特异性刺激的多敏感纳米药物递送系统是提高抗癌药物递送效率的关键[7].
因此,本文构建了稳定、高载药量以及可响应肿瘤微环境刺激的载药纳米凝胶(DOX@pH/R-lipogels)载体.使用羧基化胆固醇和蛋黄卵磷脂制备了pH敏感的脂质体膜,接着以脂质体膜为聚合模板,丙烯酰胺为单体,还原敏感的胱氨酸甲基丙烯酸酯(CDA)为交联剂,通过模板原位聚合方法[8-9]设计出一种新型的pH和还原双敏感的纳米药物递送载体pH/R-lipogels.模型药物阿霉素盐酸盐(DOX)通过主动载药的方式负载到纳米载体中[10-11].本实验对pH/R-lipogels的水合粒径及形貌进行表征,研究不同刺激条件对pH/R-lipogels粒径的影响.同时探究了在不同条件下药物释放行为的变化.通过体外溶血实验探究pH/R-lipogels的血液相容性,并评价细胞对pH/R-lipogels的摄取能力及pH/R-lipogels的体外细胞毒性.
1 实 验
1.1 实验主要材料
阿霉素盐酸盐(DOX,99%,)、谷胱甘肽(GSH,99%,)、核染料(Hoechst 33342,BR)、蛋黄卵磷脂(egg PC,BR)和聚乙二醇辛基苯基醚(TX100,BR)均购自上海阿拉丁生化科技股份有限公司;偶氮二异丁脒盐酸盐(V-50,98%,)、丙烯酰胺(AAM,99%,)、N,N-亚甲基双丙烯酰胺(MBA,98%,)、胆固醇(Chol,95%,)、胆固醇琥珀酸单酯(CHEMS,97%,)和抗坏血酸(99%,)均购自天津希恩思生化科技有限公司;氯化钠、氯化钾、无水磷酸氢二钠、无水磷酸二氢钾、柠檬酸和三氯甲烷均为分析纯试剂,购自利安隆博华(天津)医药化学有限公司.胱氨酸二甲基丙烯酸酯(CDA)详细的制备方法见文献[12].
1.2 脂质体纳米凝胶的制备
pH和还原双敏感脂质体纳米凝胶的制备方法如下:40,µmol的egg PC和13,µmol的CHEMS通过2,mL三氯甲烷溶解在500,mL的梨形瓶中,用旋转蒸发仪将溶剂除去得到一层无色透亮的薄膜,放入真空干燥箱中12,h使溶剂完全挥发.将得到的干燥脂质体膜用5,mL水凝胶预聚物水溶液(500,mg单体AAM,50,mg交联剂CDA,5,mg引发剂V-50,260,mmol硫酸铵)水化.通过手摇法使脂质体膜从内壁脱落溶解到预聚水溶液中,在冰水浴下将样品置于细胞粉碎仪探头下400,W超声5,min,形成由脂质体囊泡和纳米凝胶预聚物水溶液组成的混合溶液.接着在脂质体外加入可阻止脂质体囊泡外部聚合的阻聚剂抗坏血酸50,mg,抽真空后通入氮气,重复3次.将在氮气保护下的密封反应装置置于45,℃水浴锅中反应70,min,并将反应后的溶液置于透析袋(截留相对分子质量8,000)中透析去除未反应的单体、交联剂及硫酸铵.先后用200,nm、100,nm孔径大小的脂质体挤出器挤出透析所得溶液,得到粒径分布良好的双敏感脂质体纳米凝胶溶液,定义为pH/R-lipogels.
脂质体膜包覆的还原敏感纳米凝胶(R-lipogels)的制备方法同上,只是将具有pH敏感性的胆固醇琥珀酸单酯(CHEMS)换成普通胆固醇(Chol);pH敏感脂质体膜包覆的无敏感纳米凝胶(pH-lipogels)是在制备过程中,将带有二硫键的交联剂CDA换成普通交联剂MBA所制得的;在双敏感纳米凝胶的制备过程中,将CHEMS换成普通的Chol、将CDA换成MBA,制得非敏感脂质体纳米凝胶(N-lipogels).
1.3 pH/R-lipogels粒径及形貌表征
本实验采用激光粒度仪来测定pH/R-lipogels的粒径及其粒径分布.每个样品重复测试3次,测试时间为2,min,取3次测试平均值做为最终测试结果.利用透射电子显微镜观察pH/R-lipogels的形貌,制样方法如下:将待测溶液滴加到碳膜铜网上,室温下于超净台放置24,h,至水分自然挥发后,通过透射电镜观察.
1.4 DOX@pH/R-lipogels的制备
载药脂质体纳米凝胶DOX@pH/R-lipogels利用硫酸铵主动载药的方法来制备[11],具体步骤如下:称取一定量的DOX溶解于超纯水中配成质量浓度为10,mg/mL的溶液,以阿霉素与卵磷脂的质量比为0.167的比例将DOX加入到上述制得的双敏感pH/R-Lipogels溶液中,然后将混合溶液放入60,℃水浴锅中共培育1,h,之后透析24,h去除未包封的药物,得到负载DOX的脂质体纳米凝胶DOX@pH/R-lipogels,整个过程需要避光处理.通过紫外-可见光分光光度仪测定波长在480,nm处DOX的吸光度,结合盐酸阿霉素的标准曲线,用总投药量减去透析液中药物量即为包封药物量,包封率(%)和载药量(%)计算式分别为

(1)

(2)
1.5 药物释放行为研究
DOX@pH/R-lipogels在37,℃下置于不同的缓冲液中进行药物释放研究:①pH 7.4的PBS溶液;②GSH浓度为10,mmol/L,pH 7.4的PBS溶液;③pH 5.0的PBS溶液;④GSH浓度为10,mmol/L,pH 5.0的PBS溶液.取2,mL的DOX@pH/R-lipogels溶液密封到透析袋并置于10,mL缓冲溶液中,每组3个平行样,然后放入37,℃的恒温振荡器中(80,r/min)进行体外药物释放实验.在规定的时间间隔点,取出3,mL释放液并补加3,mL新鲜的缓冲液.
使用紫外-可见光分光光度仪,结合盐酸阿霉素的标准曲线,测试取出的释放液中阿霉素的含量.累积药物释放量计算式为

(3)

1.6 体外细胞摄取
以4T1乳腺癌细胞为细胞模型,将细胞以2×105细胞/孔的密度在6孔板中种植并以37,℃培养24,h.然后将细胞与游离DOX和载有DOX的脂质体纳米凝胶(DOX@R-lipogels、DOX@pH-lipogels、DOX@pH/R-lipogels和DOX@N-lipogels)以一定的DOX质量浓度(10,μg/mL)共培育4,h.之后,除去培养基,并用PBS洗涤细胞3次.细胞核用Hoechst 33342染色.采用共聚焦激光扫描显微镜观察细胞的摄取情况.
1.7 体外细胞毒
以4T1乳腺癌细胞为肿瘤细胞模型,采用MTT法表征脂质体纳米凝胶的体外细胞毒性.4T1细胞被接种在96孔板中,密度为8,000细胞/孔,在DMEM培养基中,将细胞置于37,℃、5%, CO2的条件下培养24,h.培养完成后,移除适量培养基,分别添加100,μL不同质量浓度的空白脂质体纳米凝胶溶液、游离DOX和几种负载DOX的脂质体纳米凝胶溶液(根据DOX质量浓度的不同分为多组),在上述条件下培养48,h之后,移除纳米凝胶培养液,添加100,μL DMEM培养基和20,μL MTT溶液,继续培养4,h.之后完全移除培养基,每孔加入150,μL的DMSO,避光振荡待紫色结晶全部溶解,振荡培养板使其均匀染色.使用酶标仪检测波长在570,nm处的吸光度,计算细胞的存活率.
1.8 体外溶血实验
室温下,取1mL新鲜的血液利用离心机以2,000,r/min的转速离心5,min,移除上层清液,然后用无菌的PBS溶液冲洗,再离心,重复4次.将红细胞(RBC)悬浮于PBS中并添加无药脂质体纳米凝胶使载体质量浓度达到400,μg/mL.用PBS和纯水处理RBC分别用作阴性和阳性对照.将100,μL上清液转移到96孔板中,在波长573,nm处测定吸光度值.细胞的溶血率(%)计算式为

(4)
2 实验结果与讨论
2.1 pH/R-lipogels性能表征
使用激光粒度仪(DLS)和透射电子显微镜(TEM)对pH/R-lipogels进行表征.由图1可知,pH/R-lipogels粒径为(128±7.9)nm,PDI分布为0.150,通过电镜图片可知pH/R-lipogels呈球形结构,粒径约为110,nm,说明pH/R-lipogels形貌规则,粒径分布良好.
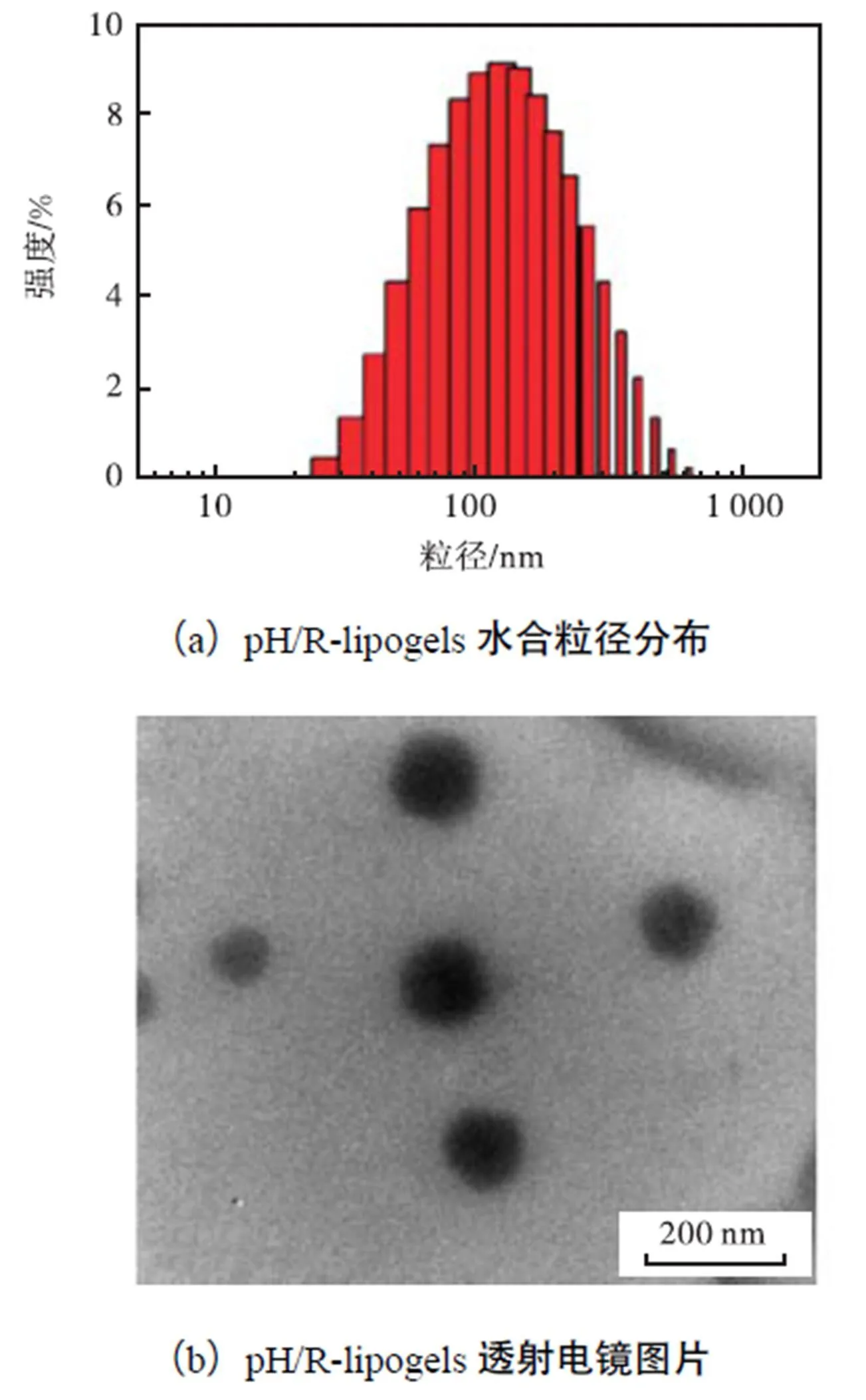
图1 pH/R-lipogels的粒径分布和透射电镜图

图2 DOX@pH/R-lipogels在不同条件下的粒径分布
2.2 DOX@pH/R-lipogels敏感性能表征
通过硫酸铵主动载药技术,本文制备出高载药量的DOX@pH/R-lipogels并采用激光粒度仪(DLS)对脂质体纳米凝胶的性能进行表征.如图2所示,pH值为7.4时DOX@pH/R-lipogels的粒径为(140±5.0)nm,粒径分布较窄;pH值为6.5时,DOX@pH/R-lipogels粒径分布较宽,粒径变大;当pH值为5.0时,粒径分布更宽,而且出现了两个峰,说明随着pH值的降低,脂质体膜孔隙变大,结构也变得松散、不稳定.上述现象表明DOX@pH/R-lipogels具有pH敏感性.在pH值为7.4的条件下,加入GSH后,粒径略微变大;当加入TX-100溶液后,观察到两个粒径峰,一个是表面活性剂TX100将脂质体膜去除后的10,nm左右的胶束峰,另一个是100,nm左右很小的纳米凝胶峰,说明DOX@pH/R-lipogels纳米凝胶内核具有还原响应性.
2.3 DOX@pH/R-lipogels体外药物释放
首先通过主动载药方法将DOX药物包裹到pH/R-lipogels中,药物包封率为99.67%(质量分数),载药量为28.94%(质量分数).接着探究了DOX@ pH/R-lipogels在pH和GSH还原条件下双重刺激的药物释放行为,如图3所示.在pH 7.4的PBS溶液中,24,h药物累积释放量为28.48%,在同样的pH条件下,GSH加入明显加快了药物释放,24,h药物累积释放量可达61.7%,,这是由于GSH的加入破坏了脂质体内部还原敏感的纳米凝胶,使得存储于纳米凝胶内部的DOX从脂质体扩散出来.当释放介质的pH值为5.0时,DOX的24,h累积释放量为48.7%,这是因为低pH条件下脂质体双分子层结构发生变化,部分药物也会从脂质体的增大的孔隙中扩散出来;在低pH和GSH的双重刺激下,DOX在24,h的累积释放量高达99%,,药物几乎完全释放.综上所述,本实验构建的pH/R-lipogels具有显著的pH和还原双重响应性能,可实现药物在肿瘤细胞内的有效递送.

图3 DOX@pH/R-lipogels在不同条件下DOX释放曲线
2.4 细胞摄取
有效的细胞摄取是提高抗癌药物治疗效果的先决条件.为了证明pH和还原双敏感的载体pH/R-lipogels可以在肿瘤细胞特殊的微环境下快速释放药物,本实验利用共聚焦显微镜观察了负载DOX的4种载体DOX@pH/R-lipogels、DOX@R-lipogels、DOX@pH-lipogels和DOX@N-lipogels与4T1细胞共培育一段时间之后的药物摄取情况.Hoechst 33342被用于细胞核染色使其发出蓝色荧光,红色荧光是DOX自身的荧光,通过荧光的叠加可以观察DOX被细胞摄取的情况.如图4所示,DOX@pH/R-lipogels在4T1细胞核周围的红色荧光强度最强,游离DOX和单敏感的DOX@R-lipogels、DOX@pH-lipogels荧光强度较弱,而无敏感的DOX@N-lipogels培养的细胞荧光强度最弱.这些结果表明,DOX@pH/R-lipogels在被细胞胞吞后,由于其内核和脂质体膜的双重敏感,导致纳米凝胶内核破坏、脂质体膜孔隙变大,使DOX能够有效地、快速地释放.如图所示,DOX@pH/R-lipogels中DOX在细胞核周围的分布明显高于其他单敏感纳米凝胶组和靠小分子扩散进入细胞的游离阿霉素.综上所述,具有pH和GSH双重敏感的载药脂质体纳米凝胶DOX@pH/R-lipogels能够实现细胞内的快速释放.尤其相比于单敏感的载药纳米凝胶,DOX@pH/R-lipogels的内核和外层脂质体膜都可对肿瘤细胞的微环境做出响应,在胞内药物释放时呈现出更好的效果.

图4 4T1细胞对游离DOX和负载DOX药物的不同脂质体纳米凝胶载体摄取共聚焦显微镜图片(标尺:20,μm)
2.5 体外细胞毒性
本实验采用MTT方法测定载体的体外细胞毒性,选用细胞为4T1细胞.如图5(a)所示.当4种空白脂质体纳米凝胶的最高质量浓度为500,μg/mL时,细胞存活率仍都在85%,以上,表明这些载体有很好的生物相容性.
如图5(b)所示,随着DOX质量浓度的增加,细胞存活率均显示出降低的趋势.几种载药脂质体纳米凝胶显示出的药效与DOX基本一致,当DOX质量浓度过高时,双敏感载药脂质体纳米凝胶DOX@pH/R-lipogels表现出更强的细胞毒性.
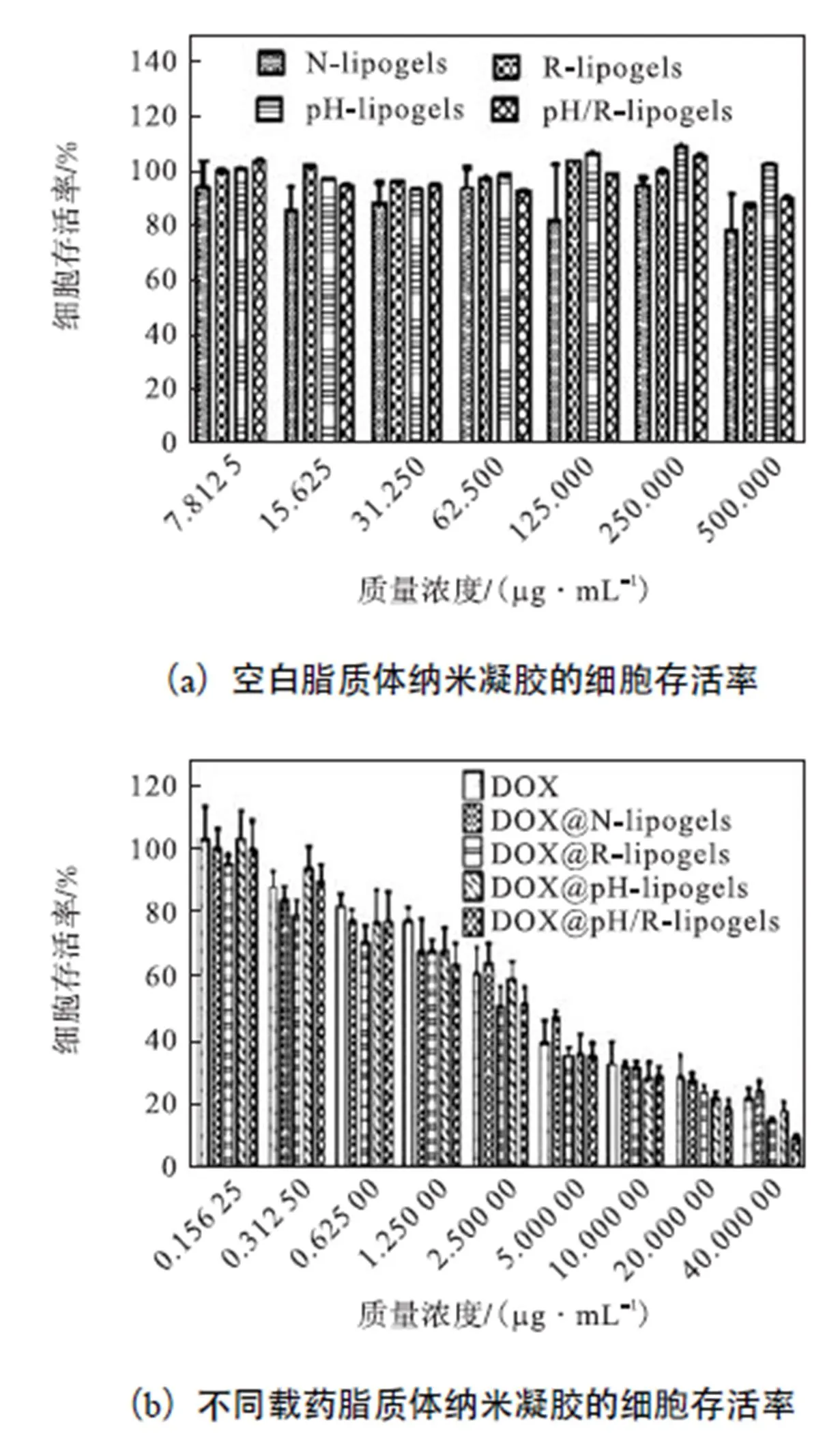
图5 不同质量浓度空白脂质体纳米凝胶和载药脂质体纳米凝胶对4T1细胞毒性的研究
2.6 溶血试验的研究
纳米材料的血液相容性是评价其生物相容性的重要标准.PBS作为阴性对照组,水作为阳性对照组,pH/R-lipogels作为实验室组进行实验.如图6所示,在37,℃下pH/R-lipogels与RBC在PBS溶液中孵育4,h后没有表现出明显的溶血性,并通过计算得到pH/R-lipogels的溶血率低于5%,.以上结果表明pH/R-lipogels载体有很好的生物相容性,可用于后期的体内实验.
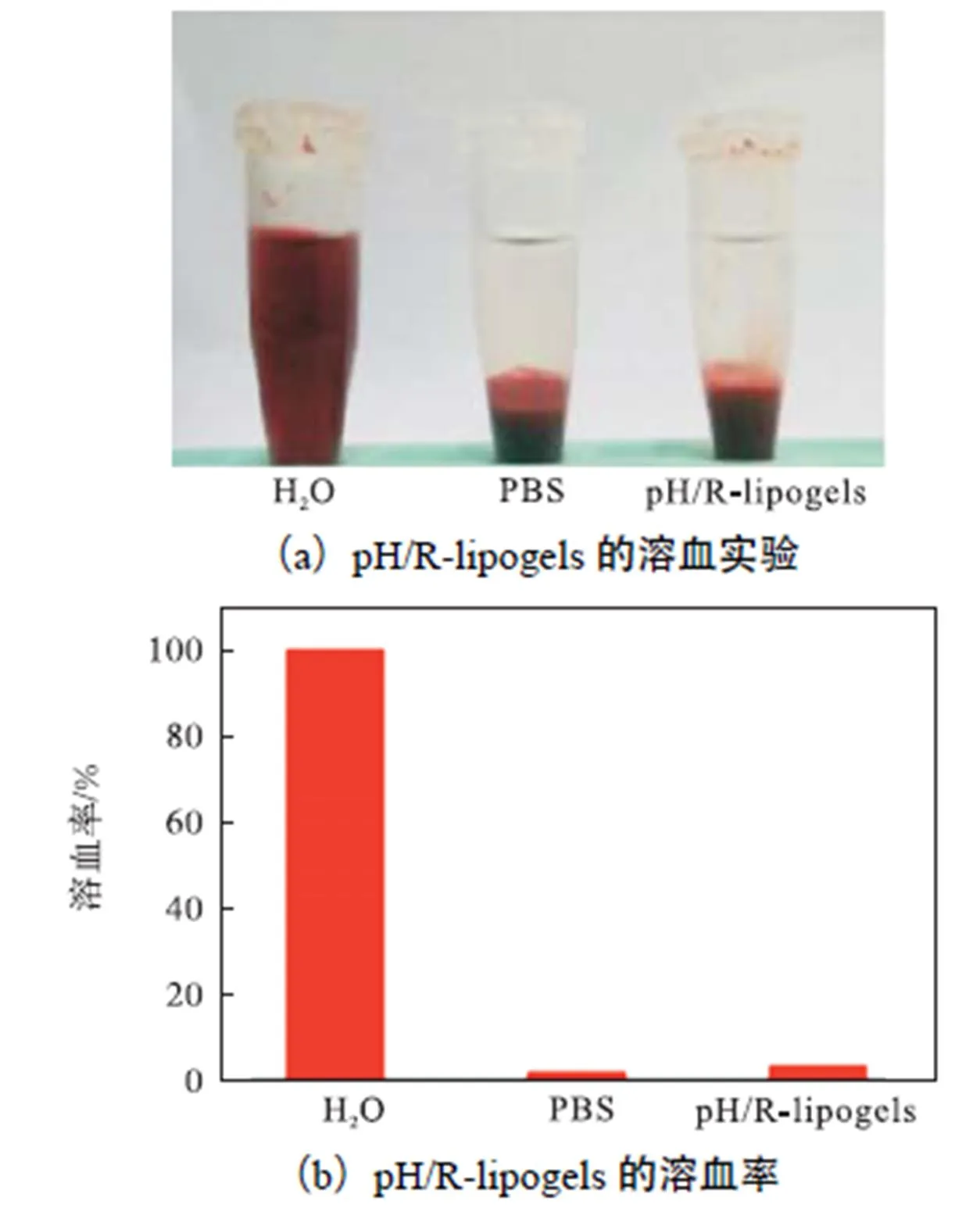
图6 pH/R-lipogels的溶血实验结果(水作为阳性对照,PBS作为阴性对照)
3 结 语
本文通过原位模板聚合方法成功制备出pH和还原双敏感脂质体纳米凝胶pH/R-lipogels,通过DLS和TEM对其粒径分布和形貌进行了表征,结果显示pH/R-lipogels粒径分布良好,形貌呈球形结构.结合主动载药技术,实现了载体对药物的高负载量.体外药物释放行为表明DOX@pH/R-lipogels能够快速响应pH和还原刺激并实现药物完全释放.通过体外细胞摄取实验数据可知,双敏感pH/R-lipogels载体相比单敏感(R-lipogels和pH-lipogels)载体和游离DOX可实现抗癌药物DOX在细胞中更多的分布.体外细胞毒性和溶血实验表明pH/R-lipogels有很好的生物安全性和相容性.以上结果说明pH/R-lipogels作为一种智能的药物递送载体具有十分广阔的应用前景.
[1] Yingchoncharoen P,Kalinowski D S,Richardson D R. Lipid-based drug delivery systems in cancer therapy:What is available and what is yet to come[J]. Pharmacological Reviews,2016,68(3):701-787.
[2] Hadinoto K,Sundaresan A,Cheow W S. Lipid-polymer hybrid nanoparticles as a new generation therapeutic delivery platform:A review[J]. European Journal of Pharmaceutics and Biopharmaceutics,2013,85(3):427-443.
[3] Al-Jamal W T,Kostarelos K. Liposomes:From a clinically established drug delivery system to a nanopar-ticle platform for theranostic nanomedicine[J]. Accounts of Chemical Research,2011,44(10):1094-1104.
[4] Yu Y,Zhang Z,Wang Y,et al. A new nir-triggered doxorubicin and photosensitizer indocyanine green co-delivery system for enhanced multidrug resistant cancer treatment through simultaneous chemo/photothermal/ photodynamic therapy[J]. Acta Biomaterials,2017,59:170-180.
[5] 马娜娜,余莉萍. 掺杂CdTe量子点的凝胶光子晶体制备[J]. 化学工业与工程,2018,35(1):51-55.
Ma Nana,Yu Liping. Prepara-tion of cdte quantum dot-immobilized hydrogel photonic crystal[J]. Chemical Industry & Engineering,2018,35(1):51-55(in Chinese).
[6] 高彤阳,管西栋,杨雨暄,等. D-葡萄糖酸酰胺类凝胶因子结构对其凝胶触变性能影响的研究[J]. 化学工业与工程,2017,34(6):24-30.
Gao Tongyang,Guan Xidong,Yang Yuxuan,et al. The influence of the D-gluconic amide gelators structure on the thixotropy of gel[J]. Chemical Industry & Engineering,2017,34(6):24-30(in Chinese).
[7] Zhan Y,Gonçalves M,Yi P,et al. Thermo/redox/ph-triple sensitive poly(n-isopropylacrylamide-co-acrylic acid)nanogels for anticancer drug delivery[J]. Journal of Materials Chemistry B:Materials for Biology and Medicine,2015,3(20):4221-4230.
[8] Kazakov S. Liposome-nanogel structures for future pharmaceutical applications:An updated review[J]. Current Pharmaceutical Design,2016,22(10):1391-1413.
[9] Camacho K M,Menegatti S,Vogus D R,et al. Dafodil:A novel liposome-encapsulated synergistic combination of doxorubicin and 5,FU for low dose chemotherapy[J]. Journal of Controlled Release,2016,229:154-162.
[10] Luo D,Carter K A,Razi A,et al. Doxorubicin encapsulated in stealth liposomes conferred with light-triggered drug release[J]. Biomaterials,2016,75:193-202.
[11] Tang W L,Chen W C,Roy A,et al. A simple and improved active loading method to efficiently encapsulate staurosporine into lipid-based nanoparticles for enhanced therapy of multidrug resistant cancer[J]. Pharmaceutical Research,2016,33(5):1104-1114.
[12] Zhang Y,Zhang J,Chen W,et al. Erythrocyte membrane-coated nanogel for combinatorial antiviru-lence and responsive antimicrobial delivery against staphylococcus aureus infection[J]. Journal of Con-trolled Release,2017,263:185-191.
(责任编辑:田 军)
Construction and Properties of Dual-Responsive Lipogels
Dong Anjie1, 2,Yu Lixia1,Ma Jinfeng1,Deng Liandong1,Zhang Jianhua1, 3
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China; 2. Collaborative Innovation Center of Chemical Science and Engineering(Tianjin),Tianjin 300072,China; 3. Tianjin Key Laboratory of Membrane Science and Desalination Technology, Tianjin University,Tianjin 300072,China)
As anticancer drugs are difficult to control and release precisely at tumor sites,a dual-responsive pH/R-lipogel carrier was designed and prepared in this study. The pH/R-lipogels comprising pH-sensitive liposome membranes and redox-sensitive 3D cross-linked network cores were constructed through in-situ template polymerization. The particle size distribution and morphology of pH/R-lipogels were studied by a laser particle sizer and transmission electron microscope. The results indicated the narrow size distribution and regular spherical structure of the pH/R-lipogels feature. The in vitro drug-release experiments showed that the doxorubicin hydrochloride pH/R-lipogels (DOX@pH/R-lipogels) can rapidly respond to changes in pH and GSH concentrations and improve the efficiency ofDOXrelease. The in vitro cell experiments showed that the DOX@pH/R-lipogels that is stimulated by the microenvironment of tumor cells can effectively release DOX and promote 4T1 cell apoptosis. These results indicate that the pH/R-lipogels have a remarkable potential in drug delivery systems and provide a foundation for the study of membrane materials.
liposome;nanogels;dual-responsive;drug delivery
10.11784/tdxbz201804011
R945
A
0493-2137(2019)03-0225-06
2018-04-04;
2018-04-27.
董岸杰(1964— ),女,博士,教授,ajdong@tju.edu.cn.
张建华,jhuazhang@tju.edu.cn.
国家自然科学基金资助项目(31470925,31671021,31470963);天津市应用基础与前沿技术研究计划资助项目(15JCQNJC03000).
the National Natural Science Foundation of China(No.31470925,No.31671021,No.31470963),the Tianjin Research Program of Application Foundation and Advanced Technology(No.15JCQNJC03000).

