MicroRNA-98通过下调EZH2表达抑制结直肠癌细胞的活力与侵袭能力*
张 娟, 冯 燕, 和水祥△
(1西安交通大学第一附属医院消化内科, 陕西 西安 710061; 2新疆维吾尔自治区人民医院消化内科, 新疆 乌鲁木齐 830001)
结直肠癌(colorectal cancer,CRC)是最常见的消化系统肿瘤之一,其发病率居恶性肿瘤第3位,死亡率居恶性肿瘤的第4位[1]。在我国,结直肠癌的死亡率和发病率呈逐年上升的趋势[2]。尽管结直肠癌的治疗方法已经有了很大的进步,但因影响其发生和侵袭的原因尚未研究清楚,其复发和转移仍十分常见。因此,探索结直肠癌的发病机制,寻找新的治疗靶点,在CRC的治疗中具有重要意义。Zeste基因增强子同源物2(enhancer ofZestehomolog 2,EZH2)基因是胚胎生长发育以及X染色体失活调节的重要基因之一[3]。研究表明,EZH2基因在包括结直肠癌的多种恶性肿瘤中呈现高表达,促进肿瘤的发生发展[4]。微小RNA(microRNA,miRNA, miR)是一类由18~25个核苷酸组成的非编码RNA,能够通过与目的基因mRNA的3’端非翻译区(3’-untranslated region,3’-UTR)碱基序列靶向互补结合,抑制或沉默靶基因的表达,从而参与到细胞的生长、分化、代谢和凋亡等生物学过程中[5]。关于miRNA的异常表达与结直肠癌的诊断、治疗及预后之间的关系已多有报道[6]。通过生物信息学软件预测出miR-98与EZH2之间可能存在靶向调节关系,并且已有研究表明miR-98在肺癌、食管癌和鼻咽癌等多种癌症中异常表达,参与肿瘤的发生发展[7-8]。最新的研究表明,miR-98在结肠癌组织中表达偏低,其表达与肿瘤恶性程度呈负相关[9]。本研究旨在探讨miR-98在结直肠癌中的作用,并通过上调和下调miR-98,了解其对人结直肠癌细胞系SW480和SW620活力和侵袭的影响,并探讨其可能的分子机制。
材 料 和 方 法
1 材料和试剂
胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司;Leibovitz’s L-15培养液购自HyClone;扩增引物购自上海吉玛公司;点突变试剂盒购自TaKaRa; LipofectamineTM3000购自Invitrogen; miR-98 mimic/inhibitor购自上海吉凯基因化学技术有限公司;I抗和 II 抗购自BD。
2 方法
2.1细胞培养 人结直肠癌细胞系SW480和SW620购于美国模式培养物保藏所(American Type Culture Collection,ATCC),细胞培养于混合10% FBS、1×105U/L青霉素和100 mg/L链霉素的Leibovitz’s L-15培养液中,置于37 ℃、 5% CO2培养箱中培养,细胞生长至90%融合状态后传代,取对数期生长状况良好的细胞进行后续实验。
2.2双萤光素酶报告基因实验 采用TargetScan软件(http://www.targetscan.org/vert_72/)预测出miR-98的靶向基因EZH2,双萤光素酶报告实验验证靶向关系。首先构建EZH2的野生型(wild type, WT)和突变型(mutant, Mut)表达质粒。实验所用引物由上海生工生物工程有限公司合成,野生型质粒的上游引物序列为5’-AAGTGAAGTGTGGTCCCTGG-3’,下游引物序列为5’-ATCATCTGGCTGGTTCTCCC-3’;突变型质粒的上游引物序列为5’-CATCTGCTACTTCCTAGAAA-3’,下游引物序列为5’-ATTATATAAAGGCGTGTTTGCTC-3’;扩增出与miR-98相结合的EZH2的3’-UTR片段。扩增产物经过纯化、酶切与连接过程导入双萤光素酶真核表达载体pmirGLO中,构建出野生型表达质粒。用点突变试剂盒扩增突变片段,随后构建EZH2突变型表达质粒。取生长良好的SW480细胞按每孔5×104的密度接种至24孔细胞培养板,孵育24 h后,用LipofectamineTM3000将EZH2 WT或EZH2 Mut表达质粒与miR-98 mimic或mimic control一起共转染SW480细胞。转染24 h后加入萤光素酶检测试剂,测定萤火虫萤光素酶的活性,随后加入Stop&Glo试剂测定海肾萤光素酶的活性,相对萤光素酶活性以萤火虫萤光素酶与海肾萤光素酶活性之比表示。
2.3实验分组 实验分为正常对照(control)组(正常培养的结直肠癌SW480细胞和SW620细胞)、miR-98 mimic组(结直肠癌细胞转染miR-98过表达试剂miR-98 mimic)、mimic control组(结直肠癌细胞转染mimic control)、miR-98 inhibitor组(结直肠癌细胞转染miR-98抑制试剂miR-98 inhibitor)和inhibitor control组(结直肠癌细胞转染inhibitor control)。细胞经处理后培养48 h进行后续检测。
2.4RT-qPCR法检测miR-98表达的变化 采用常规的TRIzol法提取结肠癌细胞的总RNA,反转录后用SYBR Green进行RT-qPCR。反应体系为SYBR Green Mix 9 μL、反转录产物2 μL、forward primer 2 μL和reverse primier 2 μL,加水至总体积20 μL。反应参数为:95 ℃ 20 s; 95 ℃ 10 s、60 ℃ 20 s、72 ℃ 10 s, 35个循环;72 ℃延伸1 min。以U6 snRNA为内参照。miR-98的上游引物序列为5’-GGGGTGAGGTAGTAAGTTGT-3’,下游引物序列为5’ -TGCGTGTCGTGGAGTC-3’;U6上游引物序列为5’- GCGCGTCGTGAA GCGTTC-3’,下游引物序列为5’- GTGCAGGGTCCGAGGT-3’。实验结果miR-98和U6产物倍数按2-ΔΔCt计算。
2.5MTT法检测细胞活力 细胞分组处理后用MTT法检测其细胞活力。各组细胞以每孔6×104个接种于96孔板,并且每组细胞设置3个复孔,继续培养24 h。弃去原培养液后每孔加入MTT(5 g/L)20 μL,置于37 ℃培养4 h。弃去上清,每孔加入150 μL二甲基亚砜(DMSO),振荡10 min使结晶充分溶解,使用酶标仪上检测各组细胞490 nm波长的吸光度(A490值),并计算细胞活力,细胞活力(%)=处理组A490值/对照组A490值×100%。
2.6Transwell法检测细胞的侵袭能力 在膜孔径为8 μm的24孔Transwell上室聚碳酸酯膜上涂抹Matrigel(70 μL,1 g/L),静置于37 ℃下60 min致使胶体在微孔滤膜上重组成为基底膜。用胰酶消化待测细胞,将收集到的细胞悬液用1 000 r/min离心8 min。弃去上清后,用不含FBS的M199培养液将细胞重悬, 取1×108/L的细胞悬液200 μL接种于Transwell上室内,并在下室中加入含有20%胎牛血清的M199培养液500 μL,37 ℃、5% CO2培养24 h。随后将滤膜上层的细胞用棉签抹去,用甲醇固定滤膜,Giemsa染色15 min。于200倍光镜下选择膜左、右、上、中、下5个视野用细胞计数板计算侵袭到下层的细胞数量。
2.7Western blot检测EZH2的蛋白表达 收集各组细胞,加入0.25%胰蛋白酶消化后,用PBS缓冲液清洗细胞3次;加入65 μL RIPA细胞蛋白裂解液,SDS-PAGE分离蛋白;电泳结束后转膜,再用5%脱脂奶粉室温封闭1 h,加入稀释1 000倍的鼠抗人EZH2和GAPDH的I 抗,4 ℃轻摇过夜,加入稀释5 000倍的HRP标记的羊抗鼠 II 抗,室温孵育1 h。X线片曝光分析,结果用Image-Pro Plus处理,以目的蛋白与内参照β-actin的灰度值比值表示蛋白的相对表达量。
2.8EZH2表达载体的构建 提取SW480细胞总RNA进行反转录。以反转录产物cDNA为模板,PCR扩增。PCR条件为:95 ℃ 5 min; 95℃ 30 s、59℃ 30 s、72℃ 30 s,30个循环;最后在72 ℃下延伸5 min。扩增EZH2的引物由上海生工生物工程有限公司合成,上游引物序列为5’-AGAGGTACCGGACGAAGAATAATCATGG-3’,下游引物序列为5’-TAGCTCGAGGGTAGCAGATGTAAGG-3’。在上、下游分别引入EcoR I与KpnI的酶切位点及保护性碱基。用EcoR I和KpnI双酶切PCR扩增得到的目的基因以及质粒载体pcDNA3.1,分别收集目的片段后使用T4连接酶进行连接,构建重组pcDNA3.1- EZH2质粒,并进行酶切鉴定和送至上海生工生物工程有限公司进行测序鉴定。
3 统计学处理
采用SPSS 17.0软件,所有数据以均数±标准差(mean±SD)表示。实验数据用单因素方差分析进行统计学分析。以P<0.05为差异有统计学意义。
结 果
1 miR-98在SW480细胞中靶向调节EZH2
TargetScan软件预测出miR-98的靶向基因EZH2。在SW480细胞中进行双萤光素酶报告基因实验检测miR-98和EZH2之间的靶向关系,结果显示,萤光素酶活性在miR-98 mimic和野生型EZH2表达质粒共转染组中显著降低(P<0.05),见图1。

Figure 1.miR-98 targeted EZH2 in SW480 cells. Mean±SD.n=3.*P<0.05vsother groups.
图1miR-98在SW480细胞中靶向调节EZH2
2 miR-98影响SW480和SW620细胞中EZH2的表达
为了证明在结直肠癌细胞中miR-98和EZH2之间的靶向关系,我们检测了过表达和抑制miR-98对SW480细胞和SW620细胞中EZH2表达的影响。与control组相比,miR-98的表达在miR-98 mimic组中显著升高,在miR-98 inhibitor组中明显降低(P<0.05),说明miR-98 mimic和miR-98 inhibitor成功转染到肿瘤细胞中。Western blot结果表明,与control组相比,EZH2蛋白的表达在miR-98 mimic组显著降低,在miR-98 inhibitor组中升高(P<0.05),见图2。
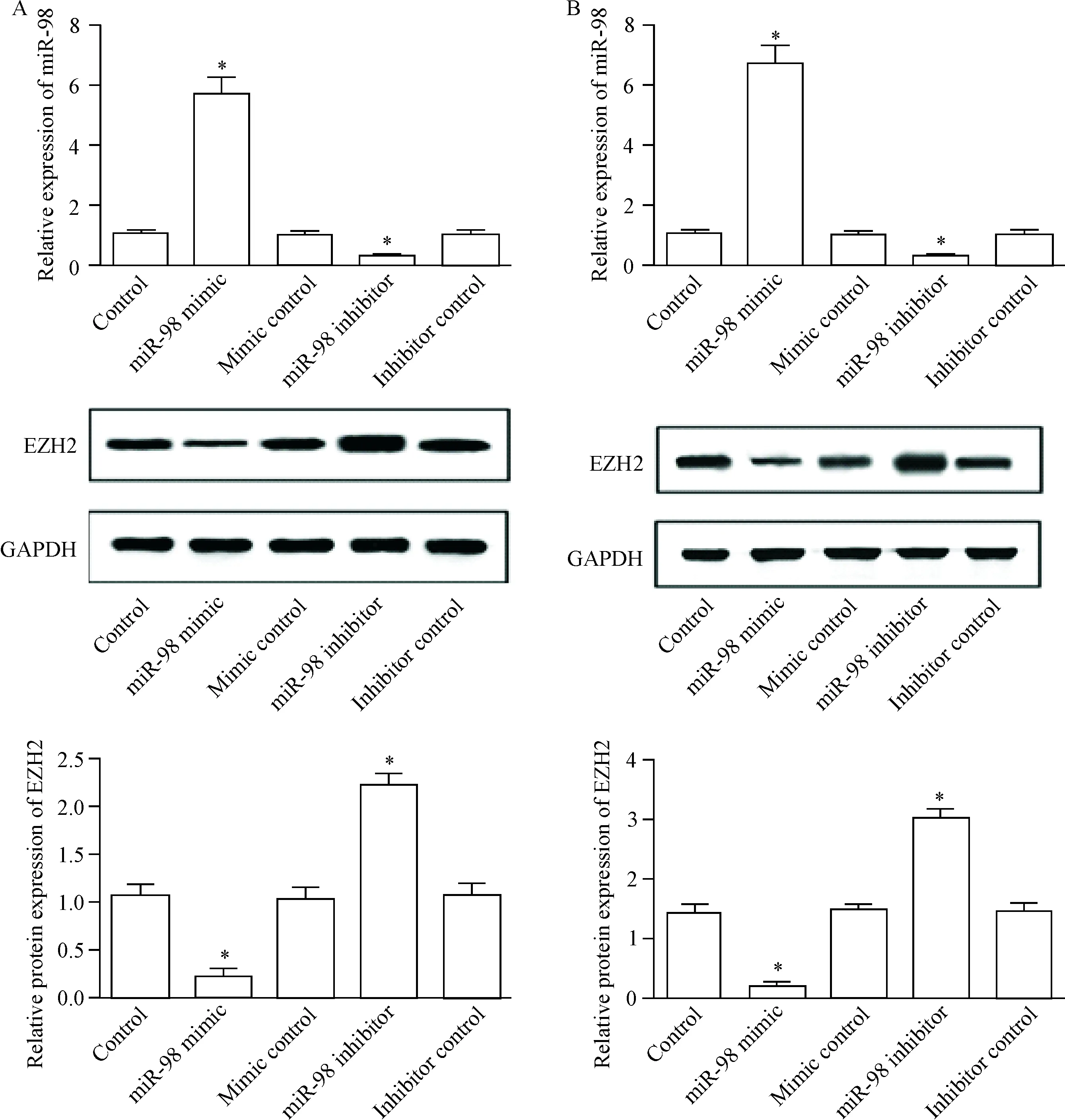
Figure 2.The effect of miR-98 on EZH2 expression in the SW480 cells (A) and SW620 cells (B). Mean±SD.n=3.*P<0.05vscontrol group.
图2miR-98对SW480细胞和SW620细胞中EZH2表达的影响
3 miR-98影响SW480和SW620细胞的活力
MTT法实验结果显示,在2种结直肠癌细胞系中,与control组相比,miR-98 mimic显著抑制细胞的活力,miR-98 inhibitor明显促进细胞的活力(P<0.05),见图3。
4 miR-98影响SW480细胞和SW620细胞的侵袭能力
Transwell实验检测SW480细胞和SW620细胞的侵袭能力,结果显示,与control组相比,过表达miR-98使细胞的侵袭能力明显降低,而抑制miR-98使细胞的侵袭能力显著增高(P<0.05),见图4。
5 EZH2过表达可上调SW480细胞和SW620细胞的活力和侵袭能力
为了进一步证明miR-98和EZH2之间的调控关系,我们构建了EZH2过表达质粒,与miR-98 mimic共转染SW480细胞和SW620细胞,结果显示,与miR-98 mimic组相比,EZH2的蛋白表达在miR-98 mimic+pcDNA3.1-EZH2组中显著升高(P<0.05),表明EZH2过表达质粒的构建和转染成功,见图5A。MTT实验和Transwell实验分别检测细胞活力和侵袭能力,结果表明,与miR-98单独转染组相比,EZH2的过表达质粒共转染显著增强SW480细胞和SW620细胞的活力和侵袭能力(P<0.05),见图5B、C。
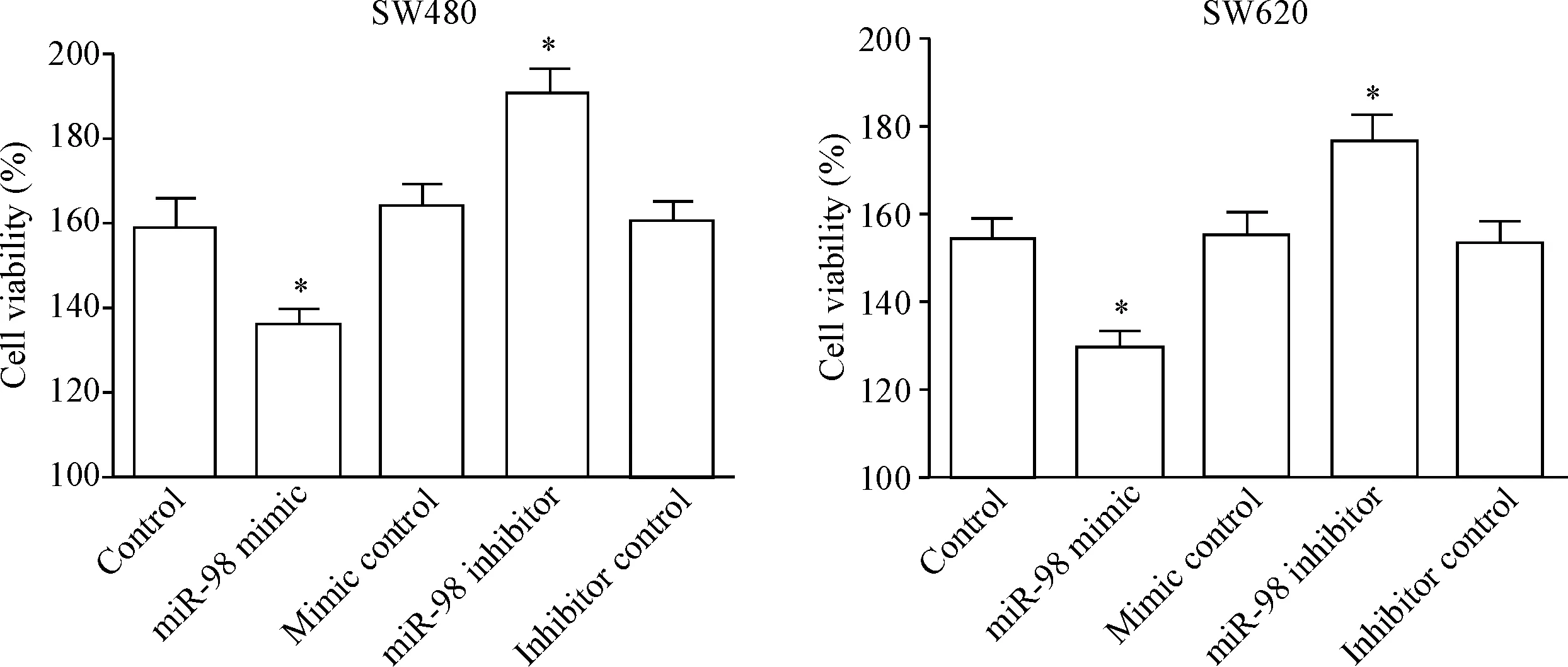
Figure 3.The effect of miR-98 on the viability of SW480 cells and SW620 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3miR-98对SW480细胞和SW620细胞活力的影响

Figure 4.The effect of miR-98 on the invasion ability of SW480 cells and SW620 cells (×200). Mean±SD.n=3.*P<0.05vscontrol group.
图4miR-98影响SW480和SW620细胞的侵袭
讨 论
EZH2基因位于人染色体的7q35区,是PcG(Polycomb Group)家族中的PRC2复合物的核心组成部分[10]。EZH2可以通过调节染色体组蛋白的甲基化水平抑制下游基因的表达,调节细胞生理机能[11]。研究发现,EZH2高表达的细胞侵袭和增殖能力较强,此现象在多种人类肿瘤细胞中得到证实[12]。已有研究表明,EZH2在结直肠癌细胞中高表达,并且其表达与癌症的组织学分化程度、淋巴结转移以及TNM分期相关[13]。另有报导指出EZH2不仅影响结肠癌细胞的生长、侵袭、代谢等,而且对细胞的耐药性生成也有影响,可见EZH2作为促癌基因在结直肠癌中发挥重要作用[14]。
EZH2在肿瘤细胞中异常高表达的原因尚未清楚,但前期在多种疾病中的研究已表明miRNA是一个重要的调控因素。miRNA是机体内一种位于基因组非编码区的内源性小分子RNA,广泛存在于各类真核细胞中,其本身并不具有开放阅读框无法进行蛋白翻译,但可以通过和靶基因进行特异的碱基配对引起靶基因mRNA的翻译抑制或者降解,从而在转录后水平调控基因的表达,进而影响蛋白的合成,参与到机体代谢、个体发育以及肿瘤的发生发展等生物进程中[15]。本研究通过TargetScan软件预测得出miR-98可能与EZH2之间存在靶向调节关系。研究表明miR-98能够参与多种疾病的调节。Bi等[16]报道miR-98通过调节Col1A1基因表达抑制增生性瘢痕细胞的生长;Cheng等[17]阐明miR-98通过抑制TGFBR1的表达减弱心肌成纤维细胞的分化,另外miR-98在心肌炎的调控中也起着重要作用[18]。可见miR-98可以通过调控不同的靶基因影响各类疾病的进程。本研究结果表明萤光素酶活性在miR-98和EZH2野生型双萤光素酶表达质粒的共转染组中显著降低,证实了miR-98和EZH2之间的靶向调节关系。并且miR-98的过表达显著降低,同时miR-98的抑制显著提升EZH2蛋白在结直肠癌细胞SW480和SW620中的表达,说明miR-98有可能通过靶向EZH2参与结直肠癌疾病的调节。

Figure 5.EZH2 over-expression increased the viability and invasion ability of SW480 cells and SW620 cells. A: the protein level of EZH2 was detected by Western blot; B: the cell viability was detected by MTT assay; C: the invasion ability of SW480 and SW620 cells was detected by Transwell assay (×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmiR-98 mimic group.
图5EZH2过表达上调SW480和SW620细胞活力和侵袭能力
miR-98在多种肿瘤中均表现为低表达,参与肿瘤调节。Tan等[19]发现,miR-98通过调节MTDH基因抑制头颈部鳞状细胞癌细胞的生长、侵袭和迁移。Huang等[20]报道miR-98通过调节E2F1降低白血病细胞的化疗药物耐药性。另有研究者阐明miR-98通过调节IKBKE/NF-κB通路增加神经胶质瘤细胞凋亡,抑制肿瘤发展。最新研究表明miR-98在结肠癌患者的癌组织中低表达,并且在结直肠癌细胞系SW480和HCT116中的研究表明,miR-98可以通过调节HK2基因抑制癌细胞的Warburg效应[9]。因为EZH2与细胞生长和侵袭之间具有紧密的联系,本文检测了miR-98对结直肠癌细胞SW480和SW620生长和侵袭的影响。研究结果表明过表达miR-98降低结直肠癌细胞的生长和侵袭,而抑制miR-98表达提升癌细胞的生长和侵袭能力,说明miR-98在结直肠癌中发挥了抑癌作用,与前人的结果一致。最后通过EZH2过表达实验,我们验证了miR-98对结直肠癌细胞生长和侵袭的调节作用是通过靶向抑制EZH2表达产生的。
综上所述,本研究表明miR-98对结直肠癌细胞SW480和SW620的生长和侵袭有抑制作用,且其作用是通过靶向调节EZH2产生的。这为理解结直肠癌的分子机制提供了新的理论基础,并对疾病的治疗提供了新的靶点。
——一道江苏高考题的奥秘解读和拓展

