不同机械增氧模式对池塘水质及施氏鲟生长和代谢的影响
倪蒙 迟美丽 李吉方

摘要:以池塘养殖施氏鲟[体质量为(580.8±36.5) g]为研究对象,研究流水池塘不同机械增氧模式对施氏鲟池塘水质、生长、摄食和血液生理生化指标的影响。结果显示,水车式增氧机组溶解氧含量显著高于气石组,温度显著低于气石组,pH值在试验后期无显著差异,试验后期气石组氨氮和COD(化学需氧量)显著高于水车式增氧机组。水车式增氧机组施氏鲟最终体质量、特定生长率、增质量率等均显著高于气石组,肥满度和肝脏系数也显著高于气石组,而死亡率显著高于气石组。水车式增氧机组尿素含量显著高于气石组,而血糖和总蛋白含量显著低于气石组。白蛋白、甘油三酯、胆固醇、直接胆红素含量与谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)活性在各组之间无显著差异。因此可见,水车式增氧机组显示出了较高的生长性能和高福利指标。
关键词:施氏鲟;增氧;溶解氧;生理生化指标;水质;生长;代谢
中图分类号:S964.3 文献标志码: A 文章编号:1002-1302(2019)22-0216-04
鲟鱼隶属于硬骨鱼纲辐鳍亚纲鲟形目(Acipenseri formes),最早可追溯到侏罗纪时代(1.5×108~2.0×108年前)[1]。世界上现存的鲟鱼类有2科6属27种,濒危野生動植物种国际贸易公约组织CITES将全世界所有野生鲟鱼种类都列为濒危物种[2]。鲟鱼具有极高的生物学价值(进化学、形态学、地理学)和经济价值[3]。施氏鲟(Acipenser schrenckii)主要分布于黑龙江流域,是我国仅有的几种能够形成自然捕捞量的鲟鱼种类之一[4]。近年来,随着人工养殖技术的不断完善,施氏鲟已成为我国主要的鲟鱼养殖种类[5]。
溶解氧是养殖动物生存和生长的重要影响因子,对于水中溶解氧的研究国内外已经有大量报道。Jrgensen等的研究结果显示,氧饱和度与圆鳍鱼(Cyclopterus lumpus)的生长和健康状况呈负相关[6];在罗非鱼(Oreochromis niloticus)中,低溶解氧可显著影响罗非鱼的正常生长、呼吸和肠道健康[7];在虹鳟(Oncorhynchus mykiss)中,随着溶解氧含量的升高,蛋白酶活力、淀粉酶活力及消化吸收率出现升高的趋势[8]。因此,养殖过程中水体中的溶解氧是决定养殖成败的关键因素。随着水产养殖技术的不断发展和高密度养殖的不断加强,单纯的流水增氧已不能满足养殖生产的需要。各式各样的增氧设备不断出现,目前最常见的增氧模式主要包括气石增氧和水车式增氧机增氧,少量使用推流吸气式增氧机增氧、涌浪式增氧机增氧和叶轮式增氧机增氧等[9]。为了评价工厂化养殖过程中主要增氧模式的性能优劣,本研究以流水池塘中养殖的施氏鲟为研究对象,通过比较养殖水体水质指标、施氏鲟生长和血液生理生化指标等的变化,进而比较气石增氧和水车式增氧机增氧这2种机械增氧模式的增氧效果。
1 材料与方法
1.1 试验用鱼及条件
试验于2013年在山东省鲟龙渔业科技开发有限公司进行,施氏鲟养殖于流水水泥池塘,所有试验鱼由同一批次的受精卵孵化而来,规格基本一致,平均初始体质量为(580.8±36.5) g。试验池为6个正方形室外水泥池,水池规格为 10.0 m×10.0 m×1.5 m,试验水深设置为1.0 m,每个水泥池有2个进水口,中央排污口排污。试验用水为经曝气后的地下水,水温为16~19 ℃,溶解氧(DO)含量大于8.5 mg/L,pH值为7.5~8.0。
1.2 试验设计
试验设2种不同的增氧模式:气石增氧(A组)和水车式增氧机增氧(B组),2种增氧模式采用相同功率(1.5 kW)。施氏鲟放养密度为10 kg/m3,每个处理设3个平行。施氏鲟在试验前暂养7 d,不投喂饲料,之后正常投喂和测定各项指标,试验共50 d。
1.3 饲料及日常管理
整个试验期间根据试验鱼规格投喂宁波天邦股份有限公司生产的鲟鱼配合饲料。饲料成分:粗蛋白≥42.0,粗纤维≤5.0%,粗灰分≤18.0%,水分≤12.0%,钙≥1.5%,总磷≥1.2%,食盐≤3.0%,赖氨酸≥2.2%。每天投喂3次,投喂时间为08:00、16:00、23:00,记录投料、剩料及观察摄食情况。试验期间,在池塘入水口和出水口附近,每天采用HACH便携式溶解氧数字化分析仪测定养殖水体的温度、DO、pH值。每隔10 d测1次养殖水体的氨氮(NH+4-N,纳氏试剂法)和化学需氧量(COD,酸性高锰酸钾法),并对试验鱼进行采样测量,随机从每个池子中取100尾鱼,捞出后立即将鱼放入200 mg/L MS-222中快速麻醉,随后称量体质量,并随机选择10尾鱼解剖后称量肝脏质量和脾脏质量。试验结束时,每池随机取100尾施氏鲟测量体长和体质量,另外随机选择4尾施氏鲟,迅速麻醉后采集血液样本。
1.4 生长与摄食
试验结束时,分别测定施氏鲟体长(L)、体质量(m),并统计投饵量。相应的计算公式如下:
净增质量=(m2-m1)/m1×100%;
特定生长率(SGR)=100(lnm2-lnm1)/(t2-t1);
肥满度(K)=m/L3×100%;
饵料系数=mF/(m2-m1);
肝脏系数=mL/m;
脾脏系数=mS/m。
式中:m为体质量(g),L为体长(cm),m1、m2为时间t1、t2时的体质量(g),mF为时间t2-t1内的总投饵量,mL为肝脏质量,mS为脾脏质量。
1.5 血液生理生化指标
试验结束时,从每个试验池中随机取4尾鱼,捞出后立即将鱼放入200 mg/L MS-222中快速麻醉,尾静脉采血约 2 mL 放于4 ℃静置4~8 h,3 000 r/min离心10 min,于 -20 ℃ 保存用于进行血液生化指标的测定,使用的仪器为迈瑞BS180全自动血液生化分析仪。
1.6 数据统计分析
使用SPSS统计分析软件进行检验分析,P<0.05为有显著差异。所得数据均用平均值±标准误表示。
2 结果与分析
2.1 水质条件
由图1-a可知,养殖过程中水体pH值为7.83~8.06,试验30 d之前,气石组的pH值显著低于水车式增氧机组(P<0.05)。试验后期,各组之间无显著差异。水温随着时间的推移不断下降,试验前期(30 d之前)各处理组之间无显著差异,试验后期气石组的温度高于水车式增氧机组(P<0.05,图 1-b)。在整个试验过程中,水车式增氧机组的溶解氧显著高于气石组(P<0.05,图1-c)。
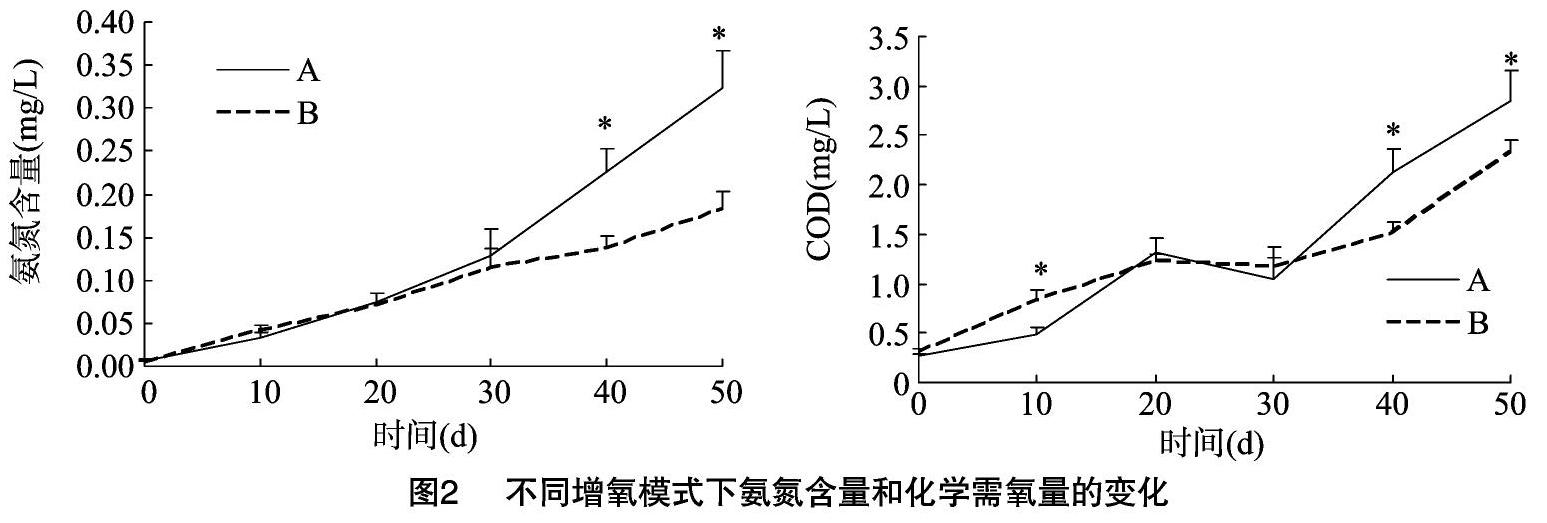
由图2可知养殖过程中养殖水体的氨氮含量和化学需氧量的变化:氨氮随时间增加而逐渐增加,试验40~50 d,气石组氨氮含量显著高于水车式增氧机组(P<0.05)。与氨氮含量变化情况相一致,化学需氧量大致随时间变化逐渐升高,但都处在相对较低的范围之内(最高COD出现在50 d气石组,为2.85 mg/L)。其中,试验40~50 d,气石组COD显著高于水车式增氧机组(P<0.05)。
2.2 生长和摄食
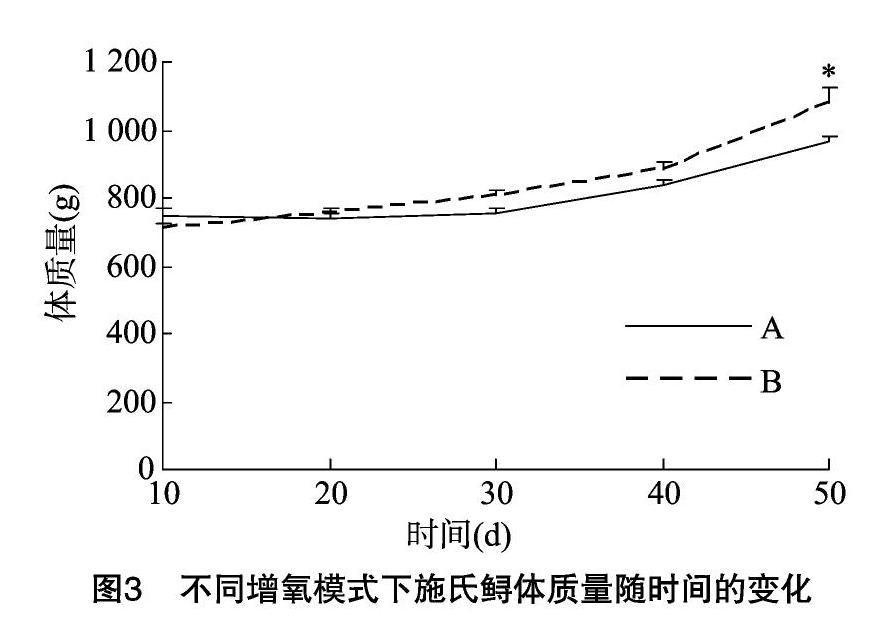
不同增氧模式下的生长和摄食情况见图3,可以看出,在初始体质量相一致的情况下,不同充氣模式显著影响了施氏鲟的生长情况,在试验结束时,水车式增氧机组的体质量显著高于气石组(P<0.05)。其次,由表1可知,水车式增氧机组的最终体质量显著高于气石组(P<0.05),特定生长率和增质量率也表现出与最终体质量相似的趋势(P<0.05),而水车式增氧机组的死亡率显著高于气石组(P<0.05)。肥满度是反映鱼类肥瘦程度和生长情况的指标,本研究中水车式增氧机组的肥满度也显著高于气石组(P<0.05)。饵料系数在2种增氧模式间无显著差异。
2.3 脏器系数
由图4、图5可知不同模式下施氏鲟脾脏系数和肝脏系数随时间的变化。试验初始阶段,水车式增氧机组的脾脏系数显著升高,后期逐渐下降到起始水平,而气石组的脾脏系数维持在一个比较稳定的范围内。肝脏系数都随着时间的推移逐渐增加,但在试验前期水车式增氧机组的肝脏系数增长较慢,到后期迅速增加,并且显著高于气石组(P<0.05)。
2.4 血液生理生化指标
由表2可知不同模式下施氏鲟血液生理生化指标的变化。水车式增氧机组尿素含量显著高于气石组(P<0.05),而总蛋白和血糖含量显著低于气石组(P<0.05)。白蛋白、甘油三酯、胆固醇和直接胆红素含量在各组之间无显著差异。水车式增氧机组谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)活性高于气石组,但无显著差异。
3 讨论
养殖池水的温度变化受季节影响比较大,从试验起始的20.3 ℃下降至结束时的9.6 ℃。在试验过程中,2种不同的增氧模式的溶解氧虽有差异,但都维持在一个较高的水平(>6 mg/L)[10],可以保证鲟鱼的正常生长发育。试验30 d之前,水车式增氧机组的pH值显著高于气石组,这与水车式增氧机组高的溶解氧水平相一致。氨、氮是反映水体污染情况的重要指标之一,能直接损害养殖动物的鳃组织,严重影响养殖动物的免疫、呼吸等生理代谢功能,最终抑制其生长和存活[11]。化学需氧量也是指示水体有机污染的一项重要指标,能够反映水体的污染程度。本研究后期,水车式增氧机组氨氮含量和COD都显著低于气石组,表明水车式增氧机组水质污染相对较轻,更适合施氏鲟健康养殖,这可能是由于水车式增氧机水体搅动效果好,利于污染物排出。
脾脏是鱼类红细胞、淋巴细胞和粒性白细胞生产、贮存和成熟的主要场所,是鱼类主要的免疫器官[12]。试验后期脾脏系数在不同增氧模式间无显著差异,表明不同增氧模式对脾脏未造成损伤。肝脏系数常常被用作动物能量状态的间接指示[13]。肝脏的主要功能是消化吸收和储存脂肪等,鱼类在面对不利的环境条件时,其肝脏系数会发生变化[14],这与本研究结果一致,即水车式增氧机组肝脏系数逐渐升高,并在试验结束时显著高于气石组。这可能由于鱼体内储藏的脂肪被分解利用以抵抗不良的环境条件。肥满度也常被用来比较鱼的生长状况,较高的肥满度反映了鱼类处于一个较好的环境条件中。本研究结果显示,试验结束时水车式增氧机组鱼体的肥满度显著高于气石组,表明试验后期水车式增氧机组具有相对更好的生长情况。
外界环境压力会导致鱼的稳态被破坏,从而影响鱼类的生长和免疫等功能,进而导致鱼体发病和福利的降低[15-16]。生长指标能够最直接地反映鱼类的福利变化。本研究中在不同处理组之间鱼的生长情况存在显著差异。水车式增氧机组的最终体质量、增质量和特定生长率都显著高于气石充气组。虽然2个组均显示出较低的死亡率(<5%),但水车式增氧机组死亡率却显著高于气石组,推测可能是由于水车式增氧机组造成池塘中局部缺氧所致。
血糖对于维持鱼体正常活动具有重要意义,本研究中气石组血糖显著高于水车式增氧机组,可能是由于气石组相对较低的溶解氧浓度导致鱼体产生应激反应,而气石组较低的总蛋白含量可能与应激状态下施氏鲟通过增加特异性蛋白质,如溶菌酶和补体等来应对外界不良环境有关[17]。尿素含量反映的是鳃组织机能[18],但意外的是水车式增氧机组具有更高的尿素含量,可能由于水车式增氧机增氧模式覆盖范围较小,引起局部缺氧,导致施氏鲟鳃组织机能下降。血清中酶的含量是反映机体代谢状况的重要标志[19],本研究中气石组谷丙转氨酶、谷草转氨酶和碱性磷酸酶活性都高于水车式增氧机组,但均无显著差异,可能是由于在现有养殖时间范围内,气石组水质状况对施氏鲟产生了一定的影响,但对机体的损伤程度不大。
总体来讲,相对于气石组,水车式增氧机组由于能够产生更高的氧气浓度,显示出较高的生长性能和高福利指标。但由于水车式增氧机覆盖范围较小,尤其是对于底层水搅动能力有限,导致池内溶解氧分布不均,可能是导致死亡率偏高的原因。因此养殖过程中,可根据池塘大小和深度增加水车式增氧机数量,或通过2种增氧模式结合的方法提高养殖效益,降低养殖成本。
参考文献:
[1]Doroshov S I,Cech J J. Sturgeon physiology of sturgeon[J]. Encyclopedia of Fish Physiology,2011,1(1):1800-1806.
[2]Ludwig A. Identification of acipenseriformes species in trade[J]. Journal of Applied Ichthyology,2008,24(1):2-19.
[3]Hung S O. Recent advances in sturgeon nutrition[J]. Animal Nutrition,2017,3(3):191-204.
[4]石振廣,王云山,李文龙. 鲟鱼与鲟鱼养殖[M]. 哈尔滨:黑龙江科技出版社,2000:1-80.
[5]孙大江,曲秋芝,吴文化,等. 施氏鲟人工繁殖及养殖技术[M]. 北京:海洋出版社,2000:12-16.
[6]Jrgensen E H,Haatuft A,Puvanendran V A. Effects of reduced water exchange rate and oxygen saturation on growth and stress indicators of juvenile lumpfish (Cyclopterus lumpus L.) in aquaculture[J]. Aquaculture,2017,474(1):26-33.
[7]Tran-Ngoc K T,Dinh N T,Nguyen T H,et al. Interaction between dissolved oxygen concentration and diet composition on growth,digestibility and intestinal health of nile tilapia (Oreochromis niloticus)[J]. Aquaculture,2016,462(1):101-108.
[8]吴 垠,张 洪,赵慧慧,等. 在循环养殖系统中不同溶氧量对虹鳟幼鱼代谢水平的影响[J]. 上海水产大学学报,2007,16(5):437-442.
[9]胡伯成. 工厂化养鱼的增氧方式浅谈[J]. 北京水产,2005(4):29-31.
[10]赵燕静,狄桂兰,孔祥会,等. 低氧环境下poly Ⅰ:C刺激对淇河鲫肝胰脏抗氧化防护的影响[J]. 水产学报,2016,40(12):1830-1841.
[11]Yue F,Pan L Q,Xie P,et al. Immune responses and expression of immune-related genes in swimming crab Portunus trituberculatus exposed to elevated ambient ammonia-N stress[J]. Comparative Biochemistry and Physiology A-molecular & Integrative Physiology,2010,157(3):246-251.
[12]赵燕静,武向敏,蒋昕彧,等. 淇河鲫不同组织器官溶菌酶与抑菌活性比较[J]. 水生态学杂志,2014,35(1):87-90.
[13]孙婷婷. 温度和CO2驯养对南极鱼P. brachycephalum肝指数(HSI)和Fultons K肥满度的影响[J]. 现代农业科技,2010(24):310-311.
[14]赵亚婷,吴旭干,常国亮,等. 饲料中DHA含量对中华绒螯蟹幼蟹生长、脂类组成和低氧胁迫的影响[J]. 水生生物学报,2013,37(6):1133-1144.
[15]Korte S M,Koolhaas J M,Wingfield J C,et al. The darwinian concept of stress:benefits of allostasis and costs of allostatic load and the trade-offs in health and disease[J]. Neuroscience & Biobehavioral Reviews,2005,29(1):3-38.
[16]Mcewen B S,Wingfield J C. The concept of allostasis in biology and biomedicine[J]. Hormones & Behavior,2003,43(1):2-15.
[17]Ming J H,Xie J,Xu P,et al. Effects of emodin and vitamin C on growth performance,biochemical parameters and two HSP70s mRNA expression of Wuchang bream (Megalobrama amblycephala Yih) under high temperature stress[J]. Fish & Shellfish Immunology,2012,32(5):651-661.
[18]Burtis C A,Ashwood E R. Fundamentals of clinical chemistry[J]. Enzymes,2001,4:312-335.
[19]冀德伟,李明云,王天柱,等. 不同低温胁迫时间对大黄鱼血清生化指标的影响[J]. 水产科学,2009,28(1):1-4.

