萝卜与芸薹属远缘杂交不亲和性克服及DNA甲基化的研究进展
郭晓灿 韩佳慧 童未名
摘要:通过远缘杂交可以获得种内杂交难以得到的变异类型,创造许多新的种质资源,为品种改良提供原材料。从20世纪20年代开始,人们就已经开展了萝卜属与芸薹属植物远缘杂交的研究,并有不少属间杂交成功的报道。本文综述了当前萝卜与芸薹属属间不亲和性的机制,总结了不亲和性的克服方法,并概括了不同属间远缘杂种的育性和DNA甲基化的研究进展,以期为今后萝卜与芸薹属蔬菜品种的遗传育种工作提供参考。
关键词:萝卜;芸薹属;远缘杂交;不亲和性;DNA甲基化;研究进展;表观遗传
中图分类号: S631.103.2 文献标志码: A 文章编号:1002-1302(2019)22-0012-06
萝卜(Raphanus sativus L.)是我国主要的蔬菜作物之一,为十字花科萝卜属一、二年生草本植物,其肉质根营养丰富,且萝卜的栽培地区广,品种类型多[1]。芸薹属(Brassica)植物种类繁多,用途广泛,具有遗传类型丰富、变异广泛的基因库。芸薹属植物的远缘杂交不仅涉及该属内的种间杂交,而且涉及与邻近属物种进行的属间杂交。Karpechenko首先进行了萝卜与甘蓝的远缘杂交,并获得高度不育的远缘杂种F1代[2]。此外,王明霞的研究表明,萝卜属与芸薹属的遗传相似水平较高,而且通过远缘杂交可以将萝卜属的抗虫能力[3],如抗根结线虫、孢囊线虫[4]和雄性不育系[5]、抗根肿病[6-7]等特异性状导入芸薹属作物中,能够实现作物之间优异性状的转移,创造蔬菜新品种和新类型。然而,在进行种间或属间杂交时,如果采用常规的杂交技术,成功率往往很低。人们通过混合花粉和多次重复授粉、柱头移植、剪短法和化学药剂的使用等方法来克服受精前的障碍,但受精后,在胚胎的發育过程中,由于胚乳得不到正常发育的营养,导致胚的死亡[8]。在1959年研究者首先用幼胚培养的方法获得了芸薹属内的种间杂种,之后许多学者采用组织培养技术使种间、属间杂交的结实率和杂种的获得频率得到了提高。
远缘杂交在创造新种质、杂种优势利用和品种改良等应用领域具有重要的现实意义,在物种的起源、演化和遗传变异研究方面也发挥着重要的指导作用。本文就萝卜与芸薹属间的远缘杂交不亲和性、异源多倍体的获得及远缘杂种的鉴定等研究进展进行综述。
1 萝卜与芸薹属远缘杂交不亲和性的影响因素
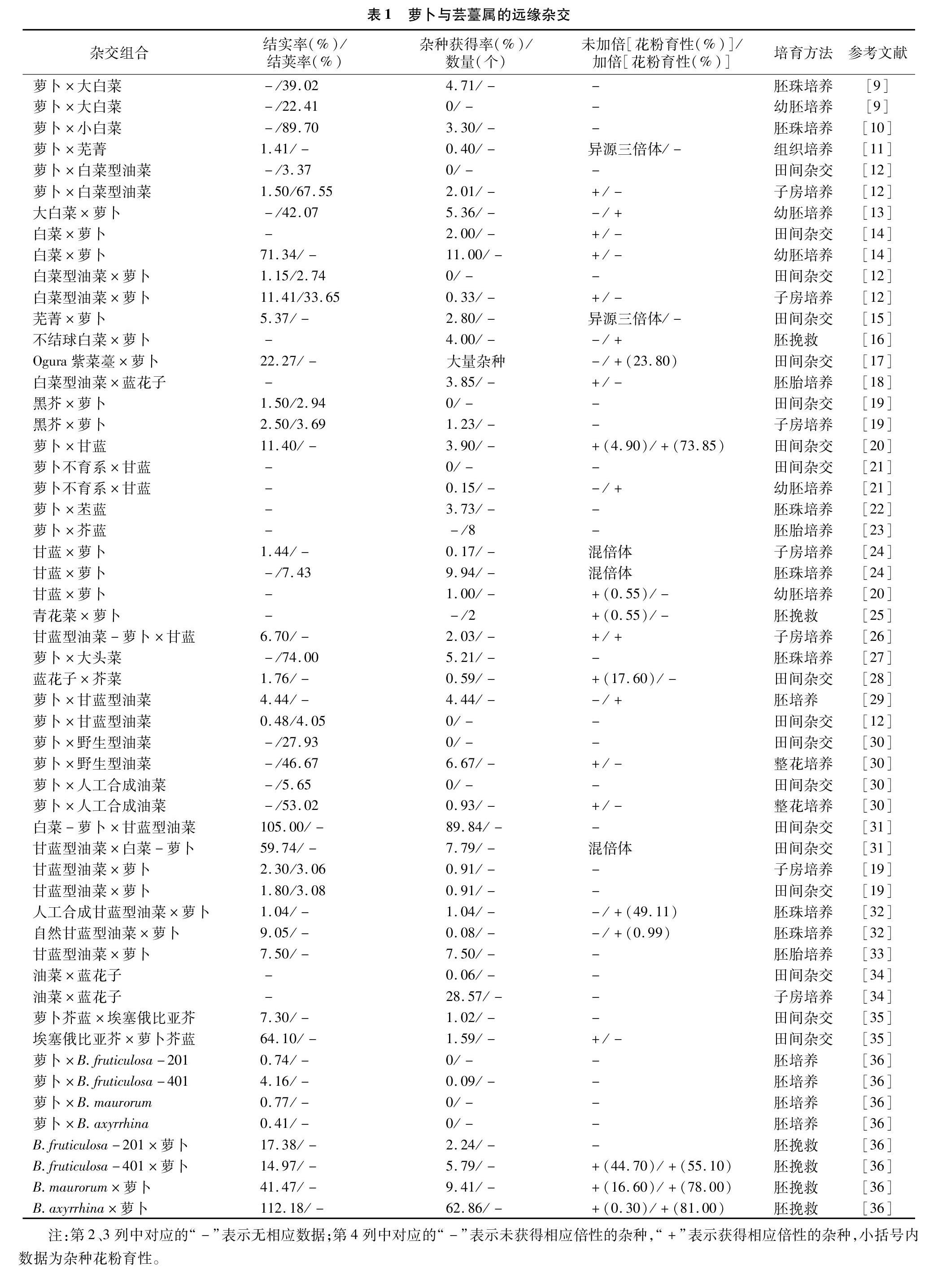
在种间或种以上的分类单位,由于在形态、遗传和生理上存在较大不同,从而导致杂交不能正常结实和获得杂种。表1中汇总了关于萝卜与芸薹属间杂交的实例,萝卜与芸薹属“禹氏三角”中的3个基本种白菜(Brassica rapa L.)、黑芥(Brassica nigra L.)、甘蓝(Brassica oleracea L.),以及3个复合种埃塞俄比亚芥(Brassica carinata L.)、芥菜(Brassica juncea L.)、甘蓝型油菜(Brassica napus L.)和野生芸薹种均有杂交成功的实例,并且有的正反交都获得了一定的结实率和杂种获得率,揭示萝卜属与芸薹属的亲缘关系较近。此外可以看出,不仅不同杂交亲本和组合方式下远缘杂交不亲和性的程度不同,而且同一杂交组合下正反交的杂种获得率也有很大差异。组培技术出现后,在萝卜与芸薹属远缘杂交中均采用子房培养、幼胚培养和胚珠培养等组培技术进行胚挽救,结果是卓有成效的。从表1还可以看出,通过组织培养和整花培养技术使结实率、杂种获得频率得到了提高,并对杂种进行加倍,获得异源四倍体、异源六倍体等,使杂种后代的育性得到了提高,有效克服了远缘杂交的不亲和性。
1.1 杂交亲本的基因组和基因型
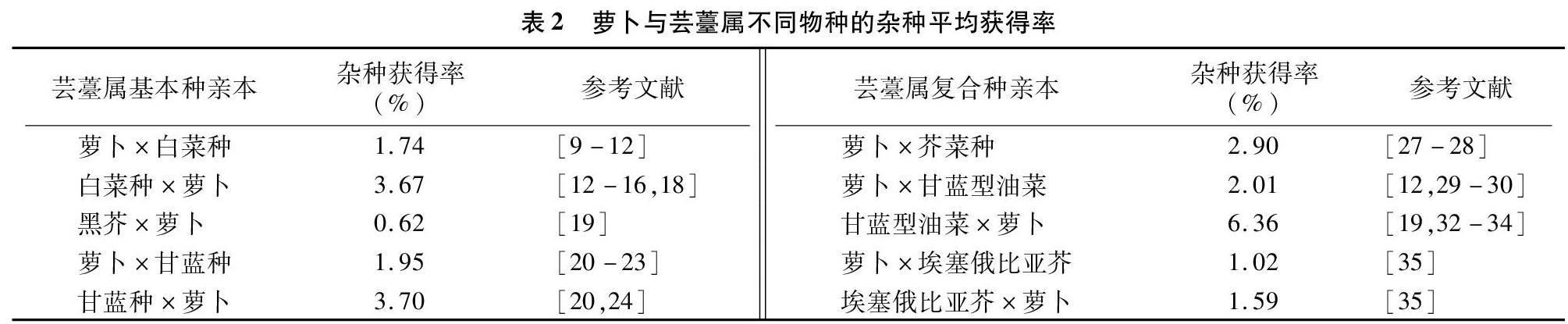
在一般情况下,杂交父母本的亲缘关系越近,获得杂种的频率越高。通过利用基因组原位杂交(GISH)和扩增片段长度多态性(AFLP)技术对部分回交后代(BC1)的基因组组成分析可知,F1代杂种的白菜基因组(AA)和萝卜基因组(RR)间的染色体配对频率较高,在73.53%的花粉母细胞(PMCs)中形成异源合价体,表明2个基因组之间存在显著的同源重组[37],如萝卜与白菜杂交更容易获得杂种[4,15,38]。表2是对表1中获得的远缘杂种频率进行汇总的结果,也揭示了萝卜与白菜、甘蓝的远缘杂种获得率显著高于黑芥组合。另外,基因组测序比对表明,萝卜基因组与芸薹属基因组共同经历了基因三倍体化的事件,有着共同的进化祖先物种[39]。因此可见,亲本的基因组体系对属间杂交的可交配性起着决定性作用[11]。在远缘杂交中,不同基因型的亲本也影响着杂种的结实率,如黄邦全等研究发现,不同类型的萝卜与Ogura紫菜薹杂交,紫菜薹Ogura CMS与四季萝卜杂交的结实率明显高于紫菜薹Ogura CMS与南畔晚萝卜杂交的结实率[17]。
1.2 杂交亲本的染色体数目
远缘杂交中杂交亲本的亲和性与亲本的染色体数目呈正相关,有研究表明,具有相同染色体组的2个亲本的亲和性较强,易得到杂种。此外,罗鸿源的试验还表明,染色体数目多的物种作母本的结角率较高(6.2%~71.7%),获得远缘杂种的成功率也较高[40]。从表2中也不难看出,萝卜与芸薹属复合种杂交获得杂种的频率明显高于与基本种杂交,是否与复合种的染色体数目相关,还有待具体分析。
1.3 子房离体培养的取材时间
授粉后杂种子房离体培养的取材时间早晚会影响子房的成活率,必须在角果停止生长、胚败育之前进行组织培养,从而为杂种胚提供正常生长所需的营养,杂种获得率也可以提高。李明山等在萝卜与大白菜的属间杂交试验中发现,在授粉第15天后,胚乳开始变褐退化,但胚仍是健康的[13]。然而,相关研究表明,萝卜与大头菜的最佳取材时间是授粉后的第7天[27]。虽然都是萝卜与芸薹属的属间杂交,但是不同亲本及杂交组合方式的最佳取材时间会不尽相同。周清元曾探讨过取材时间对芸薹属植物杂交结实率的影响[41]。可以看出,过早或过晚的取材时间都会影响远缘杂交的结荚率和结实率。
1.4 单向不亲和性
在萝卜属与芸薹属的属间杂交中,单向属间不亲和性普遍存在。例如在萝卜与甘蓝种的杂交中,以萝卜作为父本容易获得杂种[42],与表2的结论一致。Inomata在白菜与甘蓝的杂交组合中也发现,子房培养显著提高了正交组合的杂种获得率,但对于反交的效果甚微[43]。如陈洪高在远缘杂种(萝卜/芥蓝)与萝卜杂交的研究中发现,以杂种(萝卜/芥蓝)作为母本时的亲和性大于以萝卜为母本时的亲和性[35]。在表2中也明确了单向不亲和性现象的存在,即同一组合在正反交不亲和性方面也有一定的差异。
2 不亲和性的克服方法
2.1 受精指数高杂交组合与授粉时间
受精指数与结实指数间存在较高的遗传相关性(r=0.656)[44],选择受精指数高的杂交组合对于克服不亲和性有积极影响。吴江生等在甘蓝型油菜与芥菜型油菜的试验中发现,受精指数与结角率和角果长度均达到0.001的显著水平[45]。研究表明,在抑制不亲和反应的因素未发生作用之前的蕾期对柱头进行授粉,花粉管可正常生长进入子房到达胚囊。母本柱头对花粉的识别能力最低时期不仅在柱头未成熟时,还在过成熟时[46]。因此,在开花前期或后期进行授粉,可以克服远缘杂交不亲和性[47-48]。
2.2 克服受精前障碍
大量研究表明,蕾期重复授粉、混合授粉、涂抹化学药剂和辐射诱变种子等方法可以克服远缘杂交受精前的障碍。例如在萝卜×芜菁[49]、甘蓝型油菜×萝卜[12]属间杂交中采用甘氨酸(Gly)、赤霉素(GA3)、氯化钠(NaCl)取得了良好的效果;利用辐射诱变和重复授粉[50]提高了萝卜×大白菜[40]的杂种获得率。此外研究发现,花粉萌发液和重复授粉[40]对于克服萝卜与芸薹属的属间杂交不亲和性有着显著作用。
2.3 不育系材料作母本
以萝卜雄性不育植株为母本、甘蓝型油菜为父本进行授粉,得到34株杂种(萝卜/甘蓝型油菜)[29]。同样的,在克服油菜杂交不亲和的研究中也发现,以白菜型的不育材料作母本组合的平均结角率比以育性正常的材料作母本组合的结角率增加了14倍以上[40]。上述研究说明,在萝卜属与芸薹属杂交中,用不育性材料作母本可以提高远缘杂交的亲和性,这为萝卜与芸薹属的属间杂交育种提供了参考。
2.4 组织培养技术
远缘种间在遗传上的差异较大,造成生理上的不协调,所以在原胚至球形胚以及在有丝分裂和合成新的细胞质等方面时遇到障碍,就会发生杂种胚的败育。胚的发育与胚乳的营养供应有关,组培技术的出现可以及时为幼胚发育提供营养。Tokumasu等在萝卜属与芸薹属的属间杂交中都使用杂种胚离体技术,使得杂种获得率普遍提高[51]。然而组织培养技术最重要的是为杂交种创造一个适宜的环境,在培养基中添加适量的生长物质、糖、无机盐、激素及控制培养温度、光照等对杂交种的成长有着促进作用[52]。有研究表明,采用改良液体培养基胚的生长速度、成活率均显著高于固体培养基[13]。
3 远缘杂种的育性
远缘杂种的育性主要包括杂种的成活性和结实性。成活性是指杂种种子不能发芽、幼苗衰弱或者死亡。由于染色体的不同源性,在减数分裂时常发生染色体不能进行正常配对联会及随之产生的不规则分配,因而导致杂种植株不结实,表现为杂种不育。
染色体加倍可以克服减数分裂时染色体不能正常配对引起的杂种不育性,提高杂种成活率和后代结实率[12]。秋水仙素处理法是染色体加倍常用的方法,但处理的方法和效果是不同的。(1)涂抹法。用药棉蘸秋水仙素涂抹杂种着生腋芽处,如在萝卜与芸薹属间杂交时,处理的杂种均在花蕾较小时便变黄脱落或者开花后不能受精,不能使染色体加倍成功[12]。李勤菲等采用秋水仙碱滴生长点、浸根和秋水仙碱培养基等3种方法处理芸薹属三倍体幼苗,其中滴生长点诱导率最低,为17.54%[53]。(2)浸根法。如采用0.15%秋水仙素處理萝卜、甘蓝的属间杂种,51.0%的植株为嵌合体,21.3% 的植株加倍过度,27.7%的杂种植株未加倍成功[20]。采用秋水仙素浸根加倍方法简单有效,但得到的大多数为嵌合体。(3)组培加倍法。秋水仙素灭菌的方法有湿热高压灭菌和抽滤灭菌方法,在湿热高压灭菌后,含有秋水仙素的培养基上愈伤组织的生长没有发生药害,再生苗/愈伤组织的诱导率为147.2%,再生植株的结实率为48.1%;而抽滤灭菌的结果则相反,再生苗/愈伤组织的诱导率仅为3.3%,再生植株的结实率为0[54]。可能是由于秋水仙素为一种生物碱,用高压灭菌锅灭菌时,秋水仙素可能发生改性而使有效浓度降低。而且将甘蓝型油菜与蓝花子(Raphanus sativus L.var. raphanistroides Makino)F1代组培苗转入含有秋水仙素的固体培养基中,后期鉴定发现,绝大多数为双二倍体[55],嵌合体的频率降低。
综上所述,蘸秋水仙素涂抹杂种腋芽不能使杂种加倍,可能由于采用涂抹法时,秋水仙素不易渗入茎尖生长点组织;浸根加倍往往得到的是嵌合体,原因可能是炼苗后植株的根系比较发达,可能是由于根系运输秋水仙素未能到达所有生长点而不能使其整株加倍成功,也可能是由于植株的生长速度高于加倍细胞的分化和增殖速度,也有可能是由于操作不仔细,秋水仙素使部分茎叶加倍。而使用添加秋水仙素的固体培养基处理时间长,可以彻底抑制纺锤体的形成而产生双二倍体,但是不易确定合理的浓度,所以要注意浓度的使用,过高过低都会影响杂种生长。
4 表观遗传学
DNA甲基化涉及多种生物学过程,包括基因表达调控和转座子活性的调节,这些过程可能在不改变DNA序列[56-59]的情况下引起相应的形态学变化。
4.1 异源多倍体与DNA甲基化
大量新物种来源于异源多倍体,因此异源多倍体是最广泛的物种形成模式之一。然而,异源多倍体的形成需要2个亲本基因组在1个共同的细胞质内发挥作用,这可能涉及到表观遗传变化。
Xu等采用甲基化敏感性扩增多态性(MSAP)方法对白菜的DNA甲基化进行研究发现,约有1.7%的片段在基因组加倍时发生了甲基化改变,表明基因组的加倍使胞嘧啶甲基化发生变异[60]。还有研究发现,单一合成甘蓝多倍体系之间的变异,可导致开花时间等性状的遗传和表型差异[61-62]及分子变异[63]。除此之外,Lukens等研究了甘蓝和白菜双单倍体杂交,得到49个异源多倍体植株在大量位点上存在遗传和表观遗传变异,在理想状态下,植株形态是一致的,但S0多倍体后代的CpG甲基化表观遗传程度高且变化罕见[64]。远缘杂交早期世代发生遗传变异,如萝卜和芥蓝杂种的F4代至F10代异源四倍体体细胞染色体数目变化表明,早期便发生DNA甲基化变异从而导致世代染色体数目不同[23]。
4.2 DNA甲基化的遗传力和可逆性
据报道,植物中胞嘧啶甲基化(MC)模式以自发或诱导的2种方式来改变,并通过不同的DNA甲基转移酶通过有丝分裂传递[65]。然而,人们对DNA甲基化的诱导性变化是否可以传递了解得较少。Johannes等通过研究证明,拟南芥表观遗传基因重组自交系中的DNA甲基化变化至少在8代之间传播,而基因DNA序列没有发生改变[66]。与此同时,李象松等对人工合成的萝卜-芥蓝异源四倍体F4代、F10代用甲基化敏感性扩增多态性检测发现,甲基化程度分别为3061%、33.10%[67]。Li等也通过萝卜和芥蓝的属间杂交得到Raphanobrassica的异源多倍体F4代至F10代,经MSAP检测,胞嘧啶甲基化模式在杂交和二倍体形成过程中发生了明显变化[23]。除此之外,甘蓝与茎瘤芥嫁接组成了TTC(2,3,5-三苯基氯化四氮唑)嵌合茎尖分生组织(SAM),GS1(嫁接-自交)代中与茎瘤芥相比有529%~6.59%的甲基化变化,GS5代中有31.58%的甲基化变化,其余DNA的甲基化改变则逐渐恢复到原来的状态,说明嫁接诱导的DNA甲基化变化是可遗传的,也是可逆的[68]。因此,表观遗传变化是指由潜在DNA序列的改变以外的机制引起的遗传变化,这种变化可持续多代[69-70]。
利用相关序列扩增多态性(SRAP)[71-72]对白菜和黑芥杂交材料进行分析表明,同源四倍体的片段是同源二倍体的2倍,此外,异源四倍体中的新片段是异源二倍体的2倍。当异源四倍体(F1)进行自交时,F2代表现出不同的表型和遗传模式,表明在广泛的杂交和基因组加倍中,遗传变化的程度与多倍体水平呈正相关[73]。
4.3 小RNAs与DNA甲基化
远缘杂交会导致基因组复制和异源多倍体的形成,异源多倍体是研究植物进化的重要材料。最近的研究表明,小RNAs,特别是24 nt siRNAs(小干扰RNA)在基因组中起着重要的作用,是阐明异源多倍体机制的关键。Ghani等研究白菜和黑芥杂种异源多倍体的小RNA表明,MicroRNA(miRNAs)的百分比與多倍体水平呈正相关,而siRNAs和DNA甲基化的百分比与多倍体水平呈负相关[74]。siRNAs和DNA甲基化的稳定遗传可维持基因组稳定性,而miRNAs的表达变异则调控基因表达,诱导表型变异。与此同时,在研究拟南芥杂种中也发现,小RNA可作为抑制基因组重组的基因缓冲剂[75]。
5 展望
远缘杂交作为蔬菜遗传改良中实现不同物种间优良性状转移以及创造新种质资源的有效方法,一直受到人们的关注。国内外已有不少关于属间杂交成功的例子,但是通过人工杂交授粉、组织培养、体细胞杂交等改良技术仍然没有使萝卜属与芸薹属属间杂交的结实率和杂种获得率得到很大的提高。因此,仍需要不断探索关于属间杂交不亲和性的机制。异源多倍体在植物物种的起源和进化中起着重要作用,但是关于2个基因组如何在1个核内与异源多倍体单个亲本细胞质协调还尚不清楚,关于DNA甲基化如何在异源多倍体形成和发育中起作用依然知之甚少。随着组织培养、细胞遗传学和DNA甲基化等学科的迅猛发展,未来在萝卜属与芸薹属的属间杂交会为育种改良创造更多新种质和新品种,从而为深入研究物种进化提供原材料。
参考文献:
[1]汪隆植,何启伟. 中国萝卜[M]. 北京:科学技术文献出版社,2005:1-21.
[2]Karpechenko G D. Polyploid hybrids of Raphanus sativus L.×Brassica oleracea L[J]. Zeitschrift für Induktive Abstammungs-und Vererbungslehre,1928,48(1):1-85.
[3]王明霞. 萝卜及其近缘属种亲缘关系分析与遗传图谱构建[D]. 南京:南京农业大学,2007.
[4]Peterka H,Budahn H,Schrader O,et al. Transfer of resistance against the beet cyst nematode from radish (Raphanus sativus) to rape (Brassica napus) by monosomic chromosome addition[J]. Theoretical and Applied Genetics,2004,109(1):30-41.
[5]Bannerot H,Boulidard L,Chupeau Y. Unexpected difficulties met with the radish cytoplasm in Brassica oleracea[J]. Eucarpia Cruciferae Newsletter,1977,2:16-24.
[6]方小平,王秀珍,曾令益,等. 抗根肿病萝卜油菜六倍体新物种的创制[C]//中国作物学会油料作物专业委员会第八次会员代表大会暨学术年会, 2018.
[7]Long M H,Okubo H,Fujieda K. Backcross compatibility in hybrids between Brassicoraphanus (Brassica oleracea × Raphanus sativus) and cruciferous crops,and clubroot(Plasmodiophora brassicae Woronin) resistance in their BC2 plants[J]. Journal of the Faculty of Agriculture Kyushu University,1994,37(1):41-50.
[8]徐爱遐,黄继英,金平安,等. 甘蓝型油菜和芥菜型油菜种间杂交研究[J]. 西北植物学报,1999,19(3):402-407.
[9]赵德培. 通过组织培养获得萝卜与大白菜的属间杂种[J]. 实验生物学报,1983,16(1):21-29.
[10]张凤银,梅时勇,甘彩霞,等. 萝卜与小白菜属间杂交的初步研究[J]. 江汉大学学报(自然科学版),2010,38(4):70-72.
[11]娄丽娜,刘 哲,许园园,等. 萝卜与芜菁异源三倍体杂种的获得及鉴定[J]. 江苏农业学报,2017,33(4):881-889.
[12]周芳菊. 芸薹属与萝卜属间杂种的获得及SSR分子鉴定[D]. 长沙:湖南农业大学,2006.
[13]李明山,索玉英,周长久. 大白菜与萝卜属间杂种幼胚离体培养的研究[J]. 园艺学报,1992,19(4):353-357.
[14]Dolstra O. Synthesis and fertility of ×Brassicoraphanus and ways of transferring Raphanus characters to Brassica[D]. Wageningen,Holland: Centre for Agricultural Publishing and Documentation,1982.
[15]Morris L E,Richharia R H. A triploid radish × turnip hybrid and some of its progeny[J]. Journal of Genetics,1937,34(2):275-286.
[16]Sun C Z,Ying L,Zhang S N,et al. Production of intergeneric allotetraploid between autotetraploid non-heading Chinese cabbage (Brassica campestris ssp. chinensis Makino) and autotetraploid radish (Raphanus sativus L.)[J]. Acta Societatis Botanicorum Poloniae,2014,83(1):75-79.
[17]黃邦全,汪 伟,刘幼琪,等. Ogura CMS紫菜薹与萝卜双二倍体的获得及细胞遗传学研究[J]. 湖北大学学报(自然科学版),2002,24(3):267-271.
[18]吴沿友,蒋九余. 白菜型油菜与蓝花子的属间杂交合子胚组织培养[J]. 植物生理学报,1996(2):131.
[19]胡大有,王爱云,李 栒. 萝卜与甘蓝型油菜和黑芥的远缘杂交亲和性研究[J]. 作物研究,2006,20(2):124-126.
[20]程雨贵. 萝卜和甘蓝属间杂种的创建和研究[D]. 武汉:华中农业大学,2005.
[21]方智远,孙培田,刘玉梅. 萝卜与甘蓝远缘杂交研究初报[J]. 园艺学报,1983,10(3):187-191.
[22]甘彩霞,何云启,崔 磊,等. 萝卜与苤蓝属间杂种胚离体培养[J]. 长江蔬菜,2012(14):13-16.
[23]Li X L,Guo W W,Wang B,et al. Instability of chromosome number and DNA methylation variation induced by hybridization and amphidiploid formation between Raphanus sativus L. and Brassica alboglabra Bailey[J]. BMC Plant Biology,2010,10:207.
[24]扈新民. 甘蓝与萝卜属间杂种的创建及鉴定[D]. 杨凌:西北农林科技大学,2009.
[25]蒋 振,张晓辉,蒋 磊,等. 青花菜与萝卜属间杂种的表型和分子鉴定[J]. 植物遗传资源学报,2014,15(4):859-864.
[26]李 倩,丁云花,李成琼,等. 甘蓝与甘蓝型油菜-萝卜d染色体附加系杂交F1代的获得与鉴定[J]. 西南大学学报(自然科学版),2008,30(8):67-71.
[27]甘彩霞,何云启,崔 磊,等. 萝卜与大头菜属间杂种胚的离体培养[J]. 长江蔬菜,2011(8):18-20.
[28]曾令和,周长久. 萝卜与芥菜属间杂交的研究[J]. 园艺学报,1986,13(8):193-196.
[29]Paulmann W,Rbbelen G. Effective transfer of cytoplasmic male sterility from radish (Raphanus sativus L.) to rape (Brassica napus L.)[J]. Plant Breeding,2010,100(4):299-309.
[30]Metz P L J,Nap J P,Stiekema W J. Hybridization of radish (Raphanus sativus L.) and oilseed rape (Brassica napus L.) through a flower-culture method[J]. Euphytica,1995,83(2):159-168.
[31]Lelivelt C L C,Lange W,Dolstra O. Intergeneric crosses for the transfer of resistance to the beet cyst nematode from Raphanus sativus to Brassica napus[J]. Euphytica,1993,68(1/2):111-120.
[32]刘英春. 甘蓝型油菜与萝卜远缘杂交的研究[D]. 重庆:西南大学,2014.
[33]Takeshita M,Kato M,Tokumasu S. Application of ovule culture to the production of intergeneric or interspecific hybrids in Brassica and Raphanus[J]. The Japanese Journal of Genetics,1980,55(5):373-387.
[34]李旭峰. 甘蓝型油菜与蓝花子属间远缘杂交的研究[D]. 成都:四川大学,1991.
[35]陈洪高. 萝卜-芥蓝异源四倍体的结实性和可交配性研究[D]. 武汉:华中农业大学,2006.
[36]房相佑,谢国禄. 萝卜与芸薹野生种间属间杂种的生产[J]. 国外作物育种,1998(1):56-60.
[37]Zhan Z X,Nwafor C C,Hou Z K,et al. Cytological and morphological analysis of hybrids between Brassicoraphanus,and Brassica napus for introgression of clubroot resistant trait into Brassica napus L.[J]. PLoS One,2017,12(5):e0177470.
[38]Benabdelmouna A,Guéritaine G,Abirached-Darmency M,et al. Genome discrimination in progeny of interspecific hybrids between Brassica napus and Raphanus raphanistrum[J]. Genome,2003,46(3):469-472.
[39]Cheng F,Liang J L,Cai C C,et al. Genome sequencing supports a multi-vertex model for Brassiceae species[J]. Current Opinion in Plant Biology,2017,36:79-87.
[40]羅鸿源. 克服油菜远缘杂交不亲和性研究初报[J]. 湖南农业科学,1983(5):18-20.
[41]周清元,李加纳,殷家明,等. 白菜型油菜和羽衣甘蓝种间杂交的初步研究 Ⅰ. 取材时间对子房离体培养结籽率的影响[J]. 西南农业大学学报(自然科学版),2003,25(6):495-497,509.
[42]谭其猛,魏毓棠,魏宝琴,等. 十字花科蔬菜的远缘杂交试验——种属间杂交亲和力[J]. 沈阳农学院学报,1984(1):1-7.
[43]Inomata N. Production of interspecific hybrids between Brassica campestris and Brassica oleracea by culture in vitro of excised ovaries and their progenies[C]//Akio Fujiwara. Plant tissue culture:proceedings,international congress of plant tissue and cell culture held at Tokyo and Lake Yamanake,Japan,1982.
[44]孟金陵,吴江生,韩继祥. 母本基因组对油菜种间可交配性的影响[J]. 作物研究,1992,6(2):28-32.
[45]吴江生,孟金陵. 甘蓝型油菜×芥菜型油菜的种间可交配性及亲和基因型的筛选[J]. 中国农业科学,1992,25(4):36-40.
[46]吴 俊,李旭锋,李 琳,等. 油菜诸葛菜属植物杂交亲和性研究[J]. 西南农业大学学报,1999,21(5):412-416.
[47]孟金陵. 甘蓝型油菜与甘蓝杂交不亲和性研究——Ⅰ.花粉-雌蕊相互作用及杂种早期胚胎发育[J]. 华中农业大学学报,1987,6(3):203-208.
[48]林 超,孙 萍,程 斐,等. 芸薹属植物的远缘杂交[J]. 山东农业科学,2007(4):27-31.
[49]Lou L A,Lou Q F,Li Z A,et al. Production and characterization of intergeneric hybrids between turnip (Brassica rapa L. em. Metzg. subsp. rapa) and radish (Raphanus sativus L.)[J]. Scientia Horticulturae,2017,220:57-65.
[67]李象松,魏麗华,李炫丽,等. 萝卜-芥蓝异源四倍体F4和F10世代DNA甲基化变异的MSAP分析[J]. 华中农业大学学报,2010,29(1):96-100.
[68]Cao L,Yu N,Li J,et al. Heritability and reversibility of DNA methylation induced by in vitro grafting between Brassica juncea and B. oleracea[J]. Scientific Reports,2016:27233.
[69]Vrana P B,Fossella J A,Matteson P,et al. Genetic and epigenetic incompatibilities underlie hybrid dysgenesis in Peromyscus[J]. Nature Genetics,2000,25(1):120-124.
[70]Bowers J E,Chapman B A,Rong J,et al. Unravelling angiosperm genome evolution by phylogenetic analysis of chromosomal duplication events[J]. Nature,2003,422(6930):433-438.
[71]冯 涛,刘 娟,华夏雪. 利用SSR、SRAP分子标记鉴定桃早熟芽变[J]. 江苏农业科学,2017,45(6):42-44.
[72]倪雅楠,刘 博. 龙爪槐SRAP-PCR反应体系的建立与优化[J]. 江苏农业科学,2017,45(11):19-22.
[73]Ghani M A,Sun Q,Li J X,et al. Phenotypic and genetic variation occurred during wide hybridisation and allopolyploidisation between Brassica rapa and Brassica nigra[J]. Scientia Horticulturae,2014,176(2):22-31.
[74]Ghani M A,Li J X,Rao L L,et al. The role of small RNAs in wide hybridisation and allopolyploidisation between Brassica rapa and Brassica nigra[J]. BMC Plant Biology,2014,14:272.
[75]Ha M,Lu J,Tian L,et al. Small RNAs serve as a genetic buffer against genomic shock in Arabidopsis interspecific hybrids and allopolyploids[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(42):17835-17840.

