3,3′-二氨基-4,4′-偶氮呋咱的合成及纯化
孟俞富,王小旭,张 勇,黄 明,吴金婷,陈明龙,乔琼清,许 进,李鸿波
(1.西南科技大学材料科学与工程学院,四川 绵阳 621010; 2.中国工程物理研究院化工材料研究所,四川 绵阳 621900)
引 言
呋咱环是氮氧五元杂环,又称噁二唑环,含有活性氧;具有芳香性,增大了其热稳定性和热安定性,并使其感度较低,含有较多的碳氮键和氮氧键,具有较高的正生成焓[1]。呋咱环上引入偶氮桥、氧化偶氮桥等不同基团能提高物质的能量密度和爆炸性能。
自1968年Coburn首次合成单呋咱含能化合物3,4-二氨基呋咱(DAF)以来[2],众多DAF衍生出的呋咱含能化合物[3-4]也逐步成为含能材料的研究热点。DAF经多种氧化剂氧化可制得3,3′-二氨基-4,4′-偶氮呋咱(DAAF)。DAAF是一种能量密度大(密度为1.728g/cm3、爆速为7600m/s、爆压为26.2GPa)、正生成焓高(536kJ/mol)、热稳定性好(热分解温度315℃)、与六硝基菧(HNS)和三氨基三硝基苯(TATB)相当的含能材料;其落锤撞击感度均大于320cm(2.5kg落锤),静电火花感度大于0.36J,摩擦感度大于36kg(BAM)[5-6],有望成为新型冲击片雷管用始发药。目前,国内外对于DAAF的研究主要集中在新合成方法、配方研制和性能测试上,尚无用于制备标准物质候选物的高纯DAAF合成工艺报道。
DAAF的合成工艺主要有两种:(1)以单电子体系的氧化剂,如过硫酸铵[7]、过硫酸钠[7]、高锰酸钾[5]和次氯酸钠(NaOCl)[8]等氧化DAF合成DAAF;(2)将3,3′-二氨基-4,4′-氧化偶氮呋咱(DAOAF)还原得到DAAF,在甲醇溶剂中先用锌还原DAOAF生成3,3′-二氨基-4,4′-氢化偶氮呋咱(DAHAF)中间体,然后通入空气使其氧化成DAAF[9]。第二种工艺存在原料不易制得、易发生爆炸、不稳定、反应时间长及总产率不高等缺点。
本研究一步优化了碳酸氢钠(NaHCO3)溶液缓冲体系中用NaOCl[8]氧化DAF合成DAAF的工艺条件,利用HPLC法测定粗品中杂质的结构与含量,粗品中的主要副产物DAOAF经锌粉还原、空气氧化最终转化为DAAF,提高了其原子经济性。最终以较高回收率(大于80.1%)获得高纯DAAF(纯度大于99.60%),有望成为标准物质的候选物。
1 实 验
1.1 试剂和仪器
3,4-二氨基呋咱(DAF)、3,3′-二氨基-4,4′-氧化偶氮呋咱(DAOAF)标准品,自制,纯度大于99%,满足色谱分析要求;次氯酸钠(NaOCl)溶液(氯质量分数5.5%)、碳酸氢钠(NaHCO3)、N,N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)等,均为AR级,成都市科龙化工试剂厂;锌粉,广东光华科技股份有限公司。
AV 600型(600 MHz)超导核磁共振波谱仪,瑞士Bruker公司;Nexus 870型傅里叶变换红外光谱仪,美国Nicolet公司;Varian 325-LC-MS质谱仪,美国Agilent公司;Ultimate3000DGLC 双三元、二维液相色谱仪、ICS-900离子色谱仪,美国Thermo Fisher Scientific公司;AA 700原子吸收光谱仪,美国珀金埃尔默公司。
1.2 合成路线
以3,4-二氨基呋咱(DAF)为原料在NaHCO3溶液缓冲体系中,用质量分数5%的NaOCl溶液氧化DAF,生成DAAF和副产物DAOAF,副产物DAOAF通过锌粉还原、空气氧化反应转化为产物DAAF。反应路线如下:
1.3 高纯DAAF的合成
将100g(1.00mol)新制DAF、336g(4.00mol)碳酸氢钠及6L水加入15L反应瓶中,冰浴条件下搅拌溶解后,缓慢滴加3710mL质量分数5%的NaClO溶液,体系迅速变成黄色,滴毕继续搅拌15min,静置、抽滤、水洗、真空干燥得橙黄色粉末95.25g,收率97.2%,纯度96.19%(HPLC归一化法)。
取50g粗品DAAF在80℃下搅拌溶解于DMF中,加入7g锌粉反应2h,缓慢滴加75mL、4mol/L的盐酸溶液,再通入空气氧化2h,迅速倒入约3L冷水中析出DAAF。冷却、抽滤、用乙醇充分洗涤、真空干燥得淡黄色固体粉末40.55g,纯度99.80%(HPLC归一化法),回收率80.1%。
IR(KBr),(v/cm-1):3441,3336(-NH2:υas,υs),1621,772(—NH2:δ面内,δ面外),1498,1421(C=N-O:υas,υs);1H NMR (DMSO-d6,600MHz),δ:6.91; MS (APCI),m/z(%):195.1[M-H]+(100%)。
2 结果与讨论
2.1 DAAF收率的影响因素
在NaOCl氧化DAF生成DAAF的过程中, TLC检测表明反应非常迅速,NaOCl溶液滴加完成后,原料DAF已基本反应完全。NaHCO3和NaOCl的投量及反应温度对反应收率有较大的影响。因此本研究主要考查了DAF、NaHCO3与NaOCl的投料比及反应温度对DAAF收率的影响。
2.1.1 DAF、NaHCO3和NaOCl的投料比
在冰浴条件下,DAF、NaHCO3与NaOCl的投料比对DAAF收率和纯度(HPLC面积归一化法)的影响见表1。

表1 反应物摩尔比对DAAF收率和纯度的影响Table 1 Effect of reactant molar ratio on the yield and purity of DAAF
注:η为粗品收率;P为粗品纯度。
由表1可知,反应物摩尔比n(DAF)∶n(NaHCO3)∶n(NaClO)为1.0∶5.0∶2.5和1.0∶4.0∶2.5时的收率相当,考虑到成本因素及环境保护,选用n(DAF)∶n(NaHCO3)∶n(NaClO)为1.0∶4.0∶2.5为宜。
2.1.2 反应温度
在反应物摩尔比n(DAF)∶n(NaHCO3)∶n(NaClO)为1.0∶4.0∶2.5时,反应温度对DAAF收率的影响见图2。
由图1可知,当温度为30℃时,DAAF的收率较低(81.2%),随着温度的降低,收率逐渐升高,0℃时收率为97.2%,说明低温能有效避免产品DAAF中的氨基或偶氮基被进一步氧化生成DAOAF等杂质。温度低于0℃时,收率未有明显提高,故较适宜的反应温度为0℃。
2.2 DAAF中杂质表征及纯度分析
采用HPLC(面积归一化法)测定产品纯度[10],并分析产品中杂质。DAF、DAAF和DAOAF在同一液相条件下分析,HPLC色谱图如图2所示。色谱条件为:柱温30℃;检测波长230nm;Zorbax SB-C18(250mm×4.6mm,5.0μm)柱;流动相为乙腈/水(体积比为40∶60);流速为0.8mL/min;进样体积10μL。
如图2(a)和(b)所示,粗品DAAF中的主要杂质为少量未反应完全的DAF和副产物DAOAF。纯化前后DAAF的HPLC色谱图和其相对含量见图2(b)、(c)及表2。
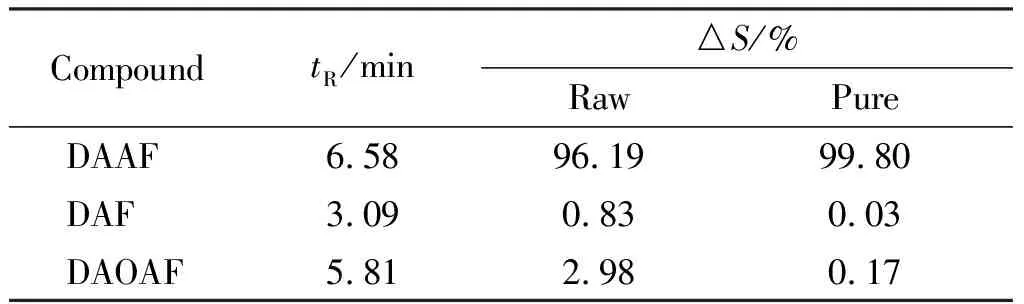
表2 DAAF及其杂质的相对含量Table 2 Relative content of the DAAF and its impurities
注:tR为保留时间;△S为相对峰面积。
由图2和表2可知,粗品DAAF于80℃经DMF溶解、Zn粉/HCl还原、空气氧化,可以把副产物DAOAF有效转化为DAAF,且未反应完全的DAF因溶解于DMF也被除去,从而制得高纯DAAF(纯度99.80%)。
DAAF的1H NMR谱图(DMSO-d6,600MHz)如图3所示。
从图3核磁氢谱中也可以看出,图谱中除了溶剂峰(δ=2.51)和溶剂水峰(δ=3.34)以外,在δ=6.52处有峰值很小的DAOAF峰,也佐证了高纯度样品的主要杂质为极少量的DAOAF。
此外对纯品中的无机阴离子和金属元素的含量分别通过离子色谱法和原子吸收光谱法进行了检测,检测结果见表3。
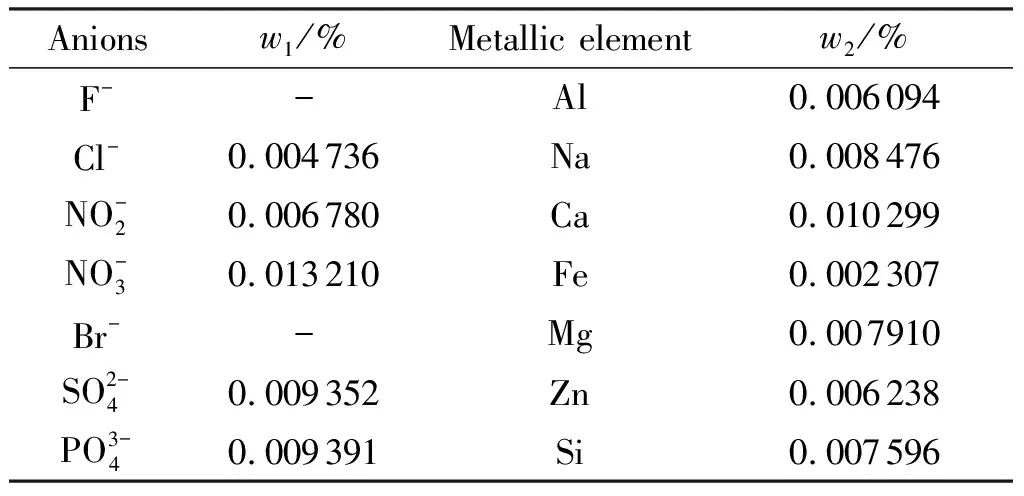
表3 DAAF样品中阴离子及金属元素检测结果Table 3 Determination results of anions and metallic elements in DAAF samples
注:“-”为未检测出;w1为阴离子含量;w2为金属元素含量。
如表3所示,纯品中的金属元素和阴离子等含量极低,其中阴离子质量分数总和为0.043%,金属元素的质量分数总和为0.049%,总质量分数不足0.1%。
2.3 DAAF的纯化
由于DAOAF在DMF和DMSO以外的其他溶剂中溶解度较小,且反应中主要副产物是DAOAF,因此,本研究主要考察了用DMF和DMSO重结晶、洗涤以及参考两步法生成DAAF来除去产物中主要副产物DAOAF[9],结果见表4(纯度测定为HPLC归一化法)
由表4可知,在DMF溶剂中,用Zn粉/HCl还原副产物DAOAF为中间体3,3′-二氨基-4,4′-氢化偶氮呋咱(DAHAF),再通入空气使其氧化为DAAF,能够以较高的回收率得到高纯度的DAAF(No.5)。扣除阴离子、金属元素后其最终纯度仍大于99.60%。

表4 不同纯化方法对DAAF回收率和纯度的影响Table 4 Effect of different purification methods on the yield and purity of DAAF
注:Y为回收率;P为纯度。
此外,在不同投料量下对DAAF粗品及其纯化后的高纯DAAF进行了工艺稳定性考察,结果见表5(纯度测定为HPLC归一化法)。

表5 不同投料量下的工艺稳定性考察Table 5 Study on process stability under different loading quantity
注:m为投料质量;η为粗品收率;Ρ为粗品纯度;Y为回收率;Ρ′为纯化后纯度。
由表5可知,在不同投料量下制得的DAAF粗品收率均达97.0%,纯度大于95.00%。粗品经纯化后得到高纯DAAF,考虑去除阴离子和金属阳离子后,纯度大于99.60%,回收率大于80.1%。因此该合成、纯化工艺重复性和稳定性高,具有较高的实用价值。
3 结 论
(1)以NaHCO3溶液为缓冲体系,DAF经次氯酸钠氧化可制得DAAF。优化后的最佳合成工艺条件为:n(DAF)∶n(NaHCO3)∶n(NaClO)为1.0∶4.0∶2.5,冰浴条件粗品收率大于97.0%,纯度大于95.00%。
(2)粗品DAAF中杂质主要为DAOAF和DAF。DMF溶剂中,粗品DAAF经锌粉还原和空气氧化,主杂质DAOAF可有效转化为DAAF,提高原子经济性,同时能除去杂质DAF,最终获得高纯DAAF,纯度大于99.60%,回收率大于80.1%。

