干热河谷土壤酶活性对碳氮添加的响应
樊 博,史亮涛,潘志贤,何光熊,孙 毅,闫帮国,*
1 云南省农业科学院热区生态农业研究所,元谋 651300 2 元谋干热河谷植物园,元谋 651300
碳氮是生态系统运转的关键元素[1-2]。碳氮交互作用深刻地影响生态系统的功能以及生态系统对全球变化的响应[3]。二氧化碳浓度升高可以促进植物生长,从而可以固定更多的碳,但是这种促进作用与氮元素的丰缺有关[4]。当氮逐渐限制时,二氧化碳浓度对植物生长不再具有促进作用[5]。
大气二氧化碳浓度升高和温度增高对植物生长的促进作用增加了土壤的碳输入[6]。另一方面,日益增加的大气氮沉降增加了土壤氮的含量,导致碳可能会成为土壤生物化学过程的限制养分。因此,碳氮交互作用同样可能存在于土壤生态系统中。碳是许多生态系统中限制土壤微生物生长的因素,特别是氮添加下的生态系统中,碳的限制可能更为严重[7]。
土壤酶是影响土壤养分循环和有机物分解的重要催化物质,主要由土壤微生物分泌而来[8]。土壤酶活性反映了土壤的肥力[9],其化学计量学特征反映了土壤养分的平衡状况[10]。碳氮平衡的改变必然对土壤酶活性及其化学计量学特征产生重要影响。
土壤酶是促进土壤稳定有机碳形成的重要因素[11]。碳源物质的水解酶产物被微生物利用后更容易与土壤矿物质结合,进而形成稳定的土壤有机碳[12]。然而,外源碳输入并不一定伴随土壤碳库的增加。外源碳可能会激发土壤中有机质的分解,产生激发效应(Priming effect)[13]。事实上,随着植物生产力的提高和碳输入的增加,土壤碳库的分解速率也在增加,从而抵消了碳的输入[14]。相反,氮增加可能会促进土壤稳定有机碳的形成[15]。这些截然不同的结果可能与碳氮对土壤酶活性的影响有关。因此,认识碳氮对土壤酶活性的交互作用是了解全球变化下土壤生态系统功能和生物地球化学循环变化趋势的关键。
已有研究表明碳、氮交互作用对生态系统生产力具有重要的影响[5],那么碳、氮对土壤酶活性的影响是否存在交互作用?本研究依托干热河谷的实验草地,进行土壤碳氮添加控制实验,揭示碳氮交互作用对土壤酶活性的影响。研究结果将有助于进一步认识碳氮在土壤生态系统中的作用及其耦合机制,理解生态系统富氮化后碳氮平衡对土壤酶活性的影响机制。
1 材料和方法
1.1 实验地概况
实验地位于金沙江干热河谷地区的元谋沟蚀崩塌观测站上,年均温在21℃左右,年降水量低于700 mm,且90%以上分布在雨季(6—10月)。当地的优势植物为黄茅Heteropogoncontortus、孔颖草Bothriochloapertusa、拟金茅Eulaliopsisbinata和橘草Cymbopogongoeringii等。区域内土壤侵蚀较为严重,导致部分地表的植被破坏和土层混合。为了模拟土壤侵蚀状况下植被恢复对土壤生态系统的影响,选定一个土壤类型为燥红土的实验区,去除植被和表层土壤(0—100 cm),通过推土机混合后回填部分土壤。土壤全碳含量为2.55 mg/g,全氮含量为0.20 mg/g,全磷含量为0.10 mg/g,pH为6.26左右。整个实验区被划分为12个区块,区块面积8 m×16 m。每个区块划分为8个样方,各样方中配置了不同的植物物种[16]。每个样方面积为1.8 m×1.8 m。中间间隔0.4 m,区块之间间隔1 m。
为了探明氮添加对土壤生态系统的影响,6个区块每年添加固体分析纯NH4NO3,分两次分别在6月和8月中旬添加,添加量为每年5 g N m-2(大约为区域大气沉降背景值[17]的2—3倍左右)。氮添加通常选择在连阴雨期间进行,氮添加时与少量当地沙土混匀后播撒。另外6个区块为对照,只播撒相应量的沙土。氮添加区块与对照区块随机排列,以消除位置上土壤异质性的影响。处理区块间隔0.8 m,设置土埂。该样地2012年建成,2013年开始进行氮添加处理。
2015年10月采集了4种单一种植样方下(分别为黄茅、孔颖草、拟金茅和橘草)的表层土壤 (0—15 cm)。每个物种的处理包含10个样方,其中5个为对照;5个为氮添加。实验共含有4个植物处理×2个氮处理×5个重复=40个样方。

1.2 样品处理与测定
每个样方的土壤称量2份(100 g风干土壤样品),放入350 mL Mason瓶中,其中一份为对照,第二份添加碳,为500 mg C kg-1土壤(0.1251 g葡萄糖/100 g土壤)。所有土壤样品水分含量均调节至田间饱和含水量的60%,用封口膜盖住以降低水分流失,每隔3 d校正一次水分。28℃下暗培养,9天后(预实验表明碳添加9 d后土壤酶活性趋于稳定,与Allison和Vitousek[20]的研究结果相似)将土壤取出,置于4℃冰箱中保存,用于测定土壤酶活性。
根据Sinsabaugh等研究结果[21],土壤或沉积物中C、N、P水解酶可由β- 1,4-葡萄糖苷酶(BG),酸性磷酸酶(AP),几丁质酶(NAG)和亮氨酸氨基肽(LAP)表征,具体测定方法参照[22]。β- 1,4-葡萄糖苷酶、酸性磷酸酶和几丁质酶测定方法相似,底物分别为对硝基苯-β-吡喃葡萄糖苷、对硝基苯磷酸二钠和对硝基苯β-N-乙酰葡糖胺糖苷,用pH 5.0的50 mmol/L醋酸缓冲液配制浓度为2.5 mmol/L的底物溶液(由于对硝基苯β-N-乙酰葡糖胺糖苷极难溶解,底物溶液的浓度为1 mmol/L)。在测定土壤酶活性前将土壤充分混匀。预实验表明土壤太多,反应底物不足会限制反应速率;土壤太少,反应产物显色太弱。因此本研究进行了预实验来测定不同土壤重量下酶活性的倍性关系和重复性,以确定合适的土壤量(AP为0.15 g左右;LAP 0.35 g左右;NAG 0.2 g左右;BG 0.2 g左右)。测定的具体步骤是:称量土壤并记录重量,放入10 mL离心管中,再加入4 mL底物溶液;用4 mL缓冲液加土壤作为土壤对照;同时设置底物对照(不加土壤)。20℃培养结束3—4 h后离心3 min。提取上清液2.5 mL,加入0.25 mL 1 mol/L NaOH终止反应和显色,在410 nm处测定吸光度,用不同浓度对硝基酚作为标准曲线。亮氨酸氨基肽酶测定中采用L-亮氨酸- 4-硝基苯胺作为底物,以pH为8.0的50 mmol/L Tris缓冲液配制1 mmol/L的底物溶液。在10 mL离心管中加入0.1 g左右的新鲜土壤,加入4 mL 1 mmol/L的底物溶液;同时设置底物对照和土壤对照,所有样品培养4 h。由于该底物对氢氧化钠很敏感,极易分解,另外pH 8.0缓冲液已经可以使对硝基酚显色,因此本指标是培养结束后直接在分光光度计410 nm处测定吸光度。定量方法也是用不同浓度对硝基酚作为标准曲线。酶活性为样品测定值减去土壤对照和底物对照,用nmol对硝基酚 g-1h-1表示。
1.3 数据分析
初步分析后发现植物物种与碳或氮之间均不存在显著的交互作用。因此本文将不同物种处理合并,只关注碳氮的作用及其交互作用。土壤酶C∶N化学计量学特征用ln(BG)∶ln(LAP+NAG)表征;C∶P用ln(BG)∶ln(AP);N∶P用ln(LAP+NAG)∶ln(AP)表征[21]。用最小显著差异法(LSD)比较碳氮处理间的差异;采用方差分析法分析碳氮处理及其交互作用对土壤酶活性的影响。为了揭示碳氮添加对土壤土壤酶活性变化的关联性影响,计算了土壤酶活性在碳添加后的变化值(碳添加后土壤酶活性减去没有碳添加的对应值),并采用线性回归分析法分析碳添加后酶活性变化值与土壤初始有效氮含量之间的关系。
2 结果与分析
2.1 碳氮处理对土壤酶活性的影响
氮添加显著增加了土壤中有效氮含量,使有效氮含量平均值由4.47 mg/kg增加至11.67 mg/kg。施氮处理显著影响了土壤AP和LAP活性(表1)。氮添加下AP活性由542.63 nmol g-1h-1增加至1143.77 nmol g-1h-1;LAP活性则由29.60 nmol g-1h-1降至24.14 nmol g-1h-1,降低了18.4%;碳添加显著影响了AP、LAP和NAG活性,三者分别由407.20、21.92、20.56 nmol g-1h-1增加至1279.19、31.82和31.59 nmol g-1h-1,分别增加了214.1%、45.2%和53.7% (图1)。
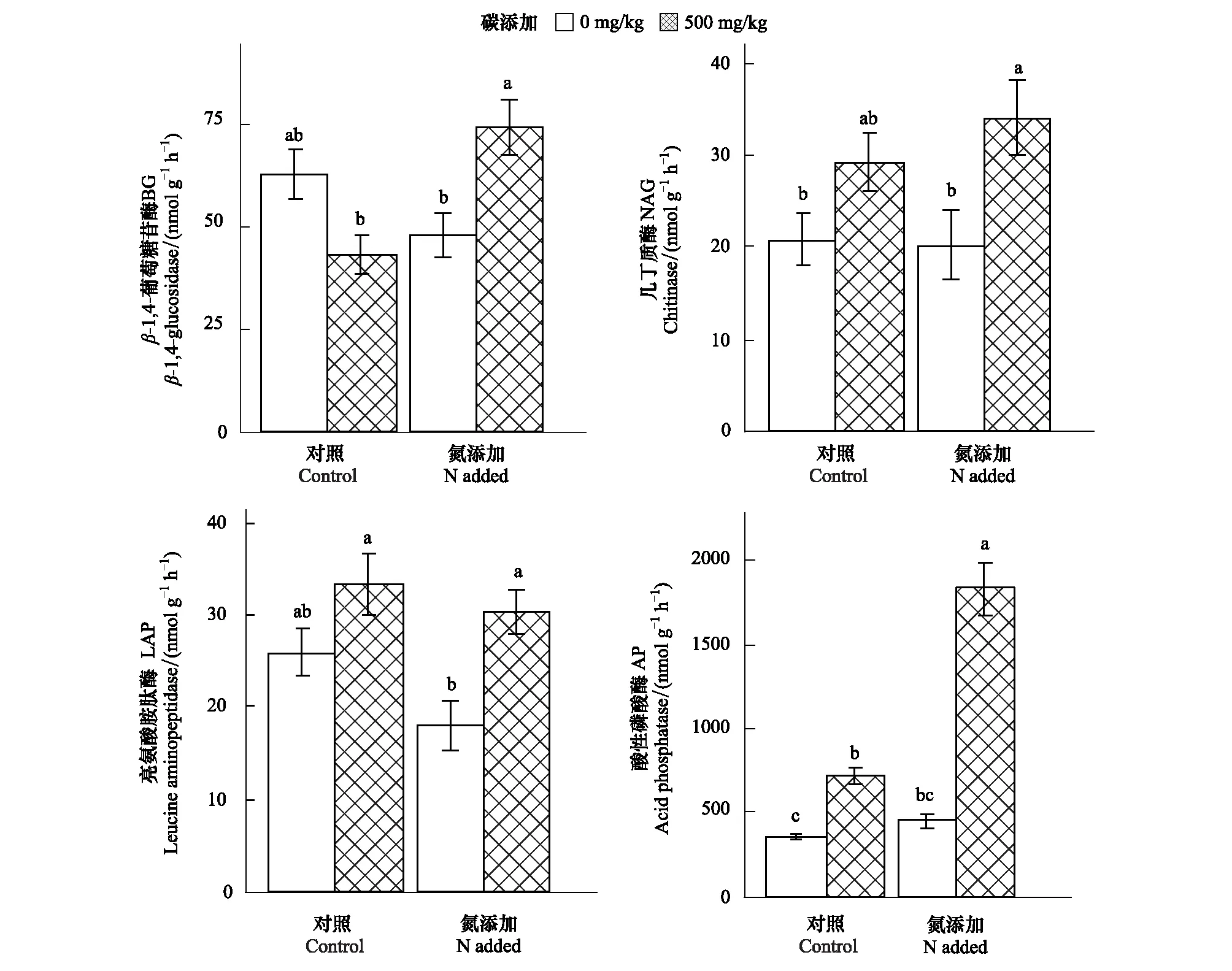
图1 碳氮添加下土壤酶活性(平均值±标准误)Fig.1 Soil enzyme activities (Mean±SE) under carbon and nitrogen additionsBG, β- 1,4-葡萄糖苷酶β- 1,4-glucosidase; NAG, 几丁质酶Chitinase;LAP亮氨酸胺肽酶Leucine aminopeptidase; AP, 酸性磷酸酶Acid phosphatase; 不同字母表示组间存在显著差异
碳氮交互作用显著影响了BG、AP和LAP活性 (表1)。在对照样方的土壤中,碳添加使BG活性由63.01 nmol g-1h-1降至43.24 nmol g-1h-1,降低了31.4%;在施氮样方的土壤中,碳添加使BG活性由48.09 nmol g-1h-1增加至74.27 nmol g-1h-1,增加了54.4%。对照样方中,碳添加AP和LAP活性影响较小,碳添加使AP活性为由358.88 nmol g-1h-1增加至726.38 nmol g-1h-1,使LAP活性由25.88 nmol g-1h-1增加至33.32 nmol g-1h-1,二者分别增加了102.4%和28.8%;而施氮样方的土壤中,碳添加下AP活性由455.53 nmol g-1h-1增加至1832.01 nmol g-1h-1,LAP活性由17.96 nmol g-1h-1增加为30.32 nmol g-1h-1,分别增加了302.2%和68.8% (图1)。回归分析表明,碳添加下AP和BG酶活性增加值与土壤初始有效氮含量显著正相关 (图2),其他酶活性增加值与土壤初始有效氮含量不相关。

图2 碳添加下土壤酶活性变化与土壤初始有效氮含量之间的关系Fig.2 Relationships between changes in soil enzyme activities and soil initial nitrogen availabilities under carbon additions
2.2 碳氮处理对C∶N∶P土壤酶化学计量学特征的影响
施氮处理显著降影响了土壤C∶P和N∶P水解酶化学计量关系 (表1)。氮添加下ln(BG)∶ln(AP)和ln(LAP+NAG)∶ln(AP)显著下降,分别由0.62和0.63降低为0.59和0.56。碳添加显著影响了C∶N和C∶P的水解酶化学计量关系(表1)。碳添加显著降低了ln(BG)∶ln(LAP+NAG)和ln(BG)∶ln(AP),使其分别由1.07和0.65降低为0.97和0.56 (图3)。

表1 碳(C)、氮(N)及其交互作用对土壤酶活性的影响
BG, β- 1,4-葡萄糖苷酶β- 1,4-glucosidase; NAG, 几丁质酶Chitinase;LAP亮氨酸胺肽酶Leucine aminopeptidase; AP, 酸性磷酸酶Acid phosphatase

图3 碳氮添加下土壤酶化学计量学特征(平均值±标准误)
Fig.3 Soil enzymatic stoichiometry under carbon and nitrogen additions (Mean±SE)
碳氮交互作用显著影响了C∶N和C∶P的水解酶化学计量关系 (表1)。在对照样方中碳添加使ln(BG)∶ln(LAP+NAG)由1.08降低为0.90,降低了16.9%;ln(BG)∶ln(AP)由0.69降低至0.56,降低了19.9%;而在施氮样方土壤中,碳添加下ln(BG)∶ln(LAP+NAG)由1.06降低为1.04,仅降低了1.9%;ln(BG)∶ln(AP)由0.60降低为0.57,仅降低了5.8% (图3)。
3 讨论
3.1 碳对土壤酶活性的限制
本研究发现,碳对土壤酸性磷酸酶、几丁质酶和亮氨酸胺肽酶活性具有较大的促进作用,表明碳是干热河谷土壤酶活性的限制因素。碳可以为土壤微生物的土壤酶合成提供能量,同时碳也是构成土壤酶的关键元素[8]。干热河谷植物生产力较低,土壤中有机质较为缺乏,导致土壤中可供微生物利用的碳不足,这在氮添加后可能显得更为突出。土壤酶活性是土壤养分循环的重要驱动力[10],也是土壤肥力的重要指标。碳对土壤酶活性的限制也可能存在其他生态系统中。全球范围的综合数据显示,根际土壤的土壤酶活性总体上可以比非根际土壤高出28%[23],根际土中的土壤酶活性增强的现象可能与根系分泌的碳化合物有关。事实上,植物根际土壤酶活性与根系的碳分泌量显著正相关[24],表明碳对多数生态系统中的土壤酶活性都可能具有限制作用。
3.2 碳氮交互作用对土壤酶活性的影响
碳氮交互作用表明碳对部分土壤酶活性的影响与氮有关。当碳氮添加后,土壤中的磷的限制作用日益突出,土壤微生物为了获取更多的磷从而合成酸性磷酸酶,促进磷从有机物中释放。这就表明植物根系分泌物或者植物枯落物对土壤酶活性的促进作用可能与氮含量有关。而另一方面,植物根系通过吸收土壤氮,造成根系周围氮的缺乏,这可能会影响根系分泌物对部分土壤酶活性的促进作用。相反,丰富的氮含量则可以加速磷的循环[25]。在氮沉降下,土壤中的氮含量不断增加,这将改变根际土壤的酶活性及其化学计量学特征,从而对植物养分吸收和土壤碳氮磷循环产生深远影响。
碳氮交互作用同样存在于β- 1,4-葡萄糖苷酶和亮氨酸胺肽酶,碳添加对这些土壤酶活性的促进作用主要发生在氮添加土壤中。β- 1,4-葡萄糖苷酶是水解纤维素的酶[10],可以为微生物提供必需的碳水化合物。本研究中添加葡萄糖使得碳对微生物生长的限制作用降低,从而降低了β- 1,4-葡萄糖苷酶活性。但是,在氮添加样方中,微生物对碳的需求仍然较大,促使微生物继续合成β- 1,4-葡萄糖苷酶。此外,碳添加还可能缓解了土壤对微生物生长的限制因素[7],极大地增加了氮添加土壤中的微生物量,导致β- 1,4-葡萄糖苷酶活性增高。
氮添加降低了亮氨酸胺肽酶活性,这与微生物分配的经济理论[26]相符。亮氨酸胺肽酶是氮循环的关键酶,可以降有机态氮分解,从而为植物和微生物提供可利用的无机态氮。氮添加以后,土壤中的无机态氮含量逐渐升高,氮元素不再是限制养分,因此可能造成土壤微生物对氮循环的酶合成下降。然而,碳添加对亮氨酸氨肽酶活性的促进作用与土壤初始氮含量并无显著关联,表明其他因素可能影响了碳添加的效应,比如土壤pH[27]。
已有的研究表明氮添加对土壤酶活性的影响存在很大的不确定性,存在正效应、负效应、或者没有作用[28]。氮添加对不同生态系统土壤酶活性的影响存在很大不同[29],这是否与不同生态系统的土壤碳限制程度有关呢?本文的研究结果表明:碳氮交互作用决定了土壤酶活性。碳源充足的土壤中亮氨酸胺肽酶活性不受氮添加的影响,而β- 1,4-葡萄糖苷酶和酸性磷酸酶活性则会受到氮添加的促进;而在碳源不足的环境中,氮添加则会降低亮氨酸胺肽酶活性,而对β- 1,4-葡萄糖苷酶和酸性磷酸酶活性的促进作用较小或者没有促进作用。此外,碳氮交互作用可能也是有机肥对土壤酶活性促进作用大于化学肥料[30- 32]的原因,毕竟有机肥含有大量的碳源物质。因此,以后的研究应当关注碳氮交互作用对土壤酶活性的影响。
由于碳、氮对不同酶活性影响的差异,导致了土壤碳氮磷水解酶化学计量学特征的变化。总体上碳添加降低了C∶N和C∶P的水解酶活性比,氮添加增加了C∶N的水解酶活性比,但是降低了N∶P的水解酶活性比,这与微生物分配的经济学理论相一致[26],即微生物倾向于分泌相关的酶来水解更为稀缺的养分。
4 结论
碳氮交互作用显著影响了干热河谷土壤的酸性磷酸酶、β- 1,4-葡萄糖苷酶和亮氨酸胺肽酶活性。碳添加对土壤酸性磷酸酶和β- 1,4-葡萄糖苷酶活性的促进作用与土壤氮含量有关。碳氮交互作用对土壤酶化学计量学特征也具有显著影响,碳添加虽然降低了对照样方C∶N和C∶P的水解酶活性比,但是在氮添加样方的土壤中这种效应不再显著,表明碳氮交互作用可能会影响该地区土壤碳氮磷循环的平衡。土壤酶化学计量学特征反映了土壤中的养分平衡,是影响土壤生物地球化学过程的关键驱动因素。碳氮交互作用的影响,表明在研究和认识生物地球化学循环中,需要更多维的角度,注重多元养分的交互作用。

