干旱对土壤剖面不同深度土壤CO2通量的影响
黄石德,叶功富,,林 捷,,阮宏华,*,游惠明,,许子乾,李媛媛,李庆晞,
1 南京林业大学生物与环境学院,南京 210037 2 福建省林业科学研究院,福州 350012 3 武夷山森林生态系统国家定位观测研究站,武夷山 354315 4 武夷山国家公园管理局,武夷山 354315
CO2是土壤空气的重要组成部分,土壤空气中CO2浓度一般是大气的几倍到数十倍[1]。土壤空气中的CO2主要源于土壤呼吸,土壤和空气中CO2浓度的巨大差异是不同深度土壤微生物分解和根系呼吸共同作用的结果[2]。而受土壤微生物和根系驱动的土壤CO2生产量有着时间、空间及土壤剖面垂直尺度上的变化[3]。然而,目前多数研究集中在表层土壤碳通量时间和空间尺度上[4- 7],有关土壤剖面尺度CO2通量的研究鲜见报道[8- 11]。此外,由于土壤碳通量是各土层CO2生产量的累加,而各土层有着不同生物、物理和化学特征[12],仅用表层温度敏感性指数Q10值表征土壤整体可能导致预测土壤碳库时产生较大误差[13]。因此,仅研究表层是不够的,不足以正确阐明土壤CO2通量真实的响应过程。区分不同深度土壤CO2通量及其温度敏感性是否存在土层深度的依赖性的认识,将有利于改善土壤碳通量模型的精度[14]。因此,为了更好认识土壤中碳的机制和精确预测土壤呼吸,计算土壤CO2通量的垂直分布是很有必要的[13]。
由于处于与空气接触的最前沿,多数表层土壤比底层土壤经历更大的土壤温湿度变化[12]。一方面表层土壤更容易变干,凋落物分解驱动可能比深层矿质土壤驱动更为敏感[15]。此外,源于表层土壤碳的输入通常高于底层,但底层土壤中来自根系部分的碳输入也很重要[16]。不同深度土壤CO2通量受到土壤温度、含水量和基质供应的共同驱动,而这些变量存在明显的垂直变化,不同深度土壤CO2通量对环境的响应有相当大的不确定性[3, 13]。目前,在土壤和空气界面的土壤碳通量常采用腔室法测定,而在某一特定深度CO2通量在野外无直接测定方法。梯度扩散法是一种基于菲克第一定律利用剖面浓度差异推算不同深度土壤CO2通量的间接方法[17-18]。在过去十年里,随着新型探头和设备的发展,促进了梯度扩散法在土壤气体通量研究中广泛应用[19-20]。
我国亚热带地区水热资源丰富,森林生产力高,有高的碳库和碳通量[21]。不同气候模型预测该地区干旱的强度和频率将呈加剧的趋势[22-24]。然而,有关土壤CO2通量垂直分布对干旱响应的研究鲜见报道[25]。此外,土壤碳通量对干旱的响应在生长季和非生长季间可能存在差异[26-27]。因此,本文以武夷山1450 m的针叶林(Coniferous Forest, CF)和650 m的常绿阔叶林(Evergreen Broadleaved Forest, EBF)为研究对象,利用穿透雨排除装置模拟生长季干旱试验,开展不同深度土壤CO2浓度的测定,利用梯度扩散法,估算不同深度土壤CO2通量。本研究的目的是为了(1)分析不同深度土壤CO2通量对干旱响应的差异;(2)分析不同深度土壤CO2通量温度敏感性对干旱响应的差异。
1 试验地概况
研究地点位于武夷山国家级自然保护区(27°33′—27°54′N, 117°27′—117°51′E)内,地处福建省的西北部,其东西宽22 km,南北长52 km,保护区面积56527 hm2。该地区属中亚热带气候,年平均气温12—18℃,年降雨量2000 mm左右[28],降雨多集中在3—8月。保护区拥有世界同纬度带现存面积最大、保存最完整的中亚热带常绿阔叶林生态系统,境内植被垂直带谱完整。
选择1450 m的针叶林(CF)及650 m的常绿阔叶林(EBF)作为试验样地。CF样地中黄山松(Pinustaiwanensis)为优势树种,占林分组成的80%,伴生树种有木姜子(Litseapungens)和高山杜鹃(Rhododendronlapponicum),样地密度2122株/hm2,平均胸径14.3 cm,平均树高9.6 m,胸高断面积33.9 m2/hm2。EBF样地中优势种是甜槠(Castanopsiseyrei)和米槠(Castanopsiscarlesii),占林分组成的65%,伴生树种有小叶赤楠(Syzygiumgrijsii)和青冈(Cyclobalanopsisglauca)等,样地密度1656株/hm2,平均胸径15.6 cm,平均树高11.7 m,胸高断面积31.5 m2/hm2。2014—2015年CF和EBF样地年均气温分别为12.10℃和15.63℃,降雨量分别为2461 mm和2641 mm,70%以上的降雨集中在3—8月(图1)。样地土壤理化性质见表1。

图1 CF和EBF样地2014年5月至2015年12月空气温度和降雨量的季节变化Fig.1 Seasonal variation of air temperature and throughfall in the CF and EBF sites between May 2014 and December 2015CF: 针叶林,coniferous forest; EBF: 常绿阔叶林,evergreen broadleaved forest. 阴影部分表示模拟干旱阶段
2 材料与方法
2.1 试验设计
在CF和EBF样地分别布设3个样方(30 m×30 m),每个样方相距100 m以上,其有相似的地形,坡度和植被类型。在每个样方中分别设置排除穿透雨(Throughfall exclusion, TFE)和对照处理(Control, CK)小样方,每个小样方3 m×3 m,相距10 m以上,避免不同样方间的交互作用。在CF和EBF样地分别布设了3个TFE和CK处理的小样方,共计布设12个小样方。2014年6月,在CF和EBF样地内布设6个便携3 m×3 m的排除穿透雨装置,这些装置是用镀锌钢管加工制作,装置的屋顶部分与坡面大致平行,支撑骨架上坡位一侧高度为3 m,下坡位为2 m,将其垂直埋于TFE处理小样方。本试验开展了连续两年的模拟生长季干旱试验,分别为2014年6月13日—9月12日和2015年3月15日—6月27日期间(即模拟生长季干旱阶段,期间塑料膜覆盖在排除穿透雨装置上),而试验的其余阶段移除塑料膜,使土壤重新获得降雨。2014年样地共计排除穿透雨91 d,CF和EBF样地分别减少穿透雨1054 mm和1436 mm;而在2015年排除穿透雨103 d,CF和EBF样地分别减少穿透雨1150 mm和1292 mm。

表1 武夷山针叶林和常绿阔叶林不同深度土壤理化性质
CF: 针叶林,coniferous forest; EBF: 常绿阔叶林,evergreen broadleaved forest. 括号内数值为标准误
2.2 不同深度土壤CO2浓度的测量
于2014年3月,在CF和EBF样地的TFE和CK处理中,用土钻在上述小样方内分别钻取深度为10、30 cm和50 cm的土壤孔洞,每个深度钻取3个,而后将略小于土壤孔洞的PVC管插入相应土层,回土压实。每根PVC管底端磨成尖形,便于插入土壤,并在其上2 cm的位置均匀分布若干通气孔,使相应土层土壤空气自由进入管内[19, 29]。每根PVC管均露出土壤表面20 cm,并用三通接头将每层的3根PVC管相连。每层3根PVC管起到混合特定深度CO2浓度的作用,减小土壤空间异质性。使用固体CO2检测器(GMT220系列,Vaisala公司,芬兰)测量不同深度土壤CO2浓度。测量时将CO2检测器插入管内,并用密封胶泥密封,即可测定不同深度土壤CO2浓度[30]。同时利用便携式CO2记录仪(K33,美国)测定0 cm处CO2浓度。从2014年6月至2015年12月,每月选择晴好天气,于8:00左右到翌日8:00,测定不同深度土壤CO2浓度。监测频率为每0.5 h采集1次数据,连续采集24 h以上。
2.3 土壤微气候环境的测定
于2014年5月,在CF和EBF样地的TFE和CK处理中,分别在10、30 cm和50 cm深度的土壤中安装ECHO土壤湿度传感器,每半个小时记录一次土壤湿度。温度传感器被置于土壤湿度相同深度检测10、30 cm和50 cm深度的土壤温度。在CF和EBF样地分别安装小气候观测系统(HOBO Weather Station Data Logger)用于观测样地内的降雨量和空气温度,在本研究的观测期间(2014年5月至2015年12月),每30 min记录1次。
2.4 细根生物量的测定
在CF和EBF样地的TFE和CK处理中进行细根生物量的取样。在每个样方中,分别随机选择3个样点,采用直径为3.8 cm的根钻由上至下分3层(0—10、10—30、30—50 cm)钻取土芯样品,将采回的土芯分别放入自封袋中,同一样方相同层次的土芯混合后编号。采样前需对土壤表面新鲜和半分解的凋落物残体进行清除。土芯分别在2014和2015年的9月采集。每份土芯样品都浸泡过夜,冲洗过筛,并根据外形、颜色和弹性等人工挑选出细根[31]。将挑选出的细根在60℃下烘干至恒重。
细根生物量(g/m2)=平均每根土芯细根干质量×104/[π(3.8/2)2]。
2.5 表层土壤碳通量测定
在测定不同深度CO2浓度的同时,使用Li- 8100便携式碳通量测量系统(Li-Cor Inc., Lincoln, NE, USA)测量表层土壤碳通量,用于检验用扩散法计算土壤碳通量的准确程度。于2013年12月,在每个小样方内永久性安装2个PVC土壤呼吸圈(直径20 cm,高7.5 cm,插入土层深度3—5 cm),共布设24个土壤呼吸圈。定期清理土壤呼吸圈内新生的植物和凋落物,并保持其在整个试验期间固定不动,减少机械扰动的影响。从2014年6月至2015年12月,每月选择晴朗无风天气,使用Li- 8100便携式碳通量测量系统测定土壤呼吸,在8:00—12:00间测定土壤碳通量,每次测定持续3—4 h。为了避免日变化趋势的混合效应,碳通量测定的顺序是随机的,但干旱处理的测定总是在相应对照处理后进行[32]。每个圈测定2次,每次持续120 s,在两次测定期间有30 s的间隔,期间腔室自动开放允许腔室空气与周边空气的自由流通。
2.6 数据分析
采用Fick扩散第一定律计算不同深度土壤CO2通量(Fs,mol m-2s-1)[19],公式如下:
(1)
Ds=εDa
(2)
式中,Ds为土壤中CO2的扩散系数(m2/s);C(z)为深度z(m)土层CO2浓度(mol/m3);ε为相对气体扩散系数;Da为自由大气中CO2的扩散系数,Da=1.47×10-5m2/s。
本研究采用以下5种常见的ε模型来推算不同深度土壤CO2通量[30,33]:
Penman模型:
ε=0.66φ-θ
(3)
Marshall模型:
ε=φ-θ1.5
(4)
Millington模型:
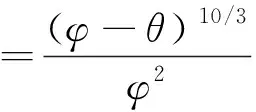
(5)
Moldrup- 1997模型:
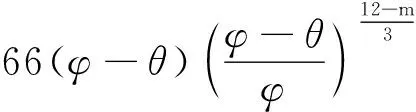
(6)
Moldrup- 2000模型:

(7)
式中,θ为土壤体积含水量(cm3/cm3);φ为土壤孔隙度(φ=ρb/ρm,其中ρb为土壤容重(g/cm3),ρm为土壤比重,矿质土壤ρm=2.65 g/cm3);m为常数3。
土层CO2生产量可以通过土层净CO2通量估算,也就是土层上下边界的土壤CO2通量差层与原本储存在土层中的CO2之和[34]。由于土层中储存的CO2量远小于土层边界的CO2通量,因此在计算各土层CO2生产量时对土层中储存的CO2量忽略[35]。
PCO2=Fi-Fi-1
(8)
式中,Fi和Fi-1分别为i层土层上下边界CO2通量。
各土层CO2生产量贡献率的计算公式为:
C=PCO2/Ft
(9)
温度敏感性指数Q10利用指数函数计算
Fi=αi·eβiTi
(10)
Q10,i=e10βi
(11)
式中,Fi为第i层土壤CO2通量,αi、βi分别为第i层相关变量,Q10,i为第i层温度敏感性指数,Ti为第i层土壤温度。
所有数据图表均为Origin 8.5处理完成,运用SPSS 19.0统计分析软件进行方差分析和回归分析。采用单因素方差分析(One-way ANOVA)比较不同深度以及干旱和对照处理土壤温度、湿度、土壤CO2浓度和通量的差异水平,显著性水平设定为α=0.05。以梯度扩散法计算获得的结果与Li- 8100腔室法测量的通量进行线性拟合。
3 结果与分析
3.1 不同深度土壤温度、土壤湿度和CO2浓度季节变化
如图2所示,整个试验期间,CF样地CK处理10、30 cm和50 cm深度土壤温度分别为13.84、14.07℃和14.10℃,EBF样地CK处理10、30 cm和50 cm深度土壤温度分别为17.08、17.23℃和17.34℃。排除穿透雨处理对各层土壤温度的影响均不显著(P>0.05),使CF样地10、30 cm和50 cm深度土壤温度分别降低0.03、0.11℃和0.12℃;使EBF样地10、30 cm和50 cm深度土壤温度分别降低0.08、0.08℃和0.07℃。如图3所示,在干旱处理期间,除EBF样地50 cm深度外,排除穿透雨处理均显著减少各层土壤湿度(P<0.05),其中CF样地10、30 cm和50 cm深度土壤湿度分别较CK处理减少18.0%、12.7%和12.9%,而EBF样地10、30 cm和50 cm深度土壤湿度分别较CK处理减少18.3%、11.5%和6.6%。如图4所示,CF和EBF样地CK处理不同深度土壤CO2浓度均表现与土壤温度相似的季节变化格局。随着土壤温度的增加,不同深度土壤CO2浓度逐渐升高,在8—9月间达到峰值;12月至1月间最小值。如表2所示,随着土壤深度的增加,土壤CO2浓度随之增加。在整个试验观测期间,CF样地CK处理10、30 cm和50 cm深度土壤CO2浓度分别为(3624.2±238.0)、(5623.7±373.5) μmol/mol和(7128.4±402.5) μmol/mol,CO2浓度的变异幅度(最大值/最小值)分别为7.57、5.40和5.64;EBF样地10、30 cm和50 cm深度土壤CO2浓度分别为(5546.6±207.9)、(8645.0±295.7) μmol/mol和(9993.4±474.4) μmol/mol,CO2浓度的变异幅度分别为7.63、5.14和5.13。本研究中地表空气CO2浓度变化幅度较小,CF和EBF样地变异幅度分别为1.14和1.24,未受到土壤中CO2浓度的影响。

图2 TFE和CK处理不同深度土壤温度的季节变化格局Fig.2 Seasonal variation of soil temperature in different soil depth from the TFE and CK treatements TFE:排除穿透雨 Throughfall exclusion; CK:对照 Control

图3 TFE和CK处理不同深度土壤湿度的季节变化格局Fig.3 Seasonal variation of soil moisture in different soil depth from TFE and CK treatements

图4 TFE和CK处理不同深度土壤CO2浓度的季节格局Fig.4 Seasonal variation of soil CO2 concentration in different soil depth from the TFE and CK treatments
模拟干旱期间,TFE处理使CF样地10、30 cm深度土壤CO2浓度分别减少21.2%、12.4%,而50 cm土壤CO2浓度增加8.9%;使EBF样地10、30 cm和50 cm深度分别减少61.2%、59.8%和56.7%。如表2所示,在整个试验观测期间,除CF样地50 cm深度外,TFE处理使CF和EBF样地土壤CO2浓度显著减少(P<0.05),其中CF样地10 cm和30 cm深度土壤CO2浓度分别减少11.4%和6.1%,EBF样地10、30 cm和50 cm深度土壤CO2浓度分别减少47.7%、45.5%和41.8%。

表2 TFE和CK处理不同深度土壤CO2浓度/(μmol/mol)
TFE: 排除穿透雨 Throughfall exclusion; CK: 对照 Control. 小写字母不同表示同一深度土壤不同处理差异显著,大写字母不同表示同一处理不同深度土壤差异显著
3.2 扩散法与腔室法结果对比
使用GMT220系列CO2浓度检测器原位连续测量不同深度土壤CO2浓度的变化,并利用Fick第一扩散法计算碳通量。本研究选择5种广泛使用的气体扩散系数计算土壤CO2通量与Li- 8100实测值结果进行对比。结果发现,Moldrup- 2000模型的计算结果与实测值最接近。在后续计算中,采用Moldrup- 2000模型计算通量分析不同深度土壤CO2通量的变化。
如图5所示,在CF和EBF样地CK处理两种方法获得的土壤碳通量之间存在较好的线性相关性,决定系数R2分别为0.919和0.846;而在TFE处理两个样地的决定系数R2略为下降,但两种方法仍表现为极显著相关(P<0.01)。采用梯度法估算CF样地TFE和CK处理的表层土壤CO2通量分别比腔室法高0.37和0.11 μmol m-2s-1,分别高估15.5%和3.5%;而在EBF样地则分别比腔室法高0.28和0.83 μmol m-2s-1,分别高估10.9%和19.9%。

图5 梯度法与Li- 8100碳通量数据拟合分析Fig.5 Fitting analysis on CO2 flux between gradient method and data from Li- 8100
3.3 不同深度土壤CO2通量的季节变化
如图6所示,CF和EBF样地的对照(CK)处理不同深度土壤CO2通量与土壤温度有基本一致的季节变化格局(图2)。CF样地CK处理10、30 cm和50 cm深度土壤CO2通量最大值均出现在8月,分别为5.89、1.85 μmol m-2s-1和0.76 μmol m-2s-1,而最小值出现在12—次年1月间,分别为0.51、0.18 μmol m-2s-1和0.14 μmol m-2s-1。EBF样地CK处理10、30 cm和50 cm深度土壤CO2通量最大值出现在7—8月,分别为8.53、2.08 μmol m-2s-1和1.58 μmol m-2s-1,而最小值出现在12月,分别为1.02、0.37 μmol m-2s-1和0.23 μmol m-2s-1。

图6 TFE和CK处理不同深度土壤CO2通量的季节变化Fig.6 Seasonal variation of soil CO2 flux in vertical profiles from the TFE and CK treatments
如表3所示,TFE处理使CF和EBF样地各土层CO2通量均显著减少(P<0.05)。试验观测期间CF样地TFE处理10、30 cm和50 cm深度土壤CO2通量均值分别为2.40、0.78 μmol m-2s-1和0.33 μmol m-2s-1,分别比CK处理相应土层低21.3%、13.3%和17.5%;而在EBF样地TFE处理10、30 cm和50 cm深度土壤CO2通量均值分别为2.58、0.88 μmol m-2s-1和0.75 μmol m-2s-1,分别比CK处理相应土层低38.1%、26.7%和11.8%。

表3 TFE和CK处理不同深度土壤CO2通量
小写字母不同表示同一土层不同处理差异显著,大写字母不同表示同一处理不同土层差异显著
3.4 不同深度土壤CO2生产量的贡献
如图7所示,CF样地CK处理10、30 cm和50 cm深度土壤CO2生产量分别占总CO2生产量的53.5%、37.7%和8.8%,而TFE处理10、30 cm和50 cm深度分别占53.7%、36.2%和10.1%。EBF样地CK处理10、30 cm和50 cm深度土壤CO2生产量分别占总CO2生产量的55.7%、39.7%和4.7%,而TFE处理10、30 cm和50 cm深度分别占58.5%、38.5%和2.9%。CF样地CK处理10、30 cm和50 cm深度细根生物量分别为98.04、45.97 g/m2和17.04 g/m2,分别占总细根生物量的60.9%、28.5%和10.6%;而TFE处理10、30 cm和50 cm深度细根生物量的比例分别为53.7%、34.7%和11.6%。EBF样地CK处理10、30 cm和50 cm深度细根生物量分别为124.12、55.98 g/m2和17.85 g/m2,分别占总细根生物量的62.7%、28.3%和9.0%;而TFE处理10、30 cm和50 cm深度细根生物量的比例分别为58.6%、31.9%和9.6%。

图7 TFE和CK处理土壤CO2生产量和细根生物量的垂直分布Fig.7 Vertical distribution in soil CO2 production and fine root biomass from TFE and CK treatments标准棒为标准误;*表示P<0.05;**表示P<0.01;ns表示不显著
3.5 不同深度土壤CO2通量温度敏感性
如图8所示,CF和EBF样地CK处理土壤CO2通量的Q10值随土层深度的增加而逐渐减小,其中CF样地从浅层4.10减少到深层1.95;EBF样地从浅层3.18减少到深层2.54。模拟干旱对不同海拔不同深度Q10值的影响并不一致。在CF样地,干旱处理显著减少了浅层土壤的Q10值(P=0.02),而对深层土壤影响不显著(30 cm:P=0.30; 50 cm:P=0.23);在EBF样地,干旱处理显著减少深层土壤的Q10(30 cm:P=0.02; 50 cm:P=0.01),而对浅层土壤影响不显著(P=0.32)。

图8 不同深度土壤CO2通量温度敏感性Fig.8 Temperature sensitivity of soil carbon flux in different soil depth under CF and EBF sites标准棒为标准误;*表示P<0.05;ns表示不显著
4 讨论
4.1 不同深度土壤CO2浓度和CO2通量对干旱的响应
本研究中土壤CO2浓度随土层深度的增加呈递增的趋势,这主要是由于土壤扩散率随深度的增加迅速下降所致。多数森林土壤剖面浓度变化均观察到类似的现象[3,30,36-37]。在加拿大温哥华54年生的花旗松中,观察到随土层深度的增加,土壤CO2浓度随之增加[11]。本研究中,除了CF样地50 cm土层外,TFE处理使CF和EBF样地不同深度土壤CO2浓度均显著减少。首先,干旱造成了土壤孔隙度增加,促进了大气和土壤中气体的交换,这可能解释干旱处理土壤CO2浓度显著减少。在日本的温带落叶林中,土壤CO2浓度随土壤的变干逐渐减少,这被归因为该阶段降雨较少引起土壤水分亏缺[12]。另一方面,长期干旱可能导致细根生物量的大量死亡[38],进而减少了源于根系自养呼吸CO2通量[39]。此外,干旱使土壤微生物活性减弱,降低土壤有机质分解[40],减少土壤空气中CO2的来源。而本研究中,模拟干旱对CF样地50 cm土层CO2浓度影响不显著,这可能与CF样地海拔较高有关,其有较低的土壤温度(图2),削弱了干旱对土壤CO2浓度的影响。另一方面底层土壤受干旱影响较弱,土壤温湿度等环境因素处于较稳定的水平(图2和图3),这可能使干旱对CF样地底层土壤的CO2浓度影响较弱。本研究中干旱处理使CF和EBF样地各土层CO2通量均显著减少,这可能被归因为干旱引起的气体扩散率的减少[25]。在日本的温带针叶林中也观察到类似的现象,他们发现较少降雨的8月,使表层CO2生产量减少了40%[12]。另一方面,不同深度土壤CO2通量均由微生物呼吸和根系自养呼吸两部分组成[41],干旱可能减少微生物和根系的活性[25],这也可能解释本研究中各层土壤CO2通量减少。
4.2 不同深度土壤CO2生产量的贡献
本研究中CF和EBF样地CK处理10 cm深度土壤CO2生产量分别占CO2总生产量的53.5%和55.7%,表明本研究中两个样地土壤CO2生产量主要集中在最上层10 cm土壤中。这可能与表层土壤含有较多的细根生物量和较高的土壤有机碳含量有关。如图6所示,CF和EBF样地中最上层10 cm土壤中的细根生物量分别占总细根生物量的60.9%和62.7%;而最上层10 cm土壤有机碳分别占总土壤有机碳的39.0%和37.1%(表1)。在50年生的欧洲赤松中,发现87%的CO2生产量集中在0—30 cm土层,这与细根和土壤有机碳库的垂直分布类似,分别有66%的细根生物量和81%的土壤有机碳库集中在该土层[42]。在加拿大54年生的花旗松超过75%的CO2生产量来源于土壤表层20 cm的土层,而底层土壤(50 cm)的贡献很小[11]。在北方森林A、B和C层分别占总CO2生产量的69.9%、19.8%和10.4%[36]。在美国的混交硬木林也观察到类似的现象,保守估计有40%—48%的CO2生产量来源于O层[3]。本研究中CF和EBF样地CK处理50 cm深度土壤CO2生产量分别占总生产量的8.8%和4.7%,这可能是由于该层土壤有较低的细根生物量,另外深层土壤有更强的土壤有机质的物理保护,避免微生物的分解利用[43]。
4.3 不同深度土壤CO2通量温度敏感性
本研究中土壤CO2通量的温度敏感性随土层深度的增加而呈逐渐减小,其中CF样地浅层土壤温度敏感性(4.10)显著高于深层(1.95);EBF样地浅层(3.18)显著高于深层(2.54),这可能是由于随着土壤深度的增加,难分解碳所占碳库比例增加,底物质量相对较低[9],因此土壤CO2通量的温度敏感性随土壤深度的增加逐渐降低。在日本名古屋的温带落叶林中观察到类似的现象,浅层土壤温度敏感性(6.39)显著高于底层土壤(1.63),他们把其归因为表层土壤的微生物群落更显著的季节变化以及根系呼吸的温度依赖性随植物生理的变化而变化[13]。也有报道与本研究结果相反,美国的乔治亚州发现随土层深度的增加温度敏感性逐渐增加,他们认为这可能是由于随土层深度增加土壤温度变化幅度减少引起的[18]。在温带森林土壤中观察到O层CO2生产量比矿质层有更低的温度敏感性[3],这可能反映了根系生长和根系的输入在矿质土壤层中比O层有相对更大的重要性。也有研究报道底层更高的温度敏感性还与湿度的限制作用和养分可用性等因素有关[44-45]。
本研究中排除穿透雨显著减少了CF样地浅层土壤CO2通量的温度敏感性,而对深层土壤影响不显著。这一方面可能是由于CF样地浅层土壤细根生物量比深层土壤减少的更为显著,而这限制了浅层土壤基质的供应[46];另一方面浅层土壤干旱引起的水分亏缺更为显著[3],增加了浅层土壤基质扩散的阻力,减少了基质、胞外酶和分解相关微生物间的接触,削弱了浅层土壤的温度敏感性[32]。而在EBF样地排除穿透雨显著减少了深层土壤的温度敏感性,而对浅层土壤影响不显著,这表明了除了浅层土壤外,开展底层土壤CO2通量的研究是非常有必要的,有利于改善干旱情境下土壤碳通量模型的精度[14]。
5 结论
本研究中CF和EBF样地土壤CO2浓度均随土壤深度的增加而升高。CF和EBF样地对照处理10 cm土壤CO2生产量分别占总生产量的53.5%和55.7%。干旱处理使CF和EBF样地不同深度土壤CO2通量均显著减少。本研究中土壤CO2通量的温度敏感性值均随土层深度增加而减少。干旱处理显著减少了CF样地浅层土壤CO2通量的Q10值,对深层土壤影响不显著;而在 EBF样地显著减少了深层土壤的Q10值,对浅层土壤影响不显著。表明干旱处理后,浅层和深层土壤对土壤温度的响应发生改变,即浅层和深层土壤的温度敏感性对干旱处理的响应机制不同。未来需进一步加强不同土层土壤有机碳组成和来源及根系质量等生物因子及对气候变化响应的研究,以期解析垂直剖面土壤碳通量的调控机理。
致谢:武夷山国家公园管理局金昌善、徐自坤对本研究野外调查给予帮助,特此致谢。

