槲皮黄酮改善心肌细胞肥大过程中对线粒体功能及动力学的影响
吴 舜 ,陈明君 ,周 燕
(1.武汉市新洲区人民医院内分泌科,武汉 430400;2.武汉市新洲区人民医院心内科,武汉 430400)
随着对心脏疾病研究的不断深入,心肌细胞能量代谢紊乱及凋亡的研究已成为当前热点。心肌细胞能量代谢的主要场所在线粒体,而且细胞凋亡的起始也发生在该细胞器[1]。线粒体功能障碍会导致心力衰竭(心衰)的发生发展,因此改善线粒体功能是治疗心衰的重要环节[2]。线粒体功能障碍及其动力学失衡是心肌肥厚发生的重要诱导因素[3],因为线粒体在心肌细胞能量代谢、信号传导、细胞增殖等方面发挥重要作用。槲皮黄酮是黄酮类活性物质,表现出抗氧化、抗炎症及参与免疫调节等方面的作用[4-5]。除此之外,槲皮黄酮还可以改善线粒体功能障碍、降低氧化应激损伤,具有保护心肌细胞免受损伤的作用[6]。本研究中采用血管紧张素II(AngII)诱导原代心肌细胞肥大,观察槲皮黄酮对心肌细胞能量代谢紊乱的保护作用及其对线粒体功能障碍、稳定线粒体动力学平衡的影响。
1 材料及方法
1.1 动物 健康雄性SD大鼠(1~3 d)购自北京维通利华实验动物中心,许可证号SCXK(京)2006-0009。
1.2 主要试剂及仪器 槲皮黄酮(中国食品药品检定研究院,批号100357-201603),DMEM培养基、II型胶原酶、FBS(美国Gibco公司),胰蛋白酶(美国Hyclone公司),AngII(美国Sigma公司),CCK8试剂盒(Ameresc公司),BCA试剂盒(上海碧云天公司),三磷酸腺苷(ATP)试剂盒、JC-1试剂盒(英国Abcam公司),兔抗鼠视神经萎缩蛋白(OPA1)、动力相关蛋白 1(Drp1)、磷酸化动力相关蛋白(p-Drp1)及 βactin抗体购自美国Cell Signaling Technology公司,HRP标记羊抗兔IgG抗体(武汉谷歌生物公司)。Victor3 1420 Multilable Counter酶标仪(DX540,美国),DYCZ-24DN型电泳仪(北京六一仪器厂,中国),4000B倒置相差显微镜及成像系统(Leica,德国),HERA cell CO2细胞培养箱(Heraeus,德国),自动X光片机UPV凝胶成像系统(GelDoc-It/EC3)。
1.3 原代心肌细胞的培养和鉴定 原代心肌细胞分离、培养和鉴定参考文献[7],将心肌组织消化为单细胞悬液后,差速离心分离加入含20%FBS及0.1mmol/L5-溴脱氧尿嘧啶的DMEM培养液培养细胞。待细胞生长至第4天进行心肌细胞鉴定,采用SABC法,细胞首先用大鼠α-横纹肌动蛋白抗体孵育,DAB显色后,阳性为α-心肌肌动蛋白。
1.4 药物干预浓度筛选 参照多篇研究文献,初步确定 AngII浓度分别为 1×10-5、1×10-6、1×10-7mol/L,槲皮黄酮浓度为 5、10、20 μmol/L,分别处理心肌细胞48、72 h后采用BCA试剂盒检测蛋白总含量,采用CCK8试剂盒分析药物对细胞的毒性,每组实验做4个复孔,重复实验6次。将确定的最佳药物浓度用于后续研究。
1.5 心肌细胞蛋白浓度及细胞直径测定 使用1×10-5mol/L浓度AngII和10 μmol/L槲皮黄酮干预心肌细胞48、72 h后,采用倒置显微镜观察、拍照及测量细胞直径,并采用BCA试剂盒检测蛋白总含量,每次设3个复孔,重复实验6次。
1.6 ATP含量测定 将6孔板细胞用AngII、槲皮黄酮干预 72 h 后裂解细胞,4 ℃ 、1.2×104r/min 离心12 min取上清。在96孔板中加入100 μL ATP检测工作液,室温放置5 min。再加入50 μL样品或标准品,迅速混匀。采用酶标仪测定RLU值。
1.7 活性氧(ROS)水平测定 细胞经药物干预72 h后,采用10 μmol/L DCFH-DA溶液重悬,37℃细胞继续培养20 min。每3~5 min颠倒一下,让探针与细胞充分接触。用培养基洗涤细胞3次,最后用200 μL磷酸缓冲盐(PBS)溶液重悬,采用荧光酶标仪测定。其中激发波长为488 nm,发射波长为525 nm。
1.8 线粒体膜电位(MMP)测定 具体操作步骤参照试剂盒说明书进行荧光法测定。荧光显微镜滤波器激发波长为490 nm,散发波长为590 nm,可见亮红色荧光;激发波长为490 nm,散发波长为530 nm,可见绿色荧光。
1.9 蛋白表达测定 药物干预细胞后,收集细胞裂解,采用BCA法测定蛋白总浓度后,每孔上样50 μg蛋白进行电泳、电转、封闭,然后将条带放入含OPA1、Drp1及p-Drp1的抗体溶液中(稀释比 1∶1 000),4℃振摇过夜,次日用HRP标记二抗室温反应1.5 h后,TBST洗膜3次后ECL显色,进行蛋白表达分析。
1.10 数据统计分析 采用SPSS 20.0软件进行统计分析,实验数据使用均数±标准差s)表示,多组间比较采用单因素方差分析,组间两两比较,方差齐时采用LSD法,方法不齐时采用Dunnett’s T3法,P<0.05为差异具有统计学意义。
2 结果
2.1 AngII浓度筛选 不同浓度AngII作用心肌细胞48、72 h后,CCK8法检测细胞的吸光度OD值没有明显变化,说明AngII对心肌细胞没有毒性作用。并且1×10-5mol/L浓度AngII对心肌细胞蛋白含量相对于空白组显著升高,差异有统计学意义(P<0.05);因此,1×10-5mol/L浓度AngII为本研究的有效干预剂量。见表1。
表1 不同浓度AngII对蛋白浓度的影响(Tab.1 Effects of varying concentrations of AngII on protein level(

表1 不同浓度AngII对蛋白浓度的影响(Tab.1 Effects of varying concentrations of AngII on protein level(
注:与空白组比较,*P<0.05。
?
2.2 槲皮黄酮浓度筛选 5、10、20 μmol/L槲皮黄酮与1×10-5mol/L浓度AngII共同作用心肌细胞48、72 h 后,10、20 μmol/L 槲皮黄酮可明显降低心肌细胞中蛋白浓度,与模型组相比差异有显著性(P<0.05);20 μmol/L 槲皮黄酮对心肌细胞具有明显的毒性作用,10 μmol/L槲皮黄酮对心肌细胞没有明显的毒性作用,因此,选用10 μmol/L槲皮黄酮、1×10-5mol/L AngII进行后续实验。见表2。
表2 不同浓度槲皮黄酮对蛋白浓度的影响Tab.2 Effects of varying concentrations of quercetin on protein level

表2 不同浓度槲皮黄酮对蛋白浓度的影响Tab.2 Effects of varying concentrations of quercetin on protein level
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05。
?
2.3 槲皮黄酮对心肌细胞肥大的影响 与空白组比较,在48、72 h两个时间点模型组心肌细胞总蛋白浓度显著升高(P<0.05),心肌细胞直径明显增大(P<0.05),提示心肌细胞肥大模型构建成功。在上述时点槲皮黄酮组心肌细胞中蛋白浓度均显著降低(P <0.05),而细胞直径只在 72 h时显著减小(P<0.05),48 h时细胞直径也有减小,但与模型组比较没有统计学差异(P >0.05)。见表 3。
2.4 槲皮黄酮对心肌细胞中ATP、ROS及MMP的影响 实验检测了72 h时间点槲皮黄酮对心肌细胞中ATP、ROS及MMP的影响,见表4。模型组中ATP水平和线粒体膜电位MMP相对空白组明显降低(P<0.05),ROS 含量明显增高(P <0.05);槲皮黄酮处理心肌细胞72 h后,ATP水平和线粒体膜电位MMP明显升高,ROS含量明显降低(P <0.05)。见表 4。
表3 槲皮黄酮对心肌细胞总蛋白含量及细胞直径的影响Tab.3 Effects of quercetin on total protein content and cell diameter of cardiocytes

表3 槲皮黄酮对心肌细胞总蛋白含量及细胞直径的影响Tab.3 Effects of quercetin on total protein content and cell diameter of cardiocytes
注:与空白组比较,*P <0.05;与模型组比较,#P <0.05。
?
表4 槲皮黄酮对心肌细胞中ATP、ROS及MMP的影响Tab.4 Effects of quercetin on ATP,ROS and MMP in cardiocytes

表4 槲皮黄酮对心肌细胞中ATP、ROS及MMP的影响Tab.4 Effects of quercetin on ATP,ROS and MMP in cardiocytes
注:与空白组比较,*P <0.05;与模型组比较,#P <0.05。
?
2.5 槲皮黄酮对心肌细胞中OPA1、Drp1及p-Drp1蛋白表达的影响 实验检测了72 h时间点槲皮黄酮对心肌细胞中OPA1、Drp1及p-Drp1蛋白表达的影响,见图1。模型组中OPA1蛋白表达量显著降低,而p-Drp1蛋白表达量显著升高,与空白组比较差异有统计学差异(P<0.05);槲皮黄酮处理心肌细胞72 h后,OPA1蛋白表达量显著增高,而p-Drp1蛋白表达量显著降低,与模型组比较差异有统计学意义(P <0.05)。
3 讨论
ROS是机体多个器官组织都存在的信号刺激子,ROS的堆积能导致心肌细胞氧化损伤,甚至引发细胞凋亡,然而线粒体是ROS产生的主要细胞器,线粒体功能状态对保证细胞机能是否正常起着关键作用[8]。心肌肥厚的发病机制并未完全得以解释,而学者提出其与线粒体的功能密切相关,因为能量代谢紊乱、氧化损伤及线粒体膜电位MMP降低都会引起心肌细胞肥厚。AngII属于肾素血管紧张素系统的关键分子,它能够介导心肌细胞ROS过多产生,从而诱导心肌细胞肥大及凋亡[9]。AngII能够作用于NADPH氧化酶途径诱导心肌细胞ROS的产生进而促使蛋白质合成。AngII不直接引起心肌能量代谢障碍,而是诱导ROS大量产生,导致心肌肥大及线粒体结构、功能损伤。笔者采用1×10-5mol/L浓度AngII作用于心肌细胞48、72 h后,心肌细胞总蛋白浓度明显升高、细胞直径明显增大,说明AngII可以很好地构建心肌细胞肥大模型。然而经过10 μmol/L槲皮黄酮能够改善心肌细胞肥大,表现在减少了细胞总蛋白浓度及细胞大小。AngII刺激心肌细胞时,会导致线粒体功能损伤,ATP生成减少,AngII持续的刺激会导致线粒体ROS过度产生,后者进而损伤氧化-还原的动态平衡,进一步引起线粒体膜通透性转换孔开放,导致膜内外离子分布紊乱,引起线粒体膜电位MMP降低[10]。本研究发现1×10-5mol/L 浓度 AngII作用心肌细胞48、72h后,心肌细胞内ATP水平及MMP显著降低,并且ROS含量显著升高,进一步论证了前期报道结果。然而经过槲皮黄酮处理心肌细胞72 h后,细胞内ATP水平及MMP显著升高,而且ROS含量显著降低,说明槲皮黄酮可通过抑制ROS的产生从而改善线粒体的能量代谢。
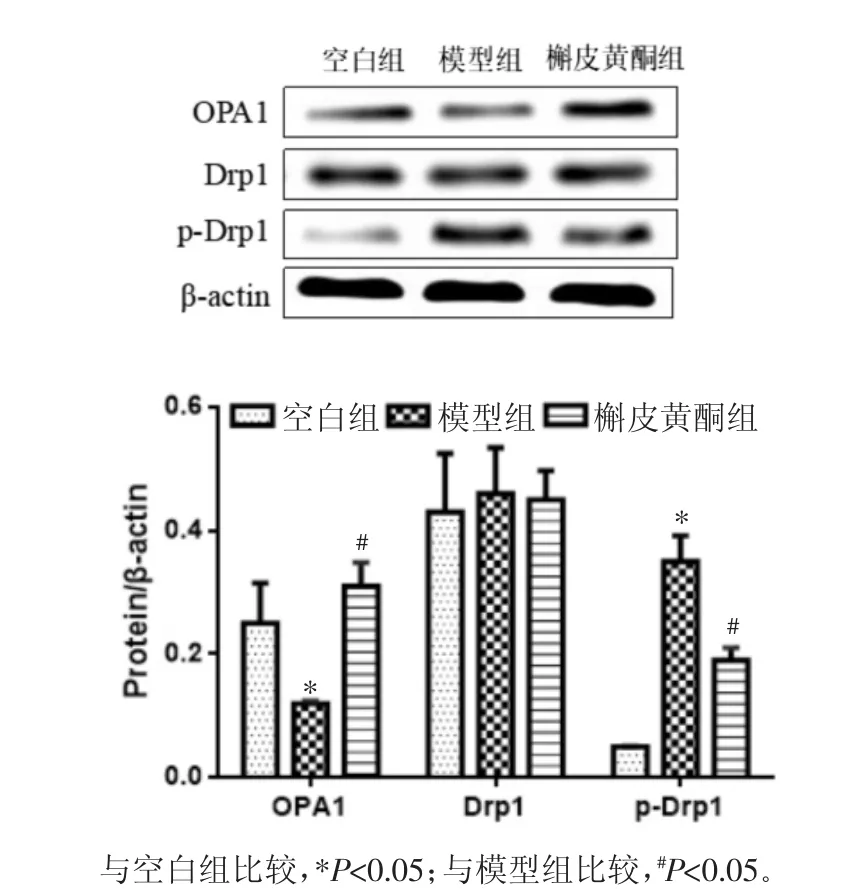
图1 槲皮黄酮对心肌细胞中OPA1、Drp1及p-Drp1蛋白表达的影响s,n=6)Fig.1 Effects of quercetin on expressions of OPA1,Drp1 and p-Drp1 in cardiocytess,n=6)
线粒体的融合-分裂由动力蛋白相关的GTP蛋白酶精细调控,包括线粒体融合相关蛋白(Mfn)、线粒体分裂相关蛋白Drp1和线粒体分裂蛋白1,而Drp1在心肌细胞能量代谢及线粒体自噬中起着关键作用[11]。Drp1蛋白磷酸化可使该蛋白转运到线粒体膜外,引起线粒体降解,导致心肌细胞氧化磷酸化水平降低,ATP合成异常,MMP下降,进而诱导心肌细胞肥大[12]。本研究中AngII能诱导OPA1表达降低,Drp1蛋白磷酸化水平升高,进而引起线粒体片段化,然而槲皮黄酮能够改变上述蛋白表达的水平,进而改善心肌细胞的肥大。总之,槲皮黄酮对AngII引起的心肌细胞肥大具有保护作用,其作用机制可能与降低心肌细胞线粒体功能障碍、稳定线粒体动力学平衡相关。

