甲壳素对葡萄园土壤微生物群落组成的影响
李芬,董书甲,赵攀,赵新节,何熹
(齐鲁工业大学山东省微生物工程重点实验室,山东济南 250353)
甲壳素,又名几丁质,是一类天然多糖类高分子化合物,具有很好的生物安全性、生物相容性和生物可降解性,被广泛应用到医药、食品、农业、保健品、化妆品和纺织等众多领域之中[1]。作为土壤改良剂,甲壳素含有丰富的碳和氮元素,使得甲壳素被微生物分解利用后可以用它来作为植物生长的养分,使得土壤中的微生物体系得到改善[2]。
土壤微生物是土壤生态系统中最活跃的成员,能够利用有机质作为营养及能量来源,与土壤酶共同参与土壤各种化学反应和生物化学过程,其生物量及数量分布可以敏感地反映土壤环境质量的变化[3]。土壤微生物对植株的生长有良好的促进作用[4-7]。赵春燕等发现,添加甲壳素的土壤中自生固氮细菌、纤维分解细菌、乳酸细菌和放线菌等有益菌数量显著增加,酵母菌数量略有增加,而常见的霉菌和其它丝状真菌的数量明显减少[8]。尹秀莲等[9]通过对甲壳素及其衍生物的研究发现,甲壳素低聚糖对革兰氏阳性菌表现出强抑制作用。土壤中的微生物群落结构失衡,尤其是土壤中真菌群落结构的变化是引起连作障碍的主要原因[10]。王艳芳等[11]研究了甲壳素对连作条件下平邑甜茶幼苗生长及土壤环境的影响,发现甲壳素对真菌的生长有明显的抑制作用而对细菌的生长有促进作用;改变了土壤中微生物的群落结构,从而改善了连作土壤环境,有效缓解了平邑甜茶的连作障碍。本研究以甲壳素处理葡萄园土壤,采用细菌16S rDNA[细菌染色体上编码16S rRNA(核糖体RNA)相对应的DNA序列]、真菌内转录间隔区(Internal Transcribed Spacer,ITS)测序,对土壤中的细菌和真菌种类组成及数量进行分析,从而了解甲壳素添加对葡萄园土壤微生物群落结构的影响。
1 材料与方法
1.1 土壤样品采集
试验在山东省莱西市沽河街道办事处曲家庄村(葛洪强葡萄园)进行,试验设置2个处理:①对照组,土壤中不添加甲壳素。②试验组,土壤中添加甲壳素。各处理面积均为666.7m2。
试验所用甲壳素为济南阿波罗甲壳素肥业有限公司生产的963牌养根素(其主要成分为虾蟹壳生产的壳聚糖,含量为60~80g/L),随基肥施入,离植株60cm开30cm深的沟施入,每年1次,每666.7m2用量300g(折合纯甲壳素的量),2009~2014年连续6年施入。
2015年进行土壤样品采集。随机选取添加甲壳素和未添加甲壳素的土壤区域,每个区域选3处取样,每处采用对角线五点取样法采集土壤样品,将三次样品混匀。取样时去除地表面的植物等残体,用土铲垂直切开土壤,取0~20cm土层的土壤,挑出碎石、植物残根后,将土壤样本装入无菌自封袋中,尽快带回实验室后送检。应用Illumina Misq测序平台(华大基因)进行分析。
1.2 高通量测序分析
基因测序的总体工作流程大致为:①土壤DNA粗提。土壤中微生物原基因组DNA的提取采用Mag-Bind Soil DNA Kit Protocol试剂盒(OMEGA)。②样品PCR。分别利用细菌16S rDNA和真菌ITS通用引物进行扩增,扩增的PCR产物-20℃保存。③PCR产物进行琼脂糖凝胶电泳分析。采用DL2000 Marker、1%的琼脂糖凝胶,110V恒压对PCR产物进行电泳35分钟,凝胶成像仪观察电泳结果。④高通量测序。使用Axy Prep DNA凝胶回收试剂盒对真菌、细菌的PCR扩增产物进行切胶回收。采用Life Qubit 3.0对纯化后的PCR产物进行浓度定量,构建真菌、细菌文库。将样品(文库)逐步稀释到4nm,按1∶1加入氢氧化钠室温变性5分钟,加入HT1 Buffer预冷,然后进行高通量上机测序[12]。
1.3 数据统计分析
下机后,采用双峰(pair-end)测序法舍弃原始数据(Raw reads)中的低质量序列(保证50个连续碱基的平均质量大于Q30)。用Flash软件,过滤对接上的序列(连续相同的碱基个数小于6,模糊碱基个数小于1),设计无法对接的序列,得到最终用于OTU(operational taxonomic unit)分析的序列(Clean reads)。
采用Uparse 软件将相似度达97%以上的序列归为一个操作分类单元即OTU;聚类所有序列(Ucl法),参照RDP(Ribosomal Database Project)数据库,采用贝叶斯算法注释每个分类中的OTU代表序列,得到每个OTU的分类学信息。分别利用Greengene、UNITE数据库进行细菌及真菌的物种注释。根据OTU使用mothur软件进行Alpha多样性分析,包括Observed species指数、Chao指数、Ace指数、Shannon指数、Simpson指数,使用R软件(V3.1.1)绘制稀释曲线、Rank abundance曲线、物种累积曲线。
2 结果与分析
2.1 OTU统计及丰度分析
物种丰富度是指群落中物种数目的多少。物种均匀度是指一个群落或环境中的全部物种数目个体数目的分配状况;物种数目越多,多样性越丰富,物种数目相同时,每个物种的个体数越平均,则多样性越丰富[13]。OTU Rank曲线能够体现样品的物种多样性,可以同时解释样品多样性的两个方面,即样品所含物种的丰富度和均匀度。物种的丰富程度由曲线的横轴长度来反映,曲线越宽,说明样品中物种组成越丰富。样品中物种的均匀度由曲线纵轴的形状来反映,曲线越平坦,说明样品中物种组成的均匀度越高。由图1与图2可知,试验组的细菌和真菌OTU Rank曲线图要比对照组的平坦且横轴长度长。由此可得,试验组所含细菌和真菌群落的均匀度和丰富度要比对照组好,而且细菌的物种群落要比真菌的丰富且均匀度更高。

图1样品的细菌OTU Rank曲线图
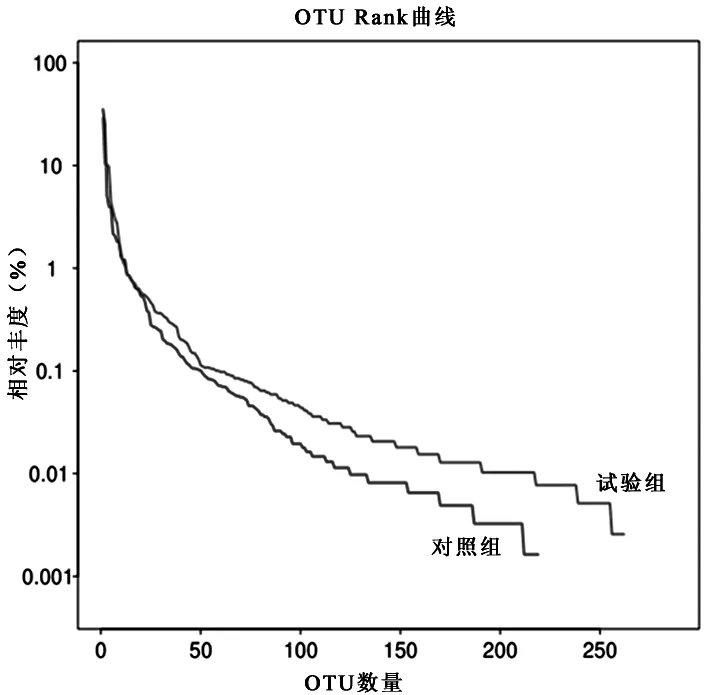
图2 样品的真菌OTU Rank曲线图
2.2 Alpha多样性分析
通过对供试土壤组进行16S rDNA及ITS高通量测序,共获得747336条原始数据,700780条过滤数据。在97%相似度下,细菌获得5661个OTU,真菌获得481个OTU。每个土壤样品的序列数及OTU数及Alpha多样性值见表1。
由表1可知,试验组的Observed species指数、Chao指数、Ace指数以及Shannon指数均比对照组的大,Simpson指数比对照组要小。Chao和Ace指数可反映群落物种丰富度,Shannon和Simpson指数可反映群落物种多样性。与对照组相比,试验组的细菌和真菌群落的物种丰富度高、均匀度大,具有更大的群落多样性,即土壤微生物种类增多,有助于土壤有机质及养分的积累,有利于植物的生长发育与繁殖。

表1 葡萄园土壤测序序列和Alpha多样性分析
2.3 物种注释分析
由于样品中所检测出的微生物种类繁多,许多物种含量十分少,以物种的丰度大于0.5%作为划分依据。由表2可得,对照组土壤中的细菌门类主要为变形菌门、酸杆菌门、浮霉菌门和厚壁菌门,试验组土壤中的主要为变形菌门、酸杆菌门、厚壁菌门、拟杆菌门和浮霉菌门。加入甲壳素后,土壤中细菌群落相对丰度增加较大的是拟杆菌门和厚壁菌门,分别增加了193.52%和47.45%;泉古菌门和疣微杆菌门则分别减少了47.30%和46.61%。
由表3可得,试验组与对照组相比,主要真菌中,子囊菌门增加了129.25%,担子菌门增加了47.24%,接合菌门减少了80.06%。
从属分类水平看,由表4可看出,两组土壤样品的细菌所占比例差距较大,试验组的亚硝化螺菌假丝酵母属、红游动菌属和慢生根瘤菌属等所占比例明显少于对照组,浮霉菌属、肠球菌属和芽孢杆菌属等所占比例明显多于对照组。
从表5可看出,在两组样品土壤微生物中,真菌种类大致相同,但试验组的土赤壳属、枝孢属和外瓶霉属等所占比例明显低于对照组,红酵母属、虫草属、隐球菌属和被孢霉属等种类所占比例明显高于对照组。
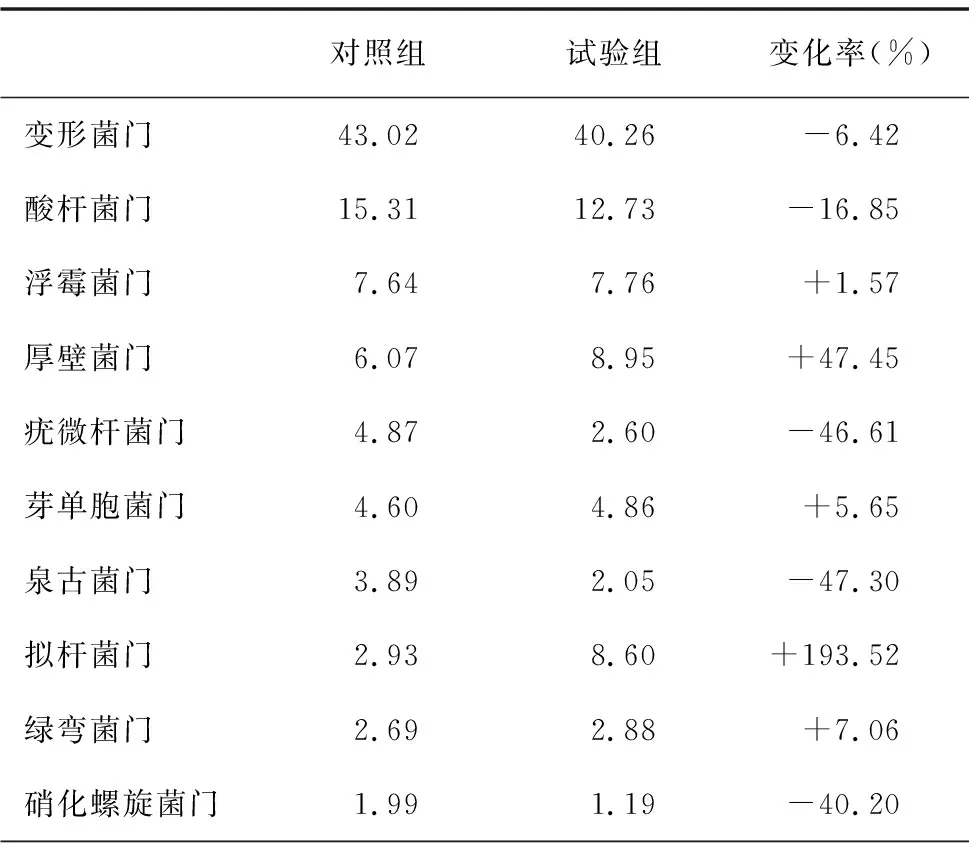
表2 对照组和试验组门水平的细菌主要群落相对丰度(%)
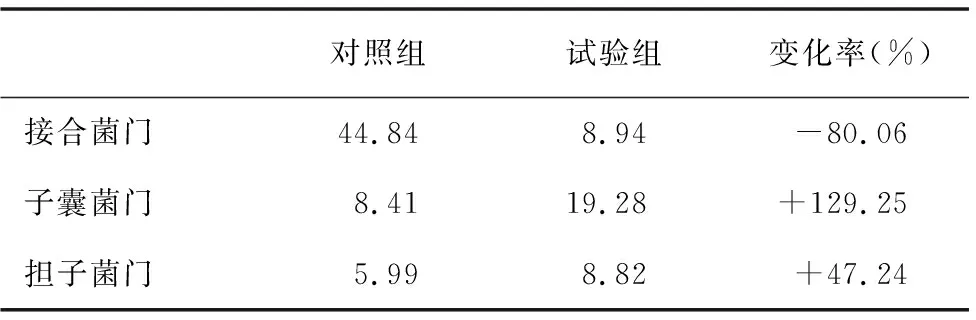
表3 对照组和试验组门水平的真菌主要群落相对丰度(%)

表4 对照组和试验组属水平的细菌主要群落相对丰度(%)
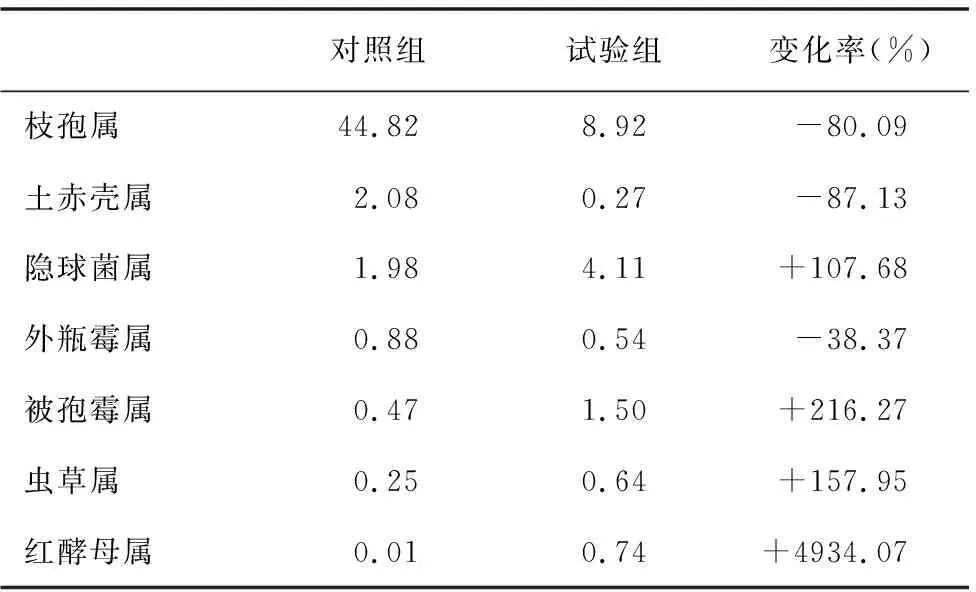
表5 对照组和试验组属水平的真菌主要群落相对丰度(%)
3 讨论
本研究通过16S rDNA及ITS高通量测序,分析了添加甲壳素(试验组)与未添加甲壳素(对照组)的土壤细菌与真菌群落结构差异。结果表明,添加甲壳素后,土壤中的细菌及真菌物种丰富度、均匀度及物种多样性均有明显的提高。土壤微生物是土壤生态系统的重要组成成分,主导着养分循环和能量流动,对维持系统的稳定性及可持续性具有重要作用[14],且微生物参与大约90%的土壤反应过程[15],故其种类的增多在一定程度上有助于土壤有机质及养分的积累,有利于植物的生长发育与繁殖。
添加甲壳素后,土壤中细菌与真菌中的微生物群落组成比例均有所变化。从门类水平来看,土壤中拟杆菌相对丰度明显提高,拟杆菌门可以通过降解纤维素、果胶和其他复杂的碳氢化合物为植物提供特殊的营养[16];试验组与对照组相比,丝状真菌的相对丰度减少,说明甲壳素对丝状真菌有一定的抑制作用,这与赵春燕[8]通过不同浓度的甲壳素灌根处理盆栽番茄来探究其对土壤微生物的影响研究相一致。从属类水平来看,土壤中细菌浮霉菌属、芽孢杆菌属,真菌被孢霉属的相对丰度明显提高,而真菌枝孢属的相对丰度明显受到抑制。浮霉菌属可以参与氮、碳、硫循环,进行多种循环代谢,富集矿物质,增强土壤肥力[17];芽孢杆菌属可以代谢碳源[16],具有保湿、抑植物病菌的作用,对植物有促生作用[18];被孢霉属能分解土壤中的糖类和简单多糖[19],为植物提供营养元素;枝孢属为植物致病菌,可寄生于植物各地上部分引起病害[20]。总的来说,甲壳素能够增加土壤微生物的物种种类与生物量,提高大部分有益菌的相对丰度,抑制部分有害菌的生长,有利于土壤中有机质与营养的积累,改善土壤环境。

