利用KASP标记评价水稻品种多态性
程萌杰,闫双勇,施利利,3,孙宁,张欣,3,丁得亮,3,边嘉宾,3,通信作者,王松文,3,通信作者
利用KASP标记评价水稻品种多态性
程萌杰1,闫双勇2,施利利1,3,孙宁1,张欣1,3,丁得亮1,3,边嘉宾1,3,通信作者,王松文1,3,通信作者
(1. 天津农学院 农学与资源环境学院,天津 300384;2. 天津市水稻研究所,天津 300384;3. 天津中日水稻品质食味研究中心,天津 300384)
采用600个KASP标记对51个品种进行多态性评价。结果表明:373个标记可以准确判定种质的单倍型,制定DNA指纹图谱,鉴定染色体片段代换系,其中有两个染色体片段代换系分别携带基因和基因。由51个品种构成一个自然群体,其多样性为568.50,粳型杂交稻保持系341B与HC-66(籼稻)的多态性为0.82,‘341B’与‘IPM’(籼稻)的多态性为0.80。373个标记可用于设计育种与模块育种。
水稻;KASP标记;多态性;染色体片段代换系
水稻是最重要的粮食作物之一。1992年,美国、日本、中国几乎同时启动了水稻基因组计划(Rice Genome Program,RGP),其基本策略是解析水稻()的基因组结构,在保持水稻高产、优质、抗病的基础上改良新品种。美国RGP率先绘制了遗传图[1],发展了SSR(Simple Sequence Repeat)标记[2],利用图位克隆法克隆了水稻抗白叶枯病基因[3]。日本学者制备了遗传图、物理图、转录图、序列图[4-5]。中国RGP在早期就注重RGP成果的应用,克隆了数百个重要农艺性状基因,启动了分子育种国家计划[6-7]。
分子育种主要包括分子标记育种与基因工程育种[8]。在我国,第一代标记(RFLP)、第二代标记(SSR)、第三代标记(SNP)技术的跟踪和创新步伐加快,在一些实验室和育种研究所都取得了突破性进展。
KASP(Kompetitive Allele Specific PCR)是竞争性等位基因特异性PCR的缩写,可在广泛的基因组DNA样品中(甚至是一些复杂基因组DNA样品),对SNPs和特定位点上的InDels进行精准等位基因判断。KASP一出现,就在小麦、西红柿等作物上得到应用[9]。本研究中利用KASP标记对选育的新品种及参照品种进行评价,以期了解水稻基因组的结构[10],为塑造亲本、选育新组合奠定基础[11]。
1 材料与方法
1.1 材料
试验材料如表1所示。
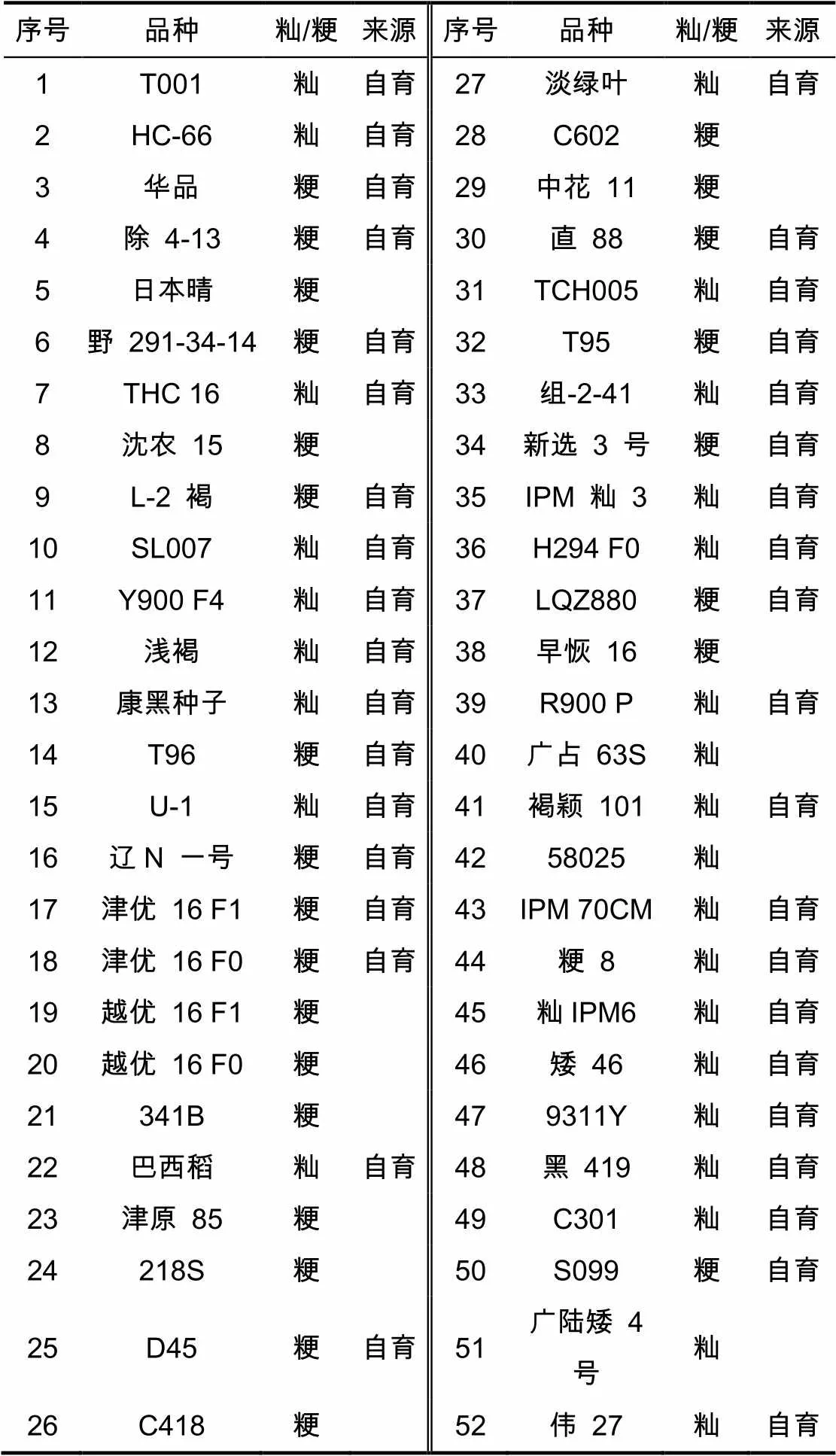
表 1 试验材料
其中,‘日本晴’从日本先端技术研究所引进,‘沈农15’由沈阳农业大学选育,‘越优16’‘C418’‘早恢16’‘广占63S’由辽宁农科院选育,‘341B’‘C602’由天津农科院选育,‘津原85’‘218S’由天津原种场选育,‘中花11’由北京市农林科学院选育,‘58025’由国际水稻所选育,‘广陆矮4号’由广东农科院选育。
试验材料在国家水稻基因组计划构建作图群体材料的基础上进行扩建,参照国际微型种质资源库构建原则,即最少的材料代表尽量多的遗传多样性。其中,部分材料进行了前期基因聚合,如‘黑419’是以‘华占’为母本、‘广西野生稻(GX102)’为父本进行杂交,连续回交11代选育出的重组自交系。
1.2 方法
依据KASP原理,设计正向引物和反向引物,假定两个正向引物具有同样的竞争能力,在PCR产物中存在两种等量的成分。本研究设计了600个KASP标记,采用LGC® SNPline 基因型分型技术平台进行PCR扩增、荧光标记、基因分型、数据处理,获得基因型后,采用最小距离法聚类并绘制图示基因型[12]。
以‘扬稻6号(9311)’为基因供体,分别与不同品种进行杂交,并回交3代或4代,选择携带‘扬稻6号’的染色体片段代换系,这些代换系分为籼稻(回交亲本)或粳稻(回交亲本),利用373个KASP标记鉴定,91个染色体片段代换系,可以携带‘扬稻6号’的全部基因组,参照边建民[13]方法绘制染色体片段代换系群的遗传图谱。
使用SPSS软件得到相似数据矩阵和遗传距离矩阵。计算群体多样性时,以一个品种作为公共亲本,计算与其他50个品种的多样性系数(品种多样性),将这50个多样性系数加权平均,然后累加各品种的加权平均值获得群体多样性系数(群体多样性)。
2 结果与分析
2.1 图示基因型
首先对600个KASP标记进行鉴定,依据多态性、品种鉴定能力、标记的育种学信息等,选取373个多态性高的标记,其相应的基因型组成了一组遗传信息矩阵。其中,第1染色体的图示基因型如图1。

图1 第1染色体的图示基因型
图1表明,粳稻的多态性低,籼稻多态性高,基因组中的杂合位点可以清楚地显示(图中黑色部分)。在本研究中,有的染色体片段较大,样本32的杂合区域覆盖了10个标记,有的杂合区段被分割成多个小段,样本36被分割(通过互换重组)成若干小的杂合片段,还有些具有亲缘关系的不同品种表现为具有相同的杂合片段,如样本17、18、19、20出现了8个相同的标记(基因型)。
2.2 染色体片段代换系
由于基因组中的标记已经比较饱和,600个标记可以准确地鉴定染色体片段代换系。染色体片段代换系如图2。
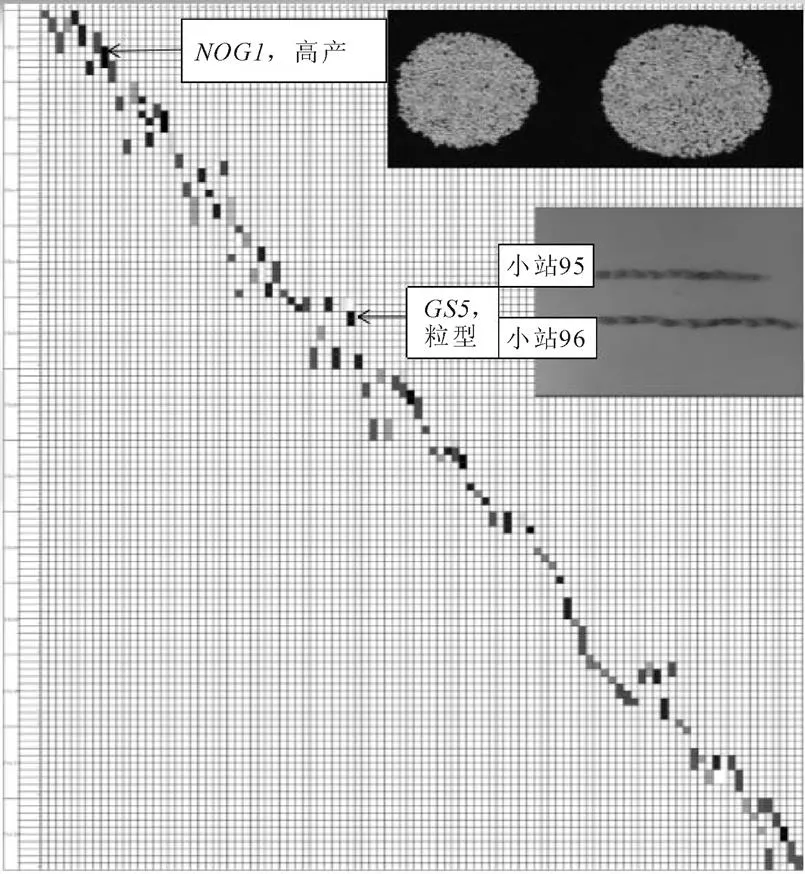
图2 染色体片段代换系图谱
图2表明,一个染色体片段携带高产基因表现为穗粒数增加,单株产量提高;另一个代换片段表现为长粒型,110个染色体片段代换系携带了粳稻品种‘日本晴’的完整基因组。第1 染色体最大,均匀分布了39个KASP标记(图1),其中,携带的一个染色体片段代换系覆盖了10个KASP标记的大片段。在育种上,可用于穗粒数、产量等多个性状的改良;在遗传上,可用于这个杂合区域的染色体定位及基因克隆的研究。同时,该染色体片段代换系还可用于基于改良强化回交的育种程序,实施定向育种研究。
2.3 51个品种的遗传多样性
51个品种构成了一个自然群体,这个群体也是一个育种群体,由28个骨干系(基因受体)和23个参照系(基因供体)构成,某些自然品种,如‘T95’‘巴西稻006’保持了未杂交品种的原始位点基因型(稀有位点基因型),一些新育成品种,如‘早恢16’‘9311Y’‘伟 27’聚合了大量的高产基因,往往能够产生很强的杂种优势。51个品种的遗传多样性见表2。

表2 51个品种的遗传多样性
表2表明,某些品种的多样性丰富,一方面典型的粳稻与典型的籼稻之间表现为很高的多态性,如‘341B’‘C602’多态性分别为0.58、0.60,主要是由于籼稻品种和粳稻品种的选择使它们成为了极端类型。另一方面,一些粳稻在改良成粳型恢复系的过程中,引入了大量的籼稻成分。在籼稻中,表现为籼稻亚种内的多态性高,如样品13(康黑种子)、样品15(U-1)引入了野生稻成分,样品11(Y900 F4)集中了不同籼稻品种的多态性。样品47(9311Y)遗传多样性表现并不突出,但性状多型性突出,可能是基因进化(遗传进化)与性状进化不同步,其机制有待进一步研究。
3 讨论
3.1 水稻品种的遗传多样性
Morishima等根据形态性状和同工酶估算,籼粳分化占遗传多态性的50%[14]。Zhang等分析,典型的籼稻和粳稻品种之间的多态性约为34%[15]。本研究中采用KASP标记对课题组选育的品种及参照品种进行多态性评估,群体多样性指数为568.50,有些品种的多样性指数可达0.60(‘中花 11’),粳型杂交稻保持系‘341B’与籼稻表现了最高的多态性,‘341B’与‘HC-66’(籼稻)的多态性为0.82,‘341B’与‘IPM’(籼稻)的多态性为0.80。从基因作图群体标准分析,基因作图群体要求多态性高、育性正常及偏分离少。‘341B’可能是基因作图的一个良好亲本,其F1育性、F2基因位点偏分离比例等有待进一步分析。从杂交稻育种的优势表现和作为骨干系的育种效应看,‘341B’是一个良好的保持系,其同核异质系‘341A’同‘C418’配置的杂交稻‘3优18’通过了国家新品种审定,表现为高产优质多抗的优良特性。
3.2 KASP标记的检测效能
KASP技术由英国LGC Genomics公司发明,用红蓝荧光标记纪录两个竞争性引物的信号,KASP技术的要点是SNP位点的两侧序列已知,3 000个水稻品种的重测序信息为KASP标记检测提供了方便[16]。在小麦中实现了多位点KASP检测,在西红柿等作物中依据KASP标记进行了分子育种。在水稻中,本课题组与中玉基因标记合作,联合建立了KASP检测平台,率先开展了51个育种骨干系的基因组分析和模块分析。在现代育种体系中,高通量检测往往采用SNP标记和基因芯片检测,SNP检测和基因芯片检测有一些报道[17],适于设计育种(Breeding by Design)[18]、作物定制改良(Crop Tailor-improve)[19],而模块育种(Module Breeding)KASP检测尚未见报道。但是,高通量检测、育种信息收集与利用[20]、核心亲本的创制、性状的遗传与控制[21]、多功能整合的育种平台建立等都是新时期育种的努力方向。
[1] Causse M A,Fulton T M,Cho Y G,et al. Saturated molecular map of the rice genome based on an interspecific backcross population[J]. Genetics,1994,138:1251-1274.
[2] Temnykh S,DeClerck G,Lukashova A,et al. Computational and experimental analysis of microsatellites in rice(L.):frequency,length variation,transposon associations,and genetic marker potential[J]. Genome Research,2001,11(8):1441-1452.
[3] Song W Y,Wang G L,Chen L,et al. A receptor kinase-like protein encoded by the rice disease resistance gene,[J]. Science,1995,270:1804-1806.
[4] Harushima Y,Yano M,Shomura A,et al. A high-density rice genetic linkage map with 2275 markers using a single F2population[J]. Genetics,1998,148(1):479-494.
[5] Matsumoto T,Wu J Z,Itoh T,et al. The Nipponbare genome and the next-generation of rice genomics research in Japan[J]. Rice,2016,9(1):33-41.
[6] Xue W Y,XingY Z,Weng X Y,et al. Natural variation inis an important regulator of heading date and yield potential in rice[J]. Nature Genetics,2008,40(6):761-767.
[7] Ling H Q,Zhao S,Liu D C,et al. Draft genome of the wheat A-genome progenitor[J]. Nature,2013,496(7443):87-90.
[8] Yang J Y,Zhao X B,Cheng K,et al. A killer-protector system regulates both hybrid sterility and segregation distortion in rice[J]. Science,2012,337:1336.
[9] Rasheed A,Wen W,Gao F M,et al. Development and validation of KASP assays for genes underpinning key economic traits in bread wheat[J]. Theor Appl Genet,2016,129(10):1843-1860.
[10] Xu X,Liu X,Ge S,et al. Resequencing 50 accessions of cultivated and wild rice yields markers for identifying agronomically important genes[J]. Nature Biotechnology,2011,30(1):105-111.
[11] 施利利,王有伟,王松文,等. 模块育种的理论与方法[J]. 天津农学院学报,2017,24(3):32-36.
[12] Milne L,Shaw P,Stephen G,et al. Flapjack-graphical genotype visualization[J]. Bioinformatics,2010,26(24):3133-3134.
[13] 边建民.“C418/9311”染色体片段置换系群体的构建及产量相关性状的研究[D]. 南京:南京农业大学,2010.
[14] Morishima H,Oka H. Phylogenetic differentiation of cultivated rice, XXII. Numerical evaluation of the Indica-Japonica differentiation[J]. Japan J Breed,1981,31(4):402- 413.
[15] Zhang Q F,Saghai-Maroof M A,Lu T Y,et al. Genetic diversity and differentiation ofandrice detected by RFLP analysis[J]. Theor Appl Genet,1992,83(4):495- 499.
[16] Wang W S,Mauleon R,Hu Z Q, et al. Genomic variation in 3010 diverse accessions of Asian cultivated rice[J]. Nature,2018,557:43-49.
[17] Yu H H,Xie W B,Li J,et al. A whole-genome SNP array(RICE6K)for genomic breeding in rice[J]. Plant Biotechnology Journal,2014,12:28-37.
[18] Peleman J D,van der Voort J R. Breeding by design[J]. Trends in Plant Science,2003,8(7):330-334.
[19] Ashikari M,Sakakibara H,Lin S Y,et al. Cytokinin oxidase regulates rice grain production[J]. Science,2005,309(741):741-745.
[20] 徐云碧. 分子植物育种[M]. 北京:科学出版社,2014.
[21] Dan Z W,Liu P,Huang W C,et al. Balance between a higher degree of heterosis and increased reproductive isolation:A strategic design for breeding inter-subspecific hybrid rice[J]. Plos One,2014,9(3):e93122.
责任编辑:宗淑萍
Evaluation of rice variety polymorphisms using KASP markers
CHENG Meng-jie1, YAN Shuang-yong2, SHI Li-li1,3, SUN Ning1, ZHANG Xin1,3, DING De-liang1,3, BIAN Jia-bin1,3,Corresponding Author, WANG Song-wen1,3,Corresponding Author
(1. College of Agronomy and Resource Environment, Tianjin Agricultural University, Tianjin 300384, China; 2. Tianjin Rice Research Institute, Tianjin 300384, China; 3. China-Japan Joint Center on Palatability and Quality of Rice in Tianjin, Tianjin 300384, China)
Polymorphisms were evaluated in 51 varieties using 600 KASP markers. The results showed that 373 markers could accurately determine the haplotypes of the germplasm, develop DNA fingerprints, and identify chromosome fragment substitution lines, among which two chromosomal fragment substitution lines carry the NOG1 gene and the GS5 gene, respectively. A natural population consists of 51 varieties, with the diversity 568.50. The polymorphism of 341B and HC-66(indica)is 0.82, and the polymorphism of 341B and IPM(indica)is 0.80. 373 markers can be used for breeding by design and module breeding.
rice; KASP marker; polymorphism; chromosome fragment substitution system
1008-5394(2018)04-0013-04
10.19640/j.cnki.jtau.2018.04.004
S336
A
2018-09-18
天津市科技计划项目(16ZXZYNC00110)
程萌杰(1993-),女,硕士在读,主要从事水稻育种研究。E-mail:1191107941@qq.com。闫双勇(1974-),男,副研究员,硕士,主要从事水稻育种研究。E-mail:niceone02@163.com。程萌杰和闫双勇对本文具有同等贡献,为并列第一作者。
边嘉宾(1977-),男,副研究员,博士,主要从事水稻育种研究。E-mail:4295997@qq.com。王松文(1958-),男,教授,博士,主要从事水稻育种研究。E-mail:dw186001@aliyun.com。

