建立体外血脑脊液屏障模型方法学研究
张海威 张丹参 苏晓梅 赵凯燕 武春阳 张 力
1. 河北北方学院药学系,张家口,075000,中国
2. 河北科技大学,石家庄,050000,中国
血脑脊液屏障是保持中枢神经系统内环境稳态的一层复杂的屏障系统,其有效的将血液和脑组织分离开来,通过多种细胞组成的“神经血管单元”,调节着营养物质渗透入脑而减少有毒有害物质的吸收,发挥着保护神经系统正常生理功能的重要作用[1]。血脑脊液屏障在体研究因高成本、费时、操作繁琐,受多种因素干扰等影响试验进展,因而研究人员更倾向体外模型研究,在神经治疗药物高通量筛选实验、药物跨血脑脊液屏障转运研究等方面展现出高效低耗的优势。因此,建立相对简单可靠、重复性好、接近在体状态的体外血脑脊液屏障模型,对研究药物对血脑脊液屏障的影响及药物转运机制方面提供技术支持。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
健康成年 Sprague Dawley(SD)大鼠,SPF级,体质量(250~300) g,♀♂比例为 2∶1,合格证号SCXK(京)2014-0004,购自北京华阜康生物科技股份有限公司。饲养于河北北方学院药学系动物屏障室,适应性喂养7 d后,雌雄合笼配种,见阴栓后异笼饲养。
1.1.2 主要试剂及材料
HBSS平衡盐液、Hibermate-E、DMEM/F12、胎牛血清、0.5% Trypsin-EDTA,均购自美国Gibco公司;ECM基础培养基、内皮细胞生长添加剂ECGS、青霉素/链霉素溶液,均购自美国Sciencell公司;Accutase、Albumin from bovine serum,均购自Sigma公司;胶原酶/分解酶,购自美国Roche公司;Ⅱ型胶原酶、D-NaseⅠ酶、γ-谷氨酰转肽酶(γ-glutamyltranspeptidase,γ-GT)活性测定试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒,均购自北京索莱宝生物科技有限公司;GFAP多克隆抗体、SABC免疫组化试剂盒、DAB显色试剂盒,均购自武汉博士德生物工程有限公司;Ⅷ-R Ag多克隆抗体、SP免疫组化试剂盒,均购自北京中杉金桥技术有限公司;FITC标记的羊抗兔IgG、Cy3标记的羊抗兔IgG、DAPI染色液,均购自北京博奥森生物技术有限公司;Transwell小室、T25细胞培养瓶,购自美国Corning公司;Millicell-ERS-2细胞电阻仪,购自美国Millipore公司。
1.2 实验方法
1.2.1 SD大鼠星形胶质细胞(astrocyte,As)的原代培养
取1~2日龄新生SD大鼠4只处死,75%酒精消毒浸泡消毒后,在无菌条件下断头取双侧大脑,置于盛有冰Hibermate-E液的培养皿中,在冰上仔细去除脑膜及大血管,分离两侧大脑皮质。将皮质剪碎成糜状后置于15 mL离心管中,用HBSS液清洗三次,后加入消化液(a ccutase)+0.1% DNAase消化,37℃水浴锅孵育 15 min,每5 min晃一次。As完全培养基+0.1% DNAase 1 mL吹打10~15次,静置3 min,取上清液过200目细胞筛后,将滤液接种于25 cm2细胞培养瓶,置37℃,5% CO2培养箱中培养。0.5 h后,通过差速贴壁法处理,吸出细胞悬液转接种于多聚赖氨酸包被的细胞培养瓶中继续培养。待细胞生长至单层融合时,将培养瓶置于37℃恒温摇床上180 r·min-1震荡4 h,收集贴壁细胞,用0.25%胰蛋白酶-EDTA消化传代,之后用As完全培养基,2~3 d换液一次。
1.2.2 SD大鼠脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)的原代培养
取10只新生7日龄左右的SD大鼠,用75%乙醇消毒。在无菌条件下迅速取出全脑,并将其置于预冷的Hibermate-E液的培养皿中,仔细剥离间脑和小脑,保留大脑灰质部分。将灰质部分全部剪碎至1 mm3大小,并移至离心管中,加入0.1%Ⅱ型胶原酶(含30 U·mL-1,DNase Ⅰ)吹打混匀后,置于37℃水浴中消化40 min,之后加入0.1%胶原酶/分散酶(含20 U·mL-1,DNaseⅠ)在37℃水浴中共同消化40 min,终止消化,4 ℃,1 000 r·min-1离心5 min。弃上清液,加入无血清的ECM培养基混匀后过100目细胞筛,收集滤液4 ℃,1 000 r·min-1离心5 min。弃上清液,加入两倍体积的 20% BSA 液重新混匀后,4 ℃,1 000 r·min-1离心20 min。弃去中上层组织及大血管,保留底部沉淀,再加入1 mL无血清的ECM培养基轻柔吹打洗涤,4 ℃,1 000 r·min-1离心5 min。弃上清,加入两倍体积的20%BSA 液重新混匀后,4 ℃,1 000 r·min-1离心 20 min。弃上清液,获得底部黄白色脑微血管段,加入ECM完全培养基混悬后,接种于鼠尾胶原预包被的25 mL培养瓶中,加入浓度为4 mg·L-1的嘌呤霉素,置于37 ℃,5% CO2培养箱中培养。48 h后换为不含嘌呤霉素的ECM完全培养基继续培养,每隔2 d换液一次。
1.2.3 细胞形态学观察
将培养有BMECs和As的培养瓶置于倒置显微镜下,观察细胞贴壁、形态及生长状况。
1.2.4 免疫荧光化学染色
取出已固定好的BMECs和As爬片;PBS漂洗5 min×3次;加入TritonX-100透化液室温处理10 min;PBS漂洗5 min×3次;山羊血清室温封闭30 min;PBS漂洗5 min×3次;加入Ⅷ因子相关抗原的单克隆抗体(1∶200);兔抗鼠 GFAP(1∶100);4 ℃冰箱中孵育过夜;PBS漂洗5 min×3次;加入FITC标记的羊抗兔荧光二抗以及Cy3标记的羊抗兔荧光二抗,避光,室温孵育1 h;PBS漂洗5 min×3次;加入DAPI工作液,避光,室温孵育15 min;PBS漂洗5 min×3次;置于荧光显微镜下观察并拍照。
1.2.5 体外模型的建立
取传代的As,用含20%血清的DMEM/F12培养基重悬后,将细胞密度调整至2×105·mL-1,接种于Transwell小室的反面侧,置于37℃,5% CO2培养箱中培养4 h,待As基本贴壁后将Transwell小室放入12孔板中加入As完全培养基继续培养,倒置显微镜观察As融合生长至70%左右时,在Transwell小室的正面侧接种BMECs。用ECM完全培养基重悬细胞,将细胞密度调整至 2.5×105·mL-1,接种于 Transwell小室的正面侧,置于37 ℃,5%CO2培养箱中培养,3 d换液一次,直至两种细胞分别在小室两侧融合生长。
1.2.6 TEER值测定
实验分组为共培养组、单独BMECs培养组和空白对照组,在接种 BMECs后的 1、3、5、7、9、11、13、15 d进行TEER值得测量。TEER值为各小室的TEER平均值减去空白对照组TEER平均值,再乘以小室的膜面积。
1.2.7 液面试漏实验
待共培养组TEER值检测保持稳定后,于Transwell小室内外侧添加细胞培养基,使内侧与外侧培养基的液面差≥0.5 cm,37 ℃、5% CO2培养4 h后观测液面差是否发生变化,如果细胞已形成致密的屏障,Transwell小室内外侧的液面仍保持明显差距(液面差浮动≤0.1 cm)。
1.2.8 特征性酶检测
γ-GT检测:将单独BMECs培养组、共培养组Transwell小室的细胞裂解,取上清液备用。按照γ-GT检测试剂盒要 求,对标准品孔和样本孔进行检测,绘制标准品线性回归曲线,按曲线方程计算各组上清液中γ-GT的量,比较差异。
碱性磷酸酶(alkaline phosphatase,ALP)检测:分别提取单独BMECs培养组、共培养组Transwell小室内侧的BMECs的上清蛋白液。按照ALP测定试剂盒说明书中要求步骤,用酶标仪测定样本蛋白与标准品的吸光度(absorbance,A)值,通过求得标准曲线方程,计算每组ALP活力值,比较差异。
1.2.9 Na-FLU通透性实验
在共培养中BMECs融合生长并且电阻值保持在恒定后,吸出完全培养基,用HBSS液将Transwell小室内外清洗两遍,用移液管将上室的DMEM/F12替换为0.5 mL浓度为100 μg·mL-1荧光素钠溶液,下室加入1.5 mL空白DMEM/F12培养基,放入37℃培养箱中进行实验。分别在 15、30、45、60、75、90、105、120 min 时间点从下室吸取100 μL培养基,并立即补充相同体积的DMEM/F12培养基,用多功能酶标仪测定荧光素钠的光密度值(optical density,OD)。酶标仪测定取得样本光密度值,利用荧光素钠标准曲线计算样本荧光素钠浓度,依次时间点相应浓度累积相加即为该时间点的渗透浓度值。
跨膜渗透系数(Pe)计算按照先前报道[2]的公式计算。

清除体积与相应时间点作坐标曲线图,实验分组为共培养组、单独BMECs培养组和空白对照组,细胞小室和空白小室的曲线分别作直线回归,斜率分别记作PSt和PSf。跨膜渗透系数按照以下公式计算:1·PSe-1=1·PSt-1-1·PSf-1。跨膜渗透系数 Pe=PSe·S-1,其中 S 为小室膜面积,单位以cm·s-1表示。
1.3 统计学方法
2 结果
2.1 倒置显微镜观察细胞形态
将原代培养的BMECs和As置于倒置显微镜下观察,BMECs生长区域沿中心向四周扩大,呈多角形或短梭形,核淡,胞膜明显,旋涡状分布,可见典型的铺路石征象;As呈梭形或不规则多边形,部分星形胶质细胞长出突足(Fig.1)。
2.2 免疫荧光化学染色
用Ⅷ因子免疫荧光鉴定BMECs,经FITC荧光二抗染色后,可见大部分细胞胞浆明显的绿色荧光,细胞轮廓清晰现出;As经GFAP免疫荧光染色后,细胞胞浆及突起发出明显的红色荧光,细胞轮廓清晰现出;细胞核用DAPI蓝色荧光染色,细胞核与细胞质重叠为阳性细胞,检测结果阳性率>95%(Fig.2)。
2.3 TEER值测定
在Transwell上室种植BMECs后开始检测共培养模型组和单独培养BMECs组的TEER值,结果表明(Fig.3),两个组的TEER值都随着时间延长不断上升,并且BMECs在共培养的d 11基本实现融合生长,TEER值达到稳态。d 15测得共培养模型组TEER值为(378.97±11.38) Ω·cm2,远高于 BMECs单独培养组(268.94±25.47) Ω·cm2(P<0.01)。
2.4 液面试漏实验
Transwell内侧与外侧培养基的液面差≥0.5 cm,继续培养4 h后,可见4 h后液面仍保持明显差距,说明共培养模型组细胞已形成致密的屏障。对照组为未接种细胞小室,可见4 h后液面消失明显差距(Fig.4)。
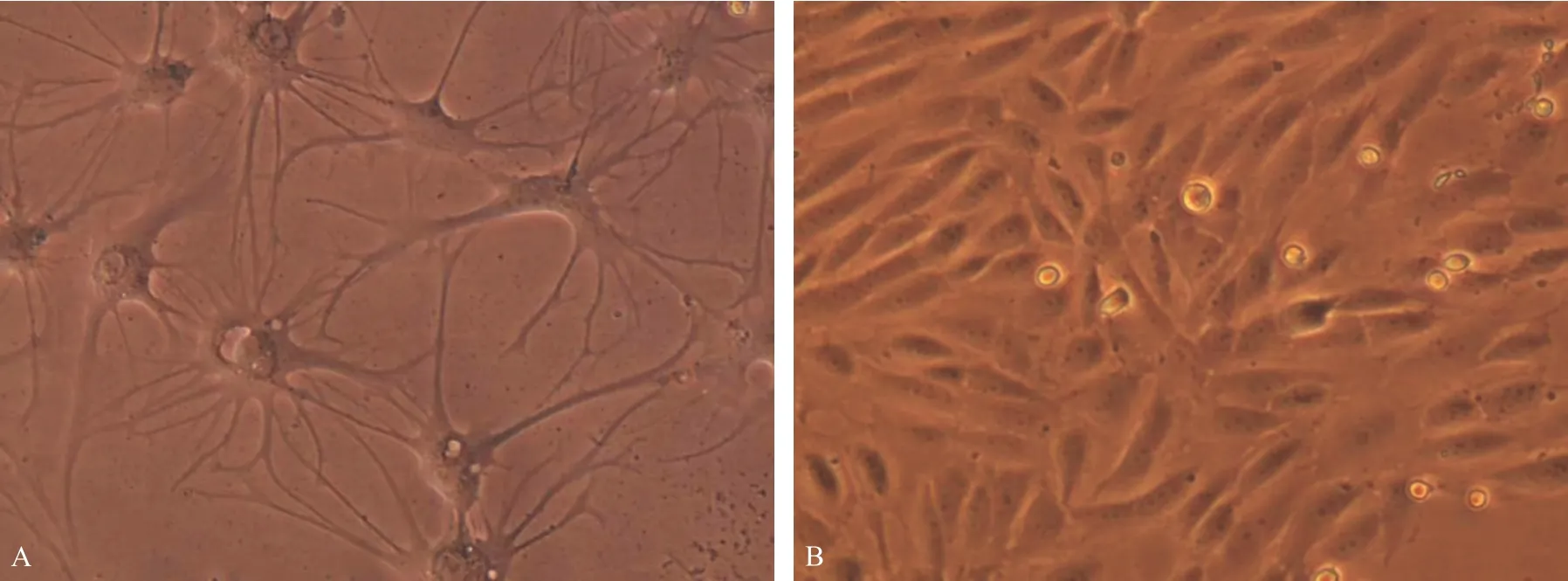
Fig.1 The morphology of As and BMECs (×200)

Fig.2 The immunofluorescence images As and BMECs (×200)

Fig.2(continued)
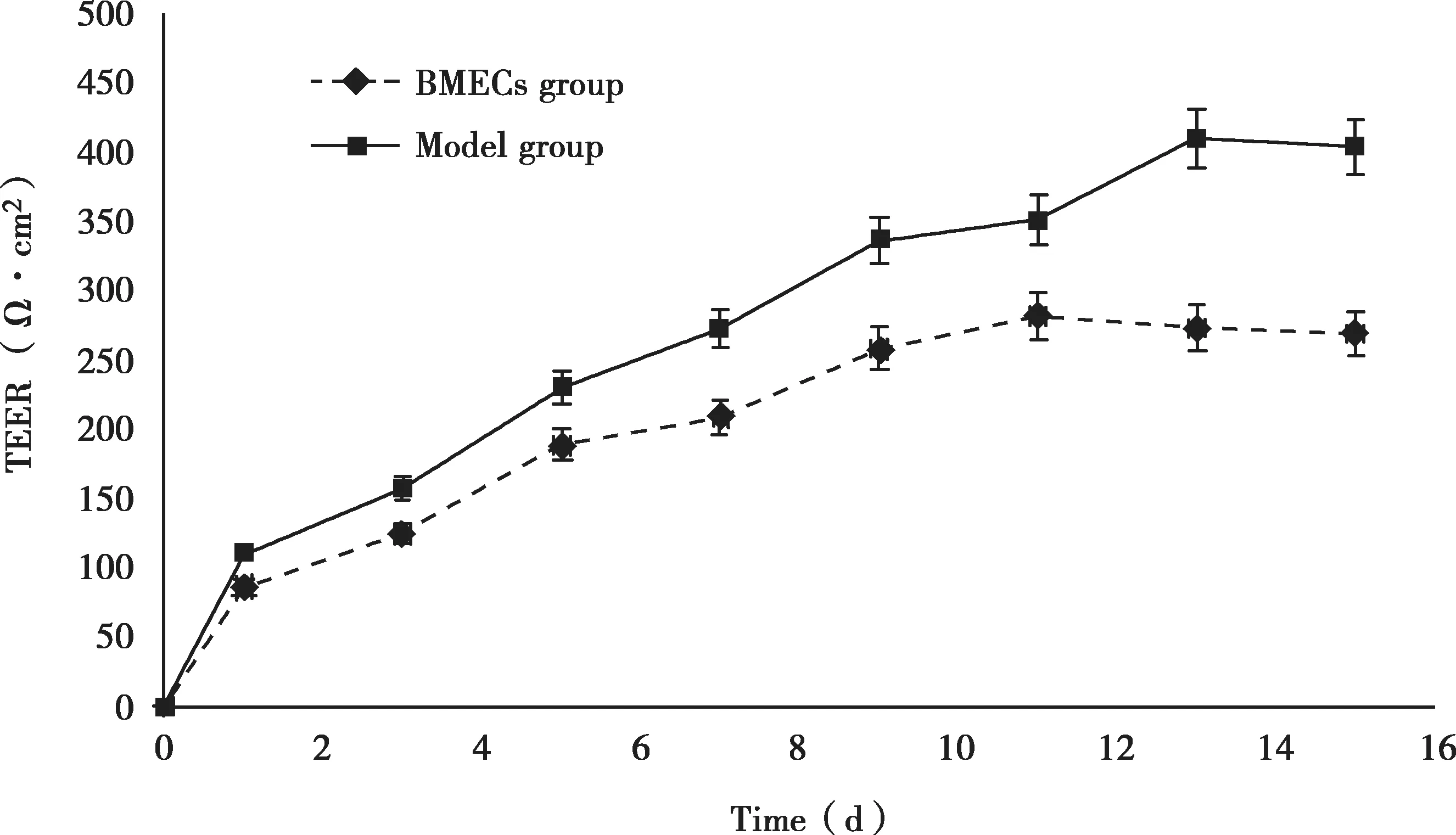
Fig.3 The measurement of TEER across transwel,n=3)
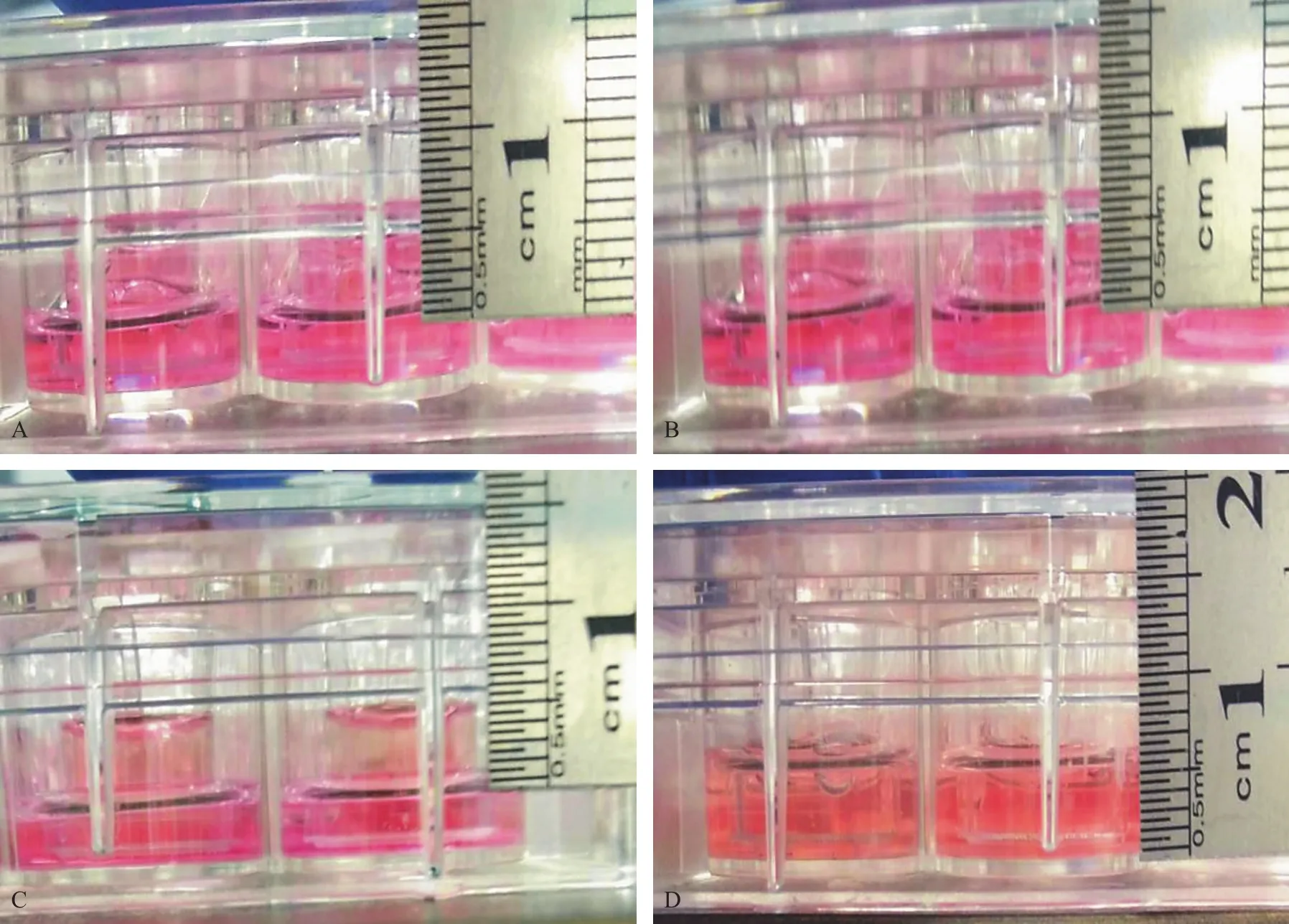
Fig.4 Liquid interview leak test
2.5 特征性酶检测
γ-谷氨酰胺转肽酶(γ-GT)检测:按照γ-GT检测试剂盒的方法。得出单独培养BMECs的γ-GT值(13.93±3.08) µmol·min-1·mL-1,共培 养 后的 BMECs的γ-GT 值(30.88±2.87) µmol·min-1·mL-1,有明显的差异(P<0.05)(Fig.5)。
碱性磷酸酶(ALP)检测:标准OD值为0.356,单独培养BMECs为0.287,共培养后BMECs为0.425。经公式计算,单独培养BMECs的碱性磷酸酶含量(1.49±0.19)金氏单位·100 mL-1,共培养后 BMECs的碱性磷酸酶含量(2.51±0.88)金氏单位·100 mL-1,有明显差异(P<0.01)(Fig.6)。
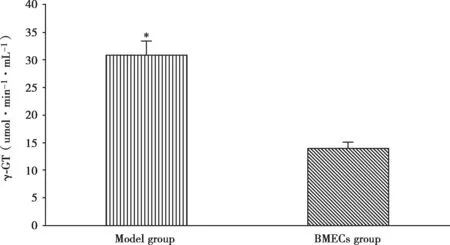
Fig.5 The detection of γ-GT
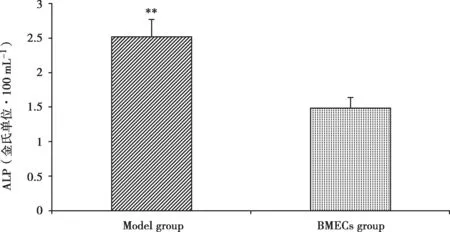
Fig.6 The detection of ALP
2.6 Na-FLU通透性实验
荧光素钠浓度的标准曲线为y=0.295 1x+0.001 3,x为荧光素钠浓度,y为吸光度,R2=0.999。根据荧光素钠浓度的标准曲线计算出不同时间点Transwell下室中荧光素钠的浓度,并绘制荧光素钠浓度-时间的关系图(Fig.7)。由图可知,对荧光素钠的限制通过能力共培养模型组>单独BMECs培养组>空白对照组。共培养模型组显示出较强的限制通过能力。

Fig.7 The concentration of fluorescein sodium in the bottom of traswell

Fig.8 The permeability coefficient of fluorescein sodium(
根据跨膜渗透系数计算公式得出(Fig.8),2 h后,共培养模型组的荧光素钠渗透系数较低,为(1.165±1.91)×106cm·s-1,与单独 BMECs培养组(2.228±0.85)×106cm·s-1(P<0.01),有显著性差异。
3 讨论
血脑脊液屏障是免疫系统中重要屏障之一,主要由BMECs、As足突、基膜以及周细胞、神经元等多种细胞共同组成的动态生理结构[3]。其中以BMECs构成基础框架,是血脑脊液屏障中主要发挥作用的细胞[4]。As作为屏障结构的辅助细胞,可以调节BMECs上酶的表达、转运蛋白的功能、增加紧密连接特性、增强细胞旁路的限制性通过。BMECs和As在体外共同培养通过细胞间相互间作用,使模型的特性更接近体内血脑脊液屏障,这也是目前国内外认可度最高的体外血脑脊液屏障模型建立方法。
为争取体外血脑脊液屏障更接近在体特征,故选取同种属SD大鼠的BMECs和As原代培养的方法获取实验细胞,原代培养方法可满足实验对细胞的大需求量,节约实验成本。As在脑皮层中含量丰富,其对生长环境要求不高,参照张楠[5]海马神经元原代培养方法,并在其基础上进行改进,获得简便、易操作、纯度较高的As原代培养方法。BMECs对细胞培养环境要求较高,需要特定的生长因子维持生长,较As原代培养方法操作复杂、难度较高。通过大量文献学习[6-7],以鼠尾胶原包被介质使细胞易贴壁生长,采用三种酶(Ⅱ型胶原酶、胶原酶/分散酶、DNA酶Ⅰ型)联合消化,使用20% BSA多次离心纯化,获得纯度较高的脑微血管碎段。之后加入嘌呤霉素培养48 h,嘌呤霉素为一种蛋白质合成抑制剂影响细胞的蛋白合成,由于BMECs上高表达的P-糖蛋白可将嘌呤霉素排出细胞,而其他杂细胞则受到影响无法生长。并使用内皮细胞专用ECM培养基,可提供内皮细胞生长所需要的微量元素、氨基酸和生长因子等,获得与文献报道一致的细胞[8]。由于两种细胞持续传代后,形态和功能会发生改变,影响实验结果的准确性,故本实验采用分离纯化原代细胞,第一次传代的细胞进行体外模型建立实验。
对于体外血脑脊液屏障模型建立情况的评价,本实验通过四个方面进行评测。TEER值测定表明在接种BMECs后,TEER值不断升高在培养至第11天后达到稳定,并且与对照组比较有显著性差异;选取TEER值稳定的共培养组进行4 h液面试漏实验,结果测试即为阳性,说明屏障功能已初步形成。血脑脊液屏障上特征性酶γ-GT与ALP的活性高低,也是检测模型建立的特征指标,实验结果表明共培养模型组的两种酶活性明显高于BMECs单独培养组,与研究报道一致[9]。荧光素钠是公认的细胞旁路转运标志物,用来评价模型细胞旁路限制性通过功能,进而反应转运膜的完整性[10]。Pe是一种不依赖于所测得物质浓度的屏障通透性指标,能客观反应化合物和血脑脊液屏障模型间的作用特点,通过对荧光素钠Pe值的测定,共培养模型组表现出显著的限制性通过能力,与BMECs单独培养组比较有显著差异。
通过实验证实已建立相对简单可靠、重复性好、接近在体状态的体外血脑脊液屏障模型。为血脑脊液屏障生理结构、转运机制和功能研究提供实验模型。

