脂溶性维生素联合阿奇霉素治疗小儿支原体肺炎的临床研究
刘友红,焦贝蓓,王家祥
(1.河南科技大学第一附属医院儿科,洛阳 471000;2.郑州大学第一附属医院儿科,郑州 450002)
肺炎支原体肺炎(Mycoplasmapneumoniaepneumonia,MPP)属儿科常见病,起病较缓慢,若及时规范处理,多数患儿预后良好。若治疗不及时,可导致患儿支气管扩张、胸腔积液和肺间质纤维化等呼吸道并发症,还可累及神经系统、心血管系统和消化系统等,严重时导致后遗症或危及生命安全[1]。文献报道[2-3],MPP患儿体内促炎/抗炎、调节性T细胞/辅助性T细胞17(Treg/Th17)比率均处于失衡状态。目前,临床对小儿MPP的治疗包括对症治疗(化痰、平喘和止咳等)、抗生素控制感染、纤维支气管镜术等方法,其中抗生素干预是治疗的关键。阿奇霉素是当前治疗小儿MPP的一线药物[4]。研究显示[5-6],儿童呼吸道感染采用脂溶性维生素佐治能明显缩短病程,促进机体康复。本研究探讨小儿MPP应用脂溶性维生素联合阿奇霉素治疗的临床效果及对患儿机体促炎/抗炎平衡和Treg/Th17细胞平衡的影响,以期指导临床抗MPP治疗。
1 资料与方法
1.1一般资料 选取收治的100例MPP患儿,均满足MPP诊断标准[6]。其中男57例,女43例;年龄为1~11岁,平均6.3±1.4岁;病程2~14 d,平均8.1±2.6 d;体质量8.7~33.4 kg,平均21.2±4.7 kg。按照随机数字表法将100例患儿随机分成观察组与对照组,各50例。其中观察组男31例,女19例;年龄1~10岁,平均6.1±1.5岁;病程3~14 d,平均8.2±2.8 d;体质量9.1~32.8 kg,平均20.9±4.9 kg。对照组男26例,女24例;年龄2~11岁,平均6.4±1.1岁;病程2~13 d,平均7.9±2.5 d;体质量8.7~33.4 kg,平均21.4±4.6 kg。2组基线资料对比差异均无统计学意义(P>0.05),具有可比性。
纳入标准:①符合《儿童肺炎支原体肺炎诊治专家共识(2015年版)》中制定的MPP诊断标准,经临床表现及病原学、影像学等检查确诊者[6];②1岁≤年龄≤11岁;③患儿及其法定监护人自愿受试并签署知情同意书;④首次急性发病,病程≤14 d;⑤依从性良好,能积极配合常规查体和影像学、实验室检查等;⑥临床资料完整;⑦入院前未有糖皮质激素、替加环素、阿奇霉素和克拉霉素等药物使用史。排除标准:①难治性或重症MPP患儿;②对本研究药物过敏或过敏体质者;③依从性较差,无法有效配合诊疗者;④合并支气管炎、先天性心脏病、院内获得性肺炎、哮喘、支气管异物或肺部先天性疾病者;⑤伴有肝肾功能不全或心脑血管疾病者;⑥患有风湿性肺炎、伤寒、衣原体肺炎、肺结核、百日咳、病毒/细菌性肺炎等疾病患者。
1.2方法 所有患儿均给予基础治疗,包括①饮食指导、卧床休息、保持呼吸通畅等一般治疗;②雾化(止咳化痰、平喘)、氧疗、退热、镇静和补液等对症处理。对照组:在基础治疗上加用阿奇霉素治疗,方法:①将10 mg·kg-1·d-1剂量的注射用阿奇霉素(东北制药有限公司,规格0.25 g,批号160305)加入280 mmol·L-1葡萄糖注射液均匀混合,调配阿奇霉素质量浓度为1.0 mg·mL-1,再静脉缓慢滴注3 h,连用5 d;②再序贯口服10 mg·kg-1·d-1剂量的阿奇霉素片(辉瑞制药有限公司,规格0.25 g,批号20160107),顿服。观察组在对照组的治疗基础上联合脂溶性维生素[成都天台山制药有限公司,规格310.0~415.0 μg(维生素A 4.5~6.0 μg,维生素D22.9~3.5 mg,维生素E 90.0~120.0 μg,维生素K190.0~120.0 μg),批号:151114,161203]治疗;方法:0.2支·kg-1·d-1用100 mL浓度为280 mmol·L-1的葡萄糖注射液充分稀释后给药,每日1次,最大剂量≤2支,连用7 d。2组均连续治疗14 d后观察疗效。
1.3观察指标 (1)疗效判定标准[7]:治愈:咳嗽、咽痛和胸闷等症状消失,体温正常,X射线显示肺部病变完全或基本吸收;好转:以上症状明显缓解,体温正常,X射线显示肺部病变部分吸收;无效:上述症状、体温、肺部病变均未见改善。总有效率=(治愈+好转)÷总例数×100%。(2)记录对比2组一般临床症状(如咳嗽、哮鸣音、喘憋和肺部阴影等)消失时间。(3)每位患儿均于治疗前及治疗14 d后运用酶联免疫法各检测1次促炎因子[γ-干扰素(IFN-γ)、白细胞介素-1β(IL-1β)]和抗炎因子[IL-10、转化生长因子-β(TGF-β)]的血清质量浓度。(4)运用流式细胞术分析所有患儿治疗前后外周血Treg、Th17细胞比例及其比值。(5)详细记录用药期间每位患儿因药物治疗而致的腹泻、稀便、头晕、消化不良、味觉异常和血小板计数减少等不良反应。

2 结果
2.12组临床疗效比较 观察组治疗14 d后总有效率为94.0%(47/50)明显高于对照组的78.0%(39/50),差异有统计学意义(P<0.05)。见表1。
表12组临床疗效比较
Tab.1 Comparison of clinical effect between the 2 groups (n=50)
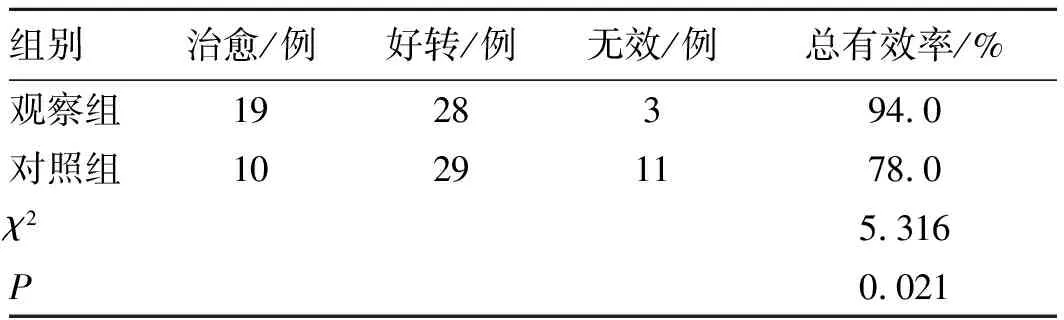
组别治愈/例好转/例无效/例总有效率/%观察组1928394.0对照组10291178.0χ25.316P0.021
2.22组症状体征改善效果比较 观察组各项症状体征消失时间较对照组均显著缩短,差异具有统计学意义(P<0.01)。见表2。
表22组症状体征改善时间比较
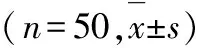
组别不同症状体征改善时间/d咳嗽哮鸣音喘憋肺部阴影湿罗音观察组6.46±1.357.73±1.256.95±1.3311.43±1.727.23±1.46对照组5.22±0.935.84±0.875.54±0.919.56±1.485.67±0.89t5.3498.7756.1875.8276.451P0.0000.0000.0000.0000.000
2.32组促炎/抗炎因子比较 与治疗前比较,2组治疗后血清IFN-γ、IL-1β水平均显著降低(P<0.01),IL-10和TGF-β水平均显著提高(P<0.01);且观察组改善更显著(P<0.01),差异均有统计学意义。见表3。
表32组促炎/抗炎因子比较
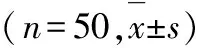
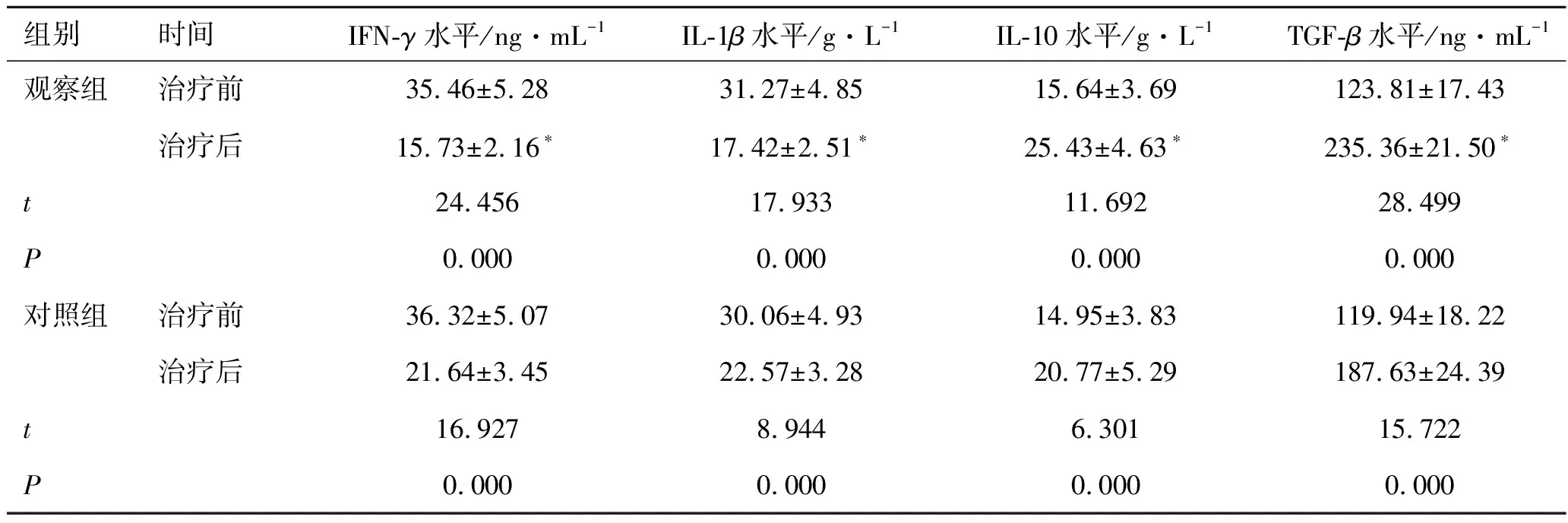
组别时间IFN-γ水平/ng·mL-1IL-1β水平/g·L-1IL-10水平/g·L-1TGF-β水平/ng·mL-1观察组治疗前35.46±5.2831.27±4.8515.64±3.69123.81±17.43治疗后15.73±2.16∗17.42±2.51∗25.43±4.63∗235.36±21.50∗t24.45617.93311.69228.499P0.0000.0000.0000.000对照组治疗前36.32±5.0730.06±4.9314.95±3.83119.94±18.22治疗后21.64±3.4522.57±3.2820.77±5.29187.63±24.39t16.9278.9446.30115.722P0.0000.0000.0000.000
注:与对照组治疗后比较*P<0.01。
2.42组Treg/Th17细胞平衡比较 2组治疗后外周血Treg细胞比例、Treg/Th17比值较治疗前均显著升高(P<0.01),Th17细胞比例均显著降低(P<0.01);且观察组改善更显著(P<0.01),差异均有统计学意义。见表4。
表42组Treg/Th17细胞平衡比较
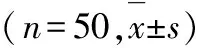
组别时间Treg/%Th17/%Treg/Th17观察组治疗前3.14±0.613.19±0.650.99±0.16治疗后5.25±1.08∗1.78±0.83∗2.67±0.43∗t12.0299.45725.892P0.0000.0000.000对照组治疗前3.05±0.683.15±0.710.96±0.17治疗后4.61±1.152.32±1.072.12±0.50t8.2574.57015.532P0.0000.0000.000
注:与对照组治疗后比较*P<0.01。
2.52组不良反应比较 观察组不良反应发生率为2.0%(1/50),较对照组的8.0%(4/50)略低,差异无统计学意义(P>0.05),见表5。
表52组不良反应比较
Tab.5 Comparison of adverse reactions between the 2 groups (n=50)
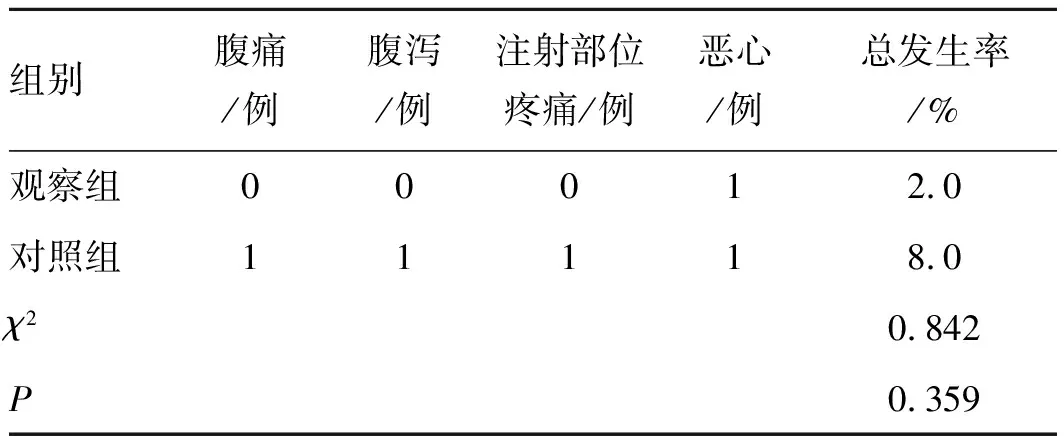
组别腹痛/例腹泻/例注射部位疼痛/例恶心/例总发生率/%观察组00012.0对照组11118.0χ20.842P0.359
3 讨论
肺炎支原体的特点是没有细胞壁,能独立实现自我复制。感染肺炎支原体的致病机制复杂,现代医学认为MPP的病理生理过程为病原体肺炎支原体侵入呼吸道后,寄生于纤毛之间,并黏附在上皮细胞(EC)表面,对抗吞噬细胞的吞噬与黏膜纤毛的清除;再通过合成过氧化氢刺激呼吸道EC产生氧化应激反应、分泌相关毒素等途径,侵袭、损伤呼吸道上皮,造成组织损伤,进而引起呼吸系统症状[8]。针对早期MPP临床主要以大环内酯类抗菌药物进行抗肺炎支原体治疗,阿奇霉素治疗MPP的作用机制与优势包括:①通过与肺炎支原体核糖体50S亚基结合,抑制其转肽过程,阻断RNA的蛋白合成,但对核酸的合成无影响,进而起到有效抗肺炎支原体的作用;②通过促进细胞外基质蛋白分泌、减少活性氧产生和抑制巨噬细胞表达等方式,减轻中性粒细胞浸润及阻止趋化因子与炎性因子释放,从而达到抗炎效果;③具有免疫调节等药理作用;④阿奇霉素具有组织穿透力强、半衰期长(药效持久)、疗程短和不良反应少等优势[9-11]。
研究显示[12],健康体检儿童均存在一定程度的脂溶性维生素A、D2、E缺乏问题。维生素D缺乏与儿童肺炎、哮喘、毛细支气管炎、肺结核和反复呼吸道感染等呼吸系统疾病的发生密切相关[13-14]。Larkin A等[15]研究指出,儿童(≤5岁)发生急性下呼吸道感染的风险及严重程度与维生素D缺乏相关,及时补充维生素D是一种低风险、低成本的有效干预手段。脂溶性维生素(包括A、D2、E、K1)属体内营养素,具有维持机体正常代谢及功能的作用,脂溶性维生素除了维持体内正常的生理功能外,还具有增强免疫功能、调节细胞因子等作用,因此无论是否缺乏维生素,适时补充适量的维生素都是很有必要的,尤其是在病理状态下[16]。研究显示,观察组(脂溶性维生素联合阿奇霉素)治疗14 d后总有效率达94.0%,较给予阿奇霉素治疗的对照组(78.0%)明显增高,且观察组咳嗽、哮鸣音、喘憋、肺部阴影和湿罗音等临床症状消失时间较对照组均显著缩短,此结果与谢辉[17]的报道相似;提示脂溶性维生素联合阿奇霉素治疗小儿MPP的效果切实。另外本研究中2组患儿用药不良反应均以轻微腹痛、腹泻和恶心等症状为主,观察组不良反应率(2.0%)低于对照组(8.0%);说明本联合疗法对减少MPP患儿不良反应更有利,究其原因可能与脂溶性维生素具有解痉、镇痛及类激素样作用有关;但2组差异无统计学意义,导致此结果的原因可能是本研究样本量相对较少。
促炎/抗炎因子失衡在小儿MPP的发生发展中起到了重要作用,IFN-γ和IL-1β等促炎因子均处于高表达状态,继而激活、加速体内炎症反应;IL-10和TGF-β等抗炎因子表达能力减小,从而对炎性反应扩展和巨噬细胞功能的抑制作用减弱;形成恶性循环,最终造成肺部组织持续损伤,病情加重[18]。本研究中观察组治疗后血清IFN-γ和IL-1β水平较对照组同期均显著更低,IL-10和TGF-β水平则均显著提高;提示脂溶性维生素联合阿奇霉素治疗方案在重建MPP患儿体内促炎/抗炎因子平衡上优势显著。分析原因可能与脂溶性维生素能通过抑制Th1细胞反应(下调IFN-γ和IL-2等细胞因子表达)、增强Th2细胞功能(促进IL-10和IL-4等分泌),进而纠正Th1/Th2平衡密切相关[19]。有报道[20],Treg/Th17细胞参与了小儿MPP的整个病理生理过程,正常生理状态下,体内Treg/Th17细胞处于免疫平衡状态,可保持机体内环境稳态;当肺炎支原体侵入肺部组织后,导致Treg细胞凋亡,引起免疫抑制功能降低;Th17细胞属促炎细胞,此时处于过度激活状态,可借助多种途径介导肺部组织炎症反应,出现免疫损伤;因此小儿MPP体内Treg/Th17细胞比率失衡,且与病情严重程度相关。本研究中观察组同期外周血Treg细胞比例、Treg/Th17比值较对照组治疗后均显著提高,Th17细胞比例则显著降低;说明小儿MPP采取本联合方案治疗在调控患儿Treg/Th17细胞平衡方面更具优势。顾磊等[20]研究表明,脂溶性维生素可通过抑制Th17细胞生物活性、转录、维持、分化等方式,抑制Th17细胞功能。这可能也是本研究加入脂溶性维生素治疗而发挥增效调节Treg/Th17细胞平衡的关键原因之一。
综上所述,小儿MPP应用脂溶性维生素联合阿奇霉素治疗可明显改善患儿症状体征,调控体内促炎/抗炎平衡和Treg/Th17细胞平衡,疗效显著,安全性高,值得临床推广应用。

