循环肿瘤DNA中ESR1突变在激素受体阳性晚期乳腺癌内分泌治疗中的价值研究△
刘斌亮,马飞#,陈闪闪,易宗毕,管秀雯,黎立喜,曾益新
1国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科,北京100021
2中国医学科学院北京协和医学院,北京100021
乳腺癌是全世界范围内最常见的女性恶性肿瘤,70%的患者雌激素受体(estrogen receptor,ER)阳性,内分泌治疗是该部分患者重要的治疗方法之一[1-2]。虽然绝大多数ER阳性的患者可以从内分泌治疗中获益,但是,患者在治疗过程中会不可避免地产生内分泌治疗的耐药[3]。编码ERα的基因——雌激素受体1(estrogen receptor 1,ESR1)基因异常是导致内分泌治疗耐药最常见的原因[4]。ESR1突变将引起ER活性的提高和ER表达的上调,甚至可以产生不依赖雌激素的自发活性[3,5]。对于采用多线内分泌治疗,尤其是既往使用芳香化酶抑制药(aromatase inhibitor,AI)后发生疾病进展的患者,ESR1突变率明显上升[5-6]。接受内分泌治疗后,15%~30%的乳腺癌患者会出现ESR1配体结合区域(ligand binding domain,LBD)的突变,其中,以D538G及Y537S位点突变最为常见。有研究证实,ESR1突变将缩短后续AI类药物的无进展生存期(progression free survival,PFS),产生内分泌治疗耐药[7]。氟维司群是一种新型ER拮抗剂,对于使用AI后出现耐药或者进展的患者有效。多个研究证明,ESR1突变的患者对氟维司群相对敏感,氟维司群的疗效优于AI[5,8-9]。循环肿瘤DNA(circulating tumor DNA,ctDNA)常携带肿瘤相关的单核苷酸变异、拷贝数改变及结构变异等遗传学改变,这一特点促使ctDNA成为潜在的生物标志物[10]。微滴式数字聚合酶链反应(droplet digital polymerase chain reaction,ddPCR)技术可以检测到≥0.001%的任何基因突变,是目前ctDNA中检测ESR1突变的最常用方法[6,11]。虽然ESR1突变在内分泌治疗耐药中的作用已得到广泛的研究,但是ESR1的检测在临床中尚未得到足够的重视。目前,尚无中国人群ESR1突变情况的报道,对于ESR1突变患者的后续治疗尚无一致性结论。因此,本研究利用ddPCR技术检测ctDNA中ESR1的突变情况,旨在探索ESR1突变在乳腺癌内分泌治疗中的具体影响,为晚期乳腺癌的治疗提供策略和参考依据,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年5月至2017年12月中国医学科学院北京协和医学院肿瘤医院收治的53例激素受体阳性的晚期乳腺癌患者作为研究对象。纳入标准:①女性,年龄≥18岁;②均经病理检查确诊为乳腺癌;③穿刺或手术切除标本免疫组织化学染色结果为激素受体阳性;④有可测量病灶;⑤临床分期均为Ⅳ期;⑥主要器官功能正常。排除标准:①怀孕期、哺乳期妇女;②合并外周神经系统障碍或有明显精神障碍及中枢神经系统障碍史;③合并严重的心血管疾病、肝病(如肝硬化等)、呼吸系统疾病、肾脏疾病或不能控制的糖尿病或高脂血症。53例患者的年龄为31~79岁,平均年龄为(52.7±11.4)岁;原发灶位置:左侧29例,右侧24例;手术方式:保乳手术8例,根治性切除术32例,术式不详3例,无法手术10例(初治晚期患者)。53例患者中,10例患者为初治Ⅳ期患者,诊断时即已发生转移,其余43例患者为复发转移的患者。入组患者中,除了2例患者未行术后辅助内分泌治疗以及1例患者于术后放疗中即出现复发,转入晚期治疗外,其余患者均给予标准的辅助放化疗和内分泌治疗。患者及家属均对本研究知情并签署知情同意书,本研究经医院医学伦理委员会审核批准。
1.2 ddPCR检测ctDNA中的ESR1突变
1.2.1 样本采集 于内分泌治疗前抽取患者的肘正中静脉血10 ml于EDTA抗凝管中,采集2 h内需进行离心处理。全血标本在4℃的温度下离心10 min,离心速度为4143 r/min,离心半径为12 cm。离心后分离上层血浆,并在4℃的温度下离心10 min,离心速度为12 023 r/min,离心半径为12 cm。去除残余的细胞及细胞碎片;血浆和相应的血细胞标本置于-80℃的冰箱中保存待测。严格按照Mag-MAX™Cell-Free DNA Isolation Ki(t购自美国Applied Biosystems公司)说明书步骤提取血清游离DNA,提取的游离DNA样本保存于-20℃冰箱中。
1.2.2 特异性引物探针设计 根据人ESR1基因序列,采用Beacon DesignerTM8.12软件设计检测ESR1基因Y537S和D538G位点的序列特异性寡核苷酸引物和探针[由生工生物工程(上海)股份有限公司合成]。(表1、表2)
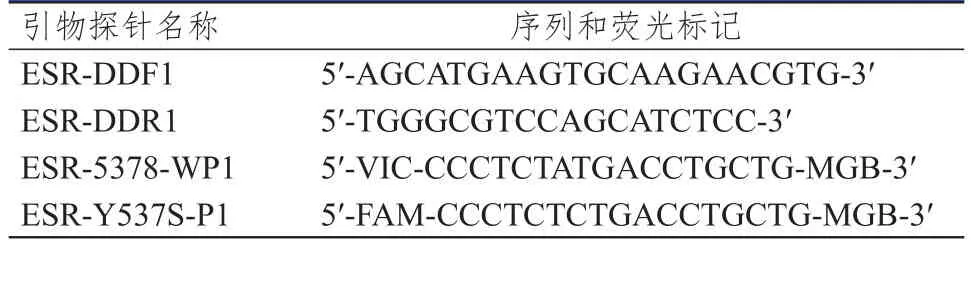
表1 人ESR1基因Y537S位点ddPCR特异性寡核苷酸引物探针

表2 人ESR1基因D538G位点ddPCR特异性寡核苷酸引物探针
1.2.3 数字PCR检测游离DNA中的ESR1突变QuantStudio™3D数字PCR系统采用高密度纳升微流控芯片,结合特异性引物和Taqman探针技术,以FAM(蓝色荧光)和VIC(绿色荧光)分别标记识别突变型DNA和非突变型DNA的探针,将样本分到20 000个单独反应孔中,单独进行PCR扩增,从而实现“单分子模板PCR扩增”;扩增结束后,通过对呈现两种信号类型的反应孔比例和数目进行统计学分析,计算出原始样本中的模板拷贝数,从而实现对样本突变的分析。ESR1突变丰度≥0.01%定义为ESR1突变。按照QuantStudio™3D数字PCR系统标准流程进行操作。反应体系:7.5 μl QuantStudio™ 3D digital PCR Master Mix v2;1.2 μl 10 μmol/L上游和下游引物;0.3 μl 10 μmol/L野生型和突变型探针;20 ng模板(ctDNA样本);去离子水补足15 μl终体积。反应条件:96℃10 min 1个循环;57℃2 min,98 ℃ 30 s,共39个循环;57℃ 2 min,1个循环,最终将温度降至10℃进行保存。
1.3 ESR1突变与内分泌治疗效果的关系
为了评估ctDNA检测ESR1对疗效评价的时效性,同时记录患者影像学或肿瘤标志物水平以评估肿瘤进展的时间,两者之差即为ctDNA提前发现肿瘤进展的时间。
根据实体瘤疗效评价标准1.1版[12],每2~3个月对患者的临床疗效评估1次。原发性内分泌治疗耐药指的是患者术后辅助内分泌治疗2年内出现复发转移,或转移性乳腺癌经内分泌治疗6个月内出现疾病进展。继发性内分泌治疗耐药指的是术后辅助内分泌治疗2年后出现复发转移,或于完成辅助内分泌治疗后12个月内出现复发转移,或转移性乳腺癌经内分泌治疗超过6个月出现疾病进展[11]。PFS指从治疗开始至疾病进展或死亡的时间。未达到疾病进展或死亡的患者,计算其末次随访时间。在本研究中,若ESR1检测时患者处于内分泌治疗中,则记录该内分泌治疗的PFS;若检测时患者处于化疗中,则选取检测时间后1年内最近的一次内分泌治疗的PFS。为了探索应用氟维司群的最佳时机,本研究根据内分泌治疗所处的线数将入组患者进行分组。因纳入的一线内分泌治疗的例数较少,因此,将患者分为一、二线组(n=11)和≥三线组(n=10)。
1.4 随访
所有患者的随访截止日期为2018年5月20日,随访时间为0.53~28.97个月,中位随访时间为5.03个月。
1.5 统计学分析
采用SPSS 19.0软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验。计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。建立COX比例风险回归模型进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 ESR1检测结果与患者基线资料
53例患者中,ESR1突变患者为21例,ESR1非突变患者32例。21例ESR1突变患者中,6例患者D538G 突变,突变率为28.6%(6/21);13例患者Y537S突变,突变率为 61.9%(13/21);2例患者D538G和Y537S双位点突变,突变率为9.5%(2/21)。根据ESR1的突变情况将患者分为ESR1突变组和ESR1非突变组。ESR1突变组最常见的转移部位是骨和肝,且ESR1突变组的肝转移率为66.7%(14/21),高于ESR1非突变组的34.4%(11/32),差异有统计学意义(χ2=5.306,P=0.021)。两组患者的病理类型、Luminal分型、月经情况、肿瘤家族史等基线资料比较,差异均无统计学意义(P>0.05)(表1)。
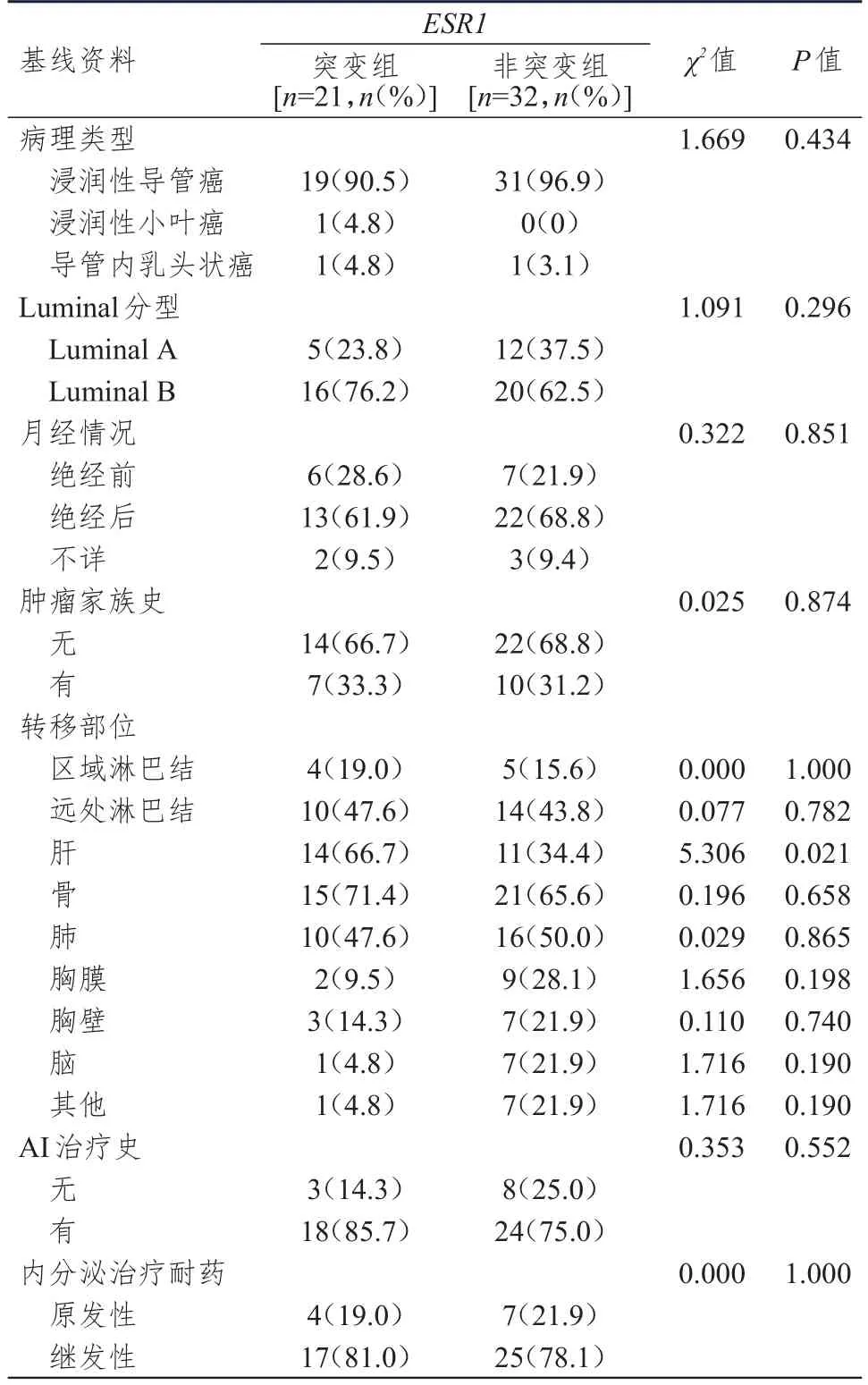
表1 ESR1突变和ESR1非突变患者的基线资料比较
在21例ESR1突变患者中,7例患者及时更改治疗方案,且均将化疗作为下一步的治疗计划;12例患者继续采用原方案进行治疗;1例患者因身体状态极差无法继续接受治疗;1例患者死亡。
2.2 ESR1突变与内分泌治疗的关系
ESR1非突变组的平均内分泌治疗线数为(1.50±1.14)线,明显少于ESR1突变组的(2.62±1.20)线,差异有统计学意义(t=-3.427,P<0.01)。既往使用过AI患者的ESR1突变率为42.9%(18/42),既往未使用过AI的患者的ESR1突变率为27.3%(3/11),两组比较,差异无统计学意义(P>0.05)。
2.3 ESR1突变与内分泌治疗效果的关系
2.3.1 ctDNA检测ESR1对疗效评价的时效性本研究发现,相较于传统的影像学或者肿瘤标志物评估方法,ctDNA可平均提前70.1天发现疾病进展。
2.3.2ESR1突变与PFS的关系 本研究的随访率为100%,49例患者到达研究终点。ESR1非突变组的中位 PFS 为5.8个月(95%CI:2.9~8.7),ESR1突变组患者的中位PFS为4.6个月(95%CI:3.7~5.5),两组患者的中位PFS比较,差异无统计学意义(χ2=3.194,P>0.05)。(图1)
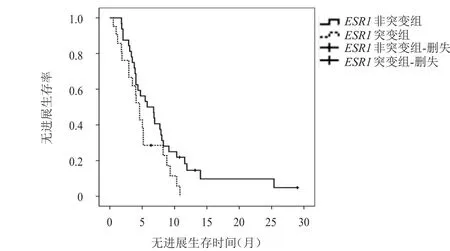
图1 ESR1突变组(n=32)与ESR1非突变组(n=21)的无进展生存曲线
2.3.3 氟维司群治疗对ESR1突变者PFS的影响在ESR1突变的患者中,氟维司群治疗者13例,非氟维司群治疗者8例(托瑞米芬4例,来曲唑1例,依西美坦3例)。氟维司群治疗组患者的中位PFS为5.2个月(95%CI:3.9~6.4),HR=0.37(0.14~0.97),长于非氟维司群治疗组患者的2.9个月(95%CI:0.6~5.3),HR=0.37(0.14~0.97),差异有统计学意义(χ2=4.556,P<0.05)(图2)。一、二线治疗组中,氟维司群治疗患者的中位PFS为5.0个月,虽长于非氟维司群治疗的2.9个月,HR=0.40(0.10~1.62),但差异无统计学意义(χ2=1.857,P>0.05)。≥三线治疗组中,氟维司群治疗患者的中位PFS为5.2个月,长于非氟维司群治疗患者的2.1个月,差异有统计学意义(χ2=4.116,P<0.05)。
3 讨论
本研究是目前已知的中国人群中最大规模的检测ctDNA中ESR1突变的临床研究。本研究发现激素受体阳性晚期乳腺癌的ESR1突变率为39.6%,与FERGI和SoFEA研究结果的37.3%和39.1%基本一致[8,13],但明显高于Toy等[14]的结果,可能原因与本研究纳入患者多为经治多次有关。此外,本研究发现ESR1突变中Y537S突变比例高达61.9%,远超既往文献报道[14-15]。主要原因考虑为本研究例数较少,但因为目前并无中国人群ESR1突变情况的统计,种群差异并不能完全除外。
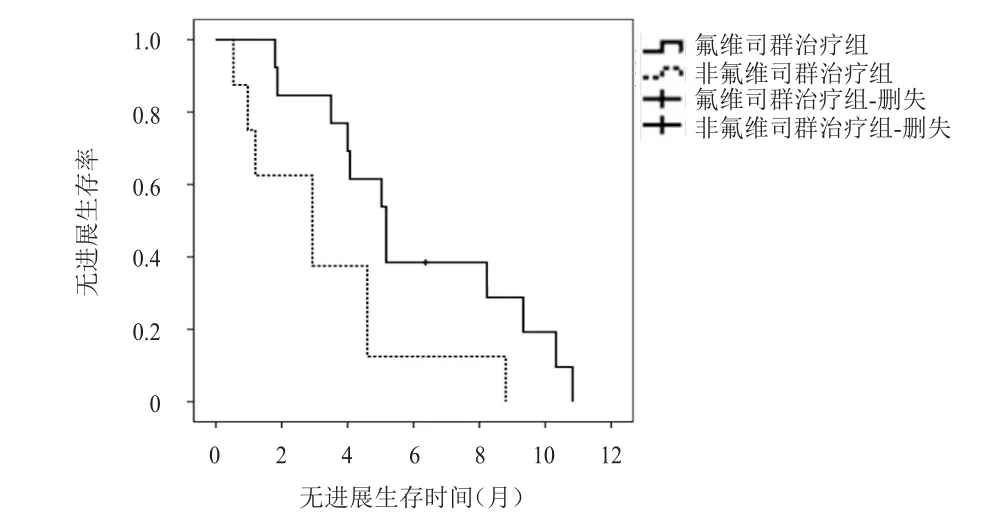
图2 氟维司群治疗组(n=13)和非氟维司群治疗组(n=8)的无进展生存曲线
与既往文献报道相似,本研究发现ESR1突变多见于多线内分泌治疗的患者中。机制可能是内分泌治疗压力下ESR1突变作为具有生存优势的基因被选择,逐渐成为肿瘤中占主导地位的细胞株[16]。除此以外,本研究发现ESR1突变人群的肝转移率高于非ESR1突变人群,提示对明确已知ESR1突变的患者或多线内分泌治疗之后的晚期患者及时、定期、规范地使用肝脏超声、腹部增强CT或MR评估复查肝脏是十分必要的。
ESR1突变将产生AI类药物的完全耐药和他莫昔芬、氟维司群的部分耐药[6]。SOFEA临床试验证明了ESR1突变患者中使用氟维司群比依西美坦有更长的PDF[8]。本研究也证实了ESR1突变者有较短的PFS,且氟维司群相较于AI类药物可以带来更多的治疗获益。在不同内分泌治疗线数的亚组分析中,发现氟维司群在后线内分泌治疗中优势更加明显。其可能原因是后线内分泌治疗群体中内分泌治疗的耐药性升高,因而更能体现氟维司群克服ESR1突变耐药的优势。
ESR1突变在临床中的应用仍然是疑惑重重。在本研究中,仅有1/3的ESR1突变患者根据基因检测报告及时更换当前的治疗方案。此外,虽然发现ctDNA可以比影像学或者肿瘤标志物平均提前70.1天发现肿瘤进展,但鉴于患者定期复查时间和肿瘤进展间固有的时间差,其真正领先时间及可靠性尚无法明确。因此,是否应该根据ESR1突变结果立即调整治疗方案以及如何选择最佳的后续治疗方案都是亟需解决的问题。
即使氟维司群在内分泌治疗中的地位逐步上升,但该研究发现其在ESR1突变群体的各线中位PFS时间仅3~5个月,耐药后的进一步治疗没有统一的标准。随着苯卓昔芬、RAD1901、GDC0810等新型雌激素受体拮抗剂在体内外实验中表现出较好的疗效[14,17],今后将会有更多手段治疗内分泌治疗耐药的患者。
ctDNA无创、方便等优势为ESR1突变的动态监测提供了可靠的平台。ESR1突变的监测应当从明确诊断乳腺癌开始,贯穿整个内分泌治疗过程,从而进一步揭示ESR1突变产生的时机及与预后的关系,优化临床决策。尽早发现ESR1突变以便及时采取更优的治疗方案。其实除了ESR1外,涉及内分泌治疗耐药的基因还包括分子磷脂酰肌醇-3-激酶、TP53、人表皮生长因子受体2、表皮生长因子受体等多种基因[18]。因此 Sefrioui等[19]、Gu 和Fuqua[20]提出了一个较为合理的监测体系和方法:在乳腺癌患者接受治疗前,使用NGS测序技术得出乳腺癌基线时的相关的突变,了解如ESR1,PI3K,TP53,HER-2,EGFR等基因突变的全貌以全面评估肿瘤的情况。针对性的治疗后再定期用ddPCR去确认原先存在的突变,并比较治疗前后的突变频率是一种合理的方法。

