非色散原子荧光光谱法同时检测硒和铅的光源干扰校正方法研究
陶 琛 李春生* 初威澄 高冉冉 周志恒李云梦 马振予 田 地*
1(吉林大学仪器科学与电气工程学院,长春 130026)2(北京博晖创新光电技术股份有限公司,北京 102206)3(中国科学院长春光学精密机械与物理研究所,长春130033)
1 引 言
硒(Se)元素具有抗氧化、提高免疫力等生理生化功能[1],并因其抗癌作用而被广泛应用于富硒大米、富硒酵母、蒜类植物等食品和营养品中[2,3]。同时,过多摄入Se也会引起中毒[4],所以对Se的准确检测尤为重要。目前,Se的检测方法主要有比色法[5]、原子吸收光谱法(Atomic absorption spectroscopy, AAS)[6]、电感耦合等离子体质谱法(Inductively coupled plasma mass spectrometry, ICP-MS)[7]等,而氢化物发生-原子荧光光谱法(Hydride generation atomic fluorescence spectroscopy,HG-AFS)以其灵敏度高和多元素同时检测等优点被广泛应用[8~11]。
空心阴极灯(Hollow cathode lamp,HCL)是HG-AFS最为常用的激发光源,已有研究发现部分光源存在灯芯干扰问题[12],如贾亚青等[13]发现Se元素HCL发射谱中含有铅(Pb)元素干扰谱线。由于纯Se阴极熔点较低(217 °C),当采用高强度短脉冲的HCL激发方式时,会在很短时间内使得灯芯温度迅速升高,并造成阴极融化和溅射,影响光源的激发强度及使用寿命。而采用SePb合金阴极可使阴极熔点升至1065 °C,光源可以拥有更强的激发强度和更长的使用寿命。此外,元素提纯技术的工艺和成本很高,SePb合金的使用也进一步降低了HCL的制造成本。但现有的AFS为非色散检测方式,当采用SePb合金阴极的Se元素HCL对Se、Pb同时测定时,会导致将样品中的Pb误测定为Se,造成测定结果的失真。由于Pb对人体是有毒害[14,15],上述问题也限制了HG-AFS对Se、Pb同时测定技术及方法的进一步扩展和应用。
本研究对Se和Pb元素HCL的发射谱线和激发荧光进行检测和分析,根据HG-AFS仪器不同检测通道获得的荧光强度关系,提出光源干扰因子法对检测结果进行校正。对Se和Pb同时测定过程中K3[Fe(CN)6]、HCl和KBH4浓度进行优化,并通过对实际样品的测试对校正效果进行比较和验证。
2 实验部分
2.1 仪器及实验条件
采用Ocean Optics Maya2000 Pro光谱仪对Se和Pb元素的HCL(北京有色院金属研究总院)发射谱线进行检测,光谱仪采集积分时间设置为500 ms。SA-7800型非色散-双通道原子荧光光谱仪(北京博晖创新光电技术股份有限公司),仪器结构见图1,实验条件见表1。
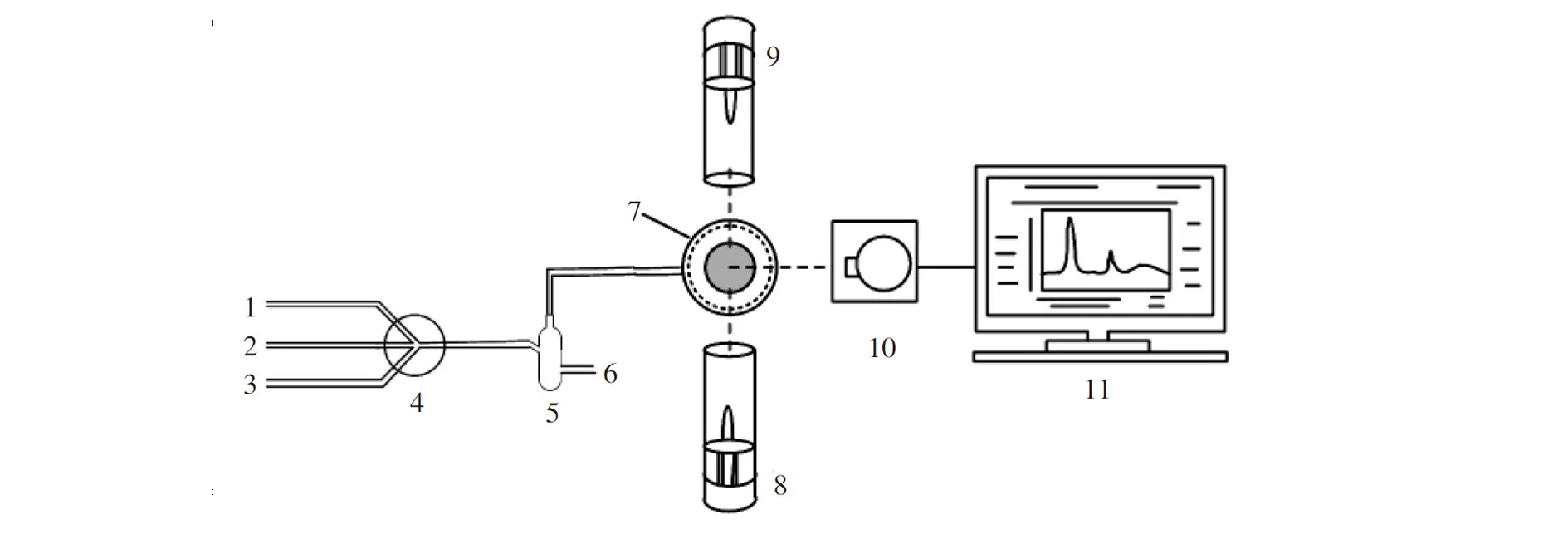
图1 氢化物发生-原子荧光光谱(HG-AFS)装置功能框图:(1)样品; (2)还原剂; (3)载气; (4)反应模块; (5)气液分离器; (6)废液; (7)原子化器; (8)Se元素空心阴极灯; (9)Pb元素空心阴极灯; (10)光电倍增管; (11)上位机Fig.1 Schematic diagram of experiment setup of hydride generation atomic fluorescence spectroscopy (HG-AFS): (1) Sample; (2) Reducing agent; (3) Carrier gas; (4) Reaction module; (5) Gas-liquid separator; (6) Waste liquid; (7) Atomizer; (8) Se hollow cathode lamp (HCL); (9) Pb HCL; (10) Photomultiplier tube (PMT); (11) Computer
表1 SA-7800型非色散-双通道原子荧光光谱仪仪器主要工作参数
Table 1 Main analytical parameters of SA-7800 AFS

参数 Parameter设定值 Setting value载气流量 Flow rate of carrier gas400 mL/min屏蔽气流量 Flow rate of shield gas850 mL/min原子化器温度 Temperature of atomizer200℃原子化器高度 Height of atomizer8 mm样品流速 Sample flow rate0.1 mL/s还原剂流速 Reductant flow rate0.05 mL/sSe灯电流 Lamp primary/boost current of Se60 mA/30 mAPb灯电流 Lamp primary/boost current of Pb60 mA/30 mA读数方式 Detecting mode峰面积 Peak area读数时间 Detecting time16 sPMT负高压 Negative high voltage of PMT260 V
2.2 样品制备
HCl和NaOH为优级纯,KBH4和 K3[Fe(CN)6]为分析纯(国药集团化学试剂有限公司); 超纯水(阻抗>18 MΩ cm); Se标准储备液(1000 μg/mL)、Pb标准储备液(1000 μg/mL)(国家标准物质中心),用其稀释成浓度为50 μg/L的Pb标准系列溶液,以及浓度为2、4、8、10、20和50 μg/L的Se和Pb标准系列混合溶液,摇匀并放置10 min后测定。
称取固体试样加入HNO3(5 mL)和HClO4(2 mL)于锥形瓶(250 mL)中,置于电热板上低温加热至试样溶解。继续升温至溶液呈微沸状态,至冒浓黄烟,待溶液剩余1 mL时,取下,冷却后加入超纯水20 mL,在电热板上加热赶酸至近干,冷却至室温,移入50 mL容量瓶中,用超纯水定容,待溶液澄清后与标准系列溶液一起测定。
3 结果与讨论
3.1 光源干扰分析
应用Ocean Optics Maya2000 Pro光谱仪分别对Se和Pb元素HCL发射谱进行了比较分析。检测结果如图2所示。在图2B中可以观察到Se元素HCL在196.0、203.9、206.3和207.5 nm的发射谱线,其中196.0和203.9 nm为Se元素的主要分析线。在210~290nm范围内的发射谱线与图2A的Pb元素HCL发射谱线完全重叠,但强度较弱,分析这部分发射谱线是由于Se元素HCL阴极中的Pb激发造成的,其中217.0、261.3和283.3 nm为Pb的主要分析线。由于Se元素HCL中存在的Pb干扰,当使用非色散HG-AFS仪器对Se、Pb进行同时测定时,样品中的Pb元素产生的所有荧光信号也会作为Se元素的荧光信号加以接收,最终导致Se元素的测量值偏大,影响对样品中Se元素真实含量的检测分析。
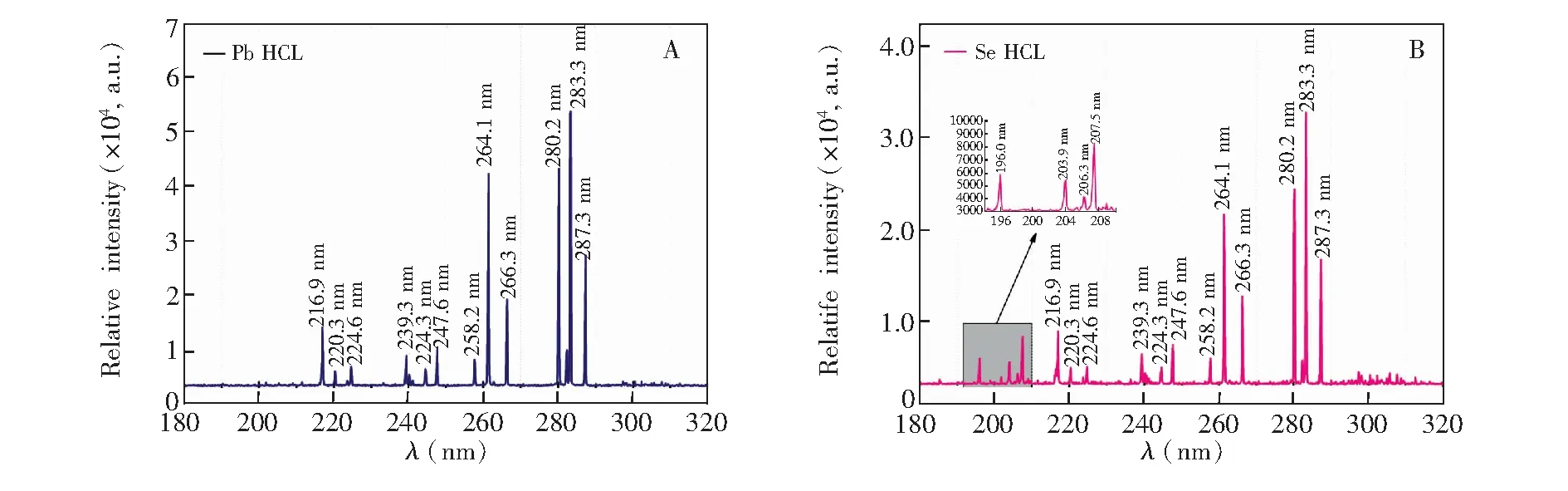
图2 (A)Pb元素空心阴极灯的发射谱; (B)Se元素空心阴极灯的发射谱Fig.2 (A) Emission spectrum of Pb HCL; (B) Emission spectrum of Se HCL
3.2 光源干扰校正
3.2.1光源干扰因子法当形成原子蒸汽的化学反应条件、原子化器和载气等条件相对固定时,若i元素光源中含有n种元素的光源干扰时,光源干扰因子为Ini和Inn的比值,M为检测总次数,如下式所示。Ini表示激发一种只含有n元素(光源干扰元素)的标准样品时,用i元素灯激发,且在i元素(待测元素)通道获得的n元素所产生的干扰荧光强度;Inn表示用第n元素灯激发,且在第n元素通道获得的荧光强度。
(1)
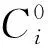
(2)
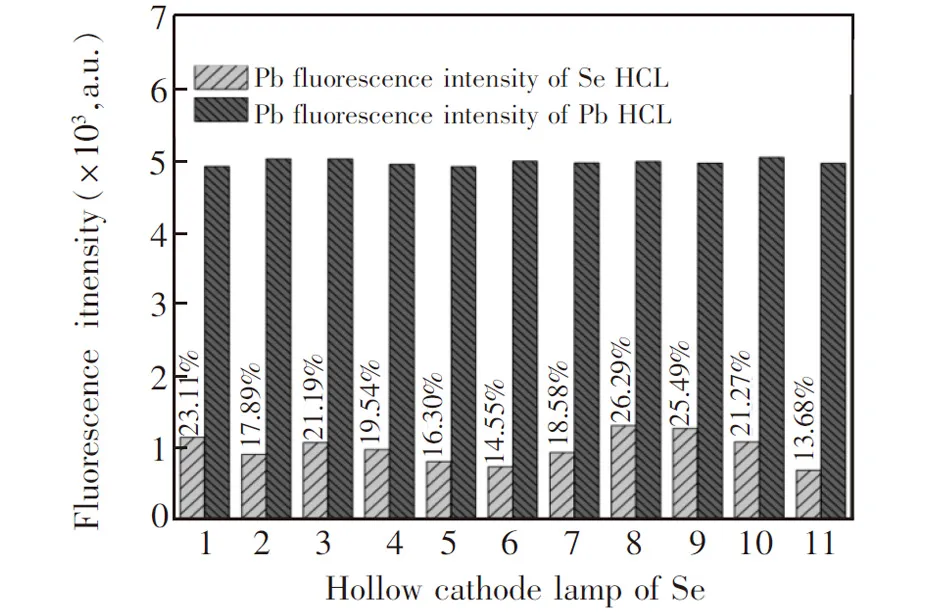
图3 11支Se灯的光源干扰因子比对Fig.3 Interference factors of 11 Se HCLs
样品中含量较高,且对待测元素的测定可能产生干扰的主体元素都应分别测定光源干扰因子,并在随后校准曲线和分析样品等工作时,都需要对检测结果进行校正。
3.2.2Se光源干扰因子计算由于Se元素HCL中仅发现了Pb的光谱干扰,为进一步验证光源干扰对检测结果的影响。使用50 μg/L的Pb标准溶液 (纯干扰元素)分别对11支北京有色院金属研究总院的Se元素HCL中的光源干扰因子进行检测,结果如图3所示。根据实验结果可知,这11支光源干扰因子的分布区间在13.68%~26.29%。由于激发光源位置和预热时间都会影响干扰因子的计算,每次实验之前需重新对选定光源进行干扰因子的检测实验。在检测过程中,还需要保证光源的激发状态稳定,且检测过程中不能随意调整光源位置和电流强度。为进一步研究Se和Pb同时测定的其它影响因素,下列实验选用干扰因子为26.29%的Se元素HCL进行。
3.3 Se和Pb同时测定的条件优化
3.3.1K3[Fe(CN)6]浓度的影响采用50 μg/L的Se、Pb混合标液,对 K3[Fe(CN)6]浓度在0%到1.0%(w/V)变化时的Se、Pb同时测定的荧光信号进行了观察和校正,结果如图5所示。增加 K3[Fe(CN)6]浓度有利于Pb的荧光激发(图4曲线C),由于反应过程中需要加入 K3[Fe(CN)6]作为氧化剂将Pb(Ⅱ)氧化成Pb(Ⅳ),不稳定的新生态Pb(Ⅳ)迅速与Fe形成稳定的络合物,才可以被KBH4还原生成氢化物。校正后的Se荧光强度变化(图4b)同样说明Se不会受到 K3[Fe(CN)6]浓度变化的影响。 K3[Fe(CN)6]为0.4%(w/V)时适于Se和Pb的同时测定,以下实验还会通过同时改变还原剂中 K3[Fe(CN)6]的含量验证光源干扰因子法对检测结果的校正效果。
3.3.2HCl浓度的影响对HCl浓度变化从1.5%(w/V)到8%(w/V)时Se和Pb同时测定的激发荧光进行了检测和校正,结果如图5所示。校正后的Se荧光强度(图5曲线c)与未加 K3[Fe(CN)6]的还原剂测得的检测结果(图5曲线a)变化趋势基本一致。当HCl浓度小于1%(w/V)时,Se荧光信号较低,HCl浓度增加有利于提高Se荧光信号激发,但过高的HCl浓度会抑制对Pb还原反应。当HCl的浓度为2.8%(w/V)时,适于Se和Pb的同时测定,且反应体系稳定。
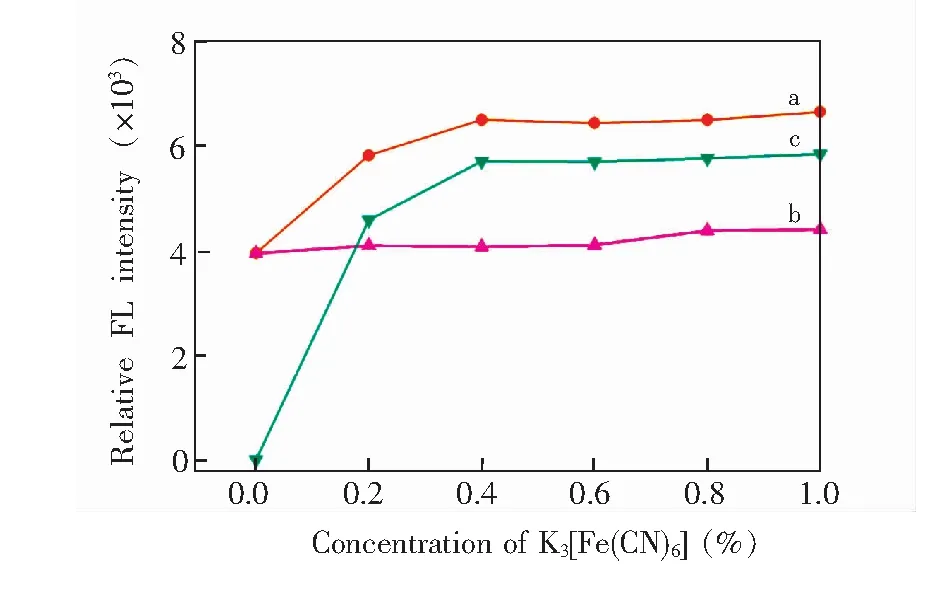
图4 K3[Fe(CN)6]浓度对Se和Pb荧光强度的影响Fig.4 Effect of K3[Fe(CN)6] concentration on fluorescence intensity of Se and Pba. Se(Before correction); b. Se(After correction); c. Pb

图5 HCl浓度对Se和Pb荧光强度的影响Fig.5 Effect of HCl concentration on fluorescence intensity of Se and Pba. K3[Fe(CN)6]/Without K3[Fe(CN)6]; b. Before correction; c. After correction; d. Pb
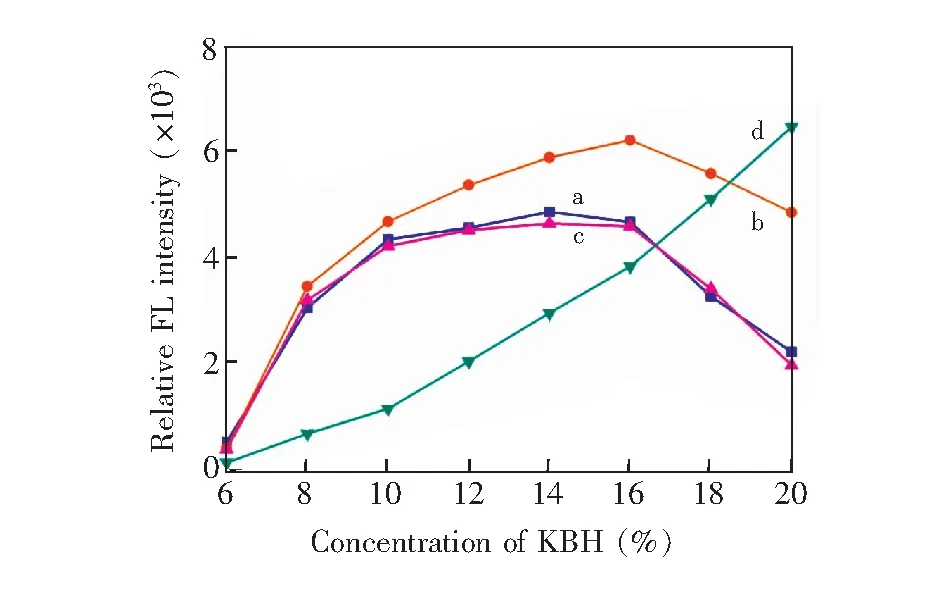
图6 KBH4浓度对Se和Pb荧光强度的影响Fig.6 Effect of KBH4 concentration on fluorescence intensity of Se and Pba. K3[Fe(CN)6]/Without K3[Fe(CN)6]; b. Before correction; c. After correction; d. Pb
3.3.3KBH4浓度的影响KBH4作为产生氢化物气体常用的还原剂,若KBH4浓度过高,则可能产生过量的氢气而导致被测元素氢化物气体被稀释,荧光信号强度降低; KBH4浓度过低,则可能使被测元素氢化物反应不完全,影响方法的灵敏度。本实验KBH4变化从6%(w/V)到20%(w/V)时,考察了KBH4浓度与Se和Pb同时测定时的荧光强度关系,结果如图6所示。结果表明,校正后的Se荧光强度(图6曲线c)与未加 K3[Fe(CN)6]的还原剂测得的检测结果(图6曲线a)变化趋势基本一致。KBH4浓度为16%(w/V)时,Se的校正信号(图6曲线c)和Pb(图6曲线d)表现出较好激发效果。
3.4 方法的分析性能和实际样品分析
在最佳实验条件下,2~50 μg/L范围内获得Se的标准曲线r1=0.9995,Pb的标准曲线r2=0.9997。检出限分别为0.034 μg/L(Se)和0.019 μg/L(Pb)。方法精密度为0.85%(10 μg/L,Se,n=9)和0.47%(10 μg/L,Pb,n=9)。满足食品样品的分析要求。
对国家标准物质大米GBW10010(GSB-1)和小麦GBW10011(GSB-2)的Se和Pb元素进行同时测定,实验结果见表2。由于标准曲线及样品测定过程中Se元素检测结果受到Pb元素的干扰,未校正的结果产生失真,无法反映检测结果的真实情况,用本方法校正后的Se测定结果与标准值吻合。此外,对豆奶中的Se和Pb元素进行加标回收实验,结果见表3。未校正的Se元素检测结果虽然满足回收率要求,但检测过程中同样受到了Pb元素的干扰,因此结果不可信。用本方法校正后的Se和Pb元素回收率在94.5%~108%之间,满足检测要求。
表2 标准样品测定
Table 2 Test results of standard sample
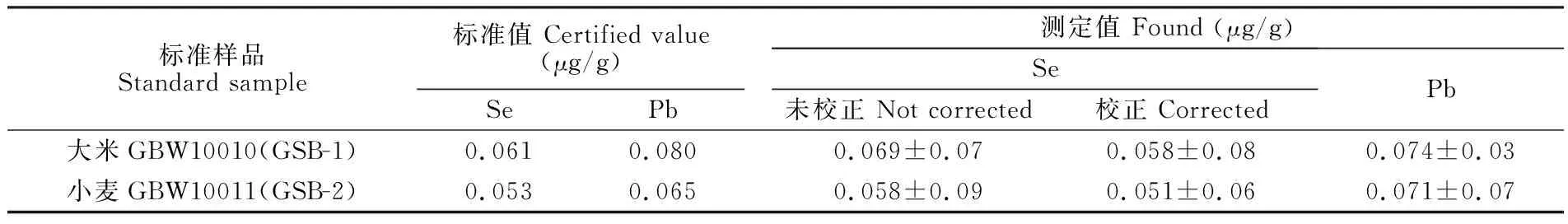
标准样品Standard sample标准值 Certified value(μg/g)SePb测定值 Found (μg/g)Se未校正 Not corrected校正 CorrectedPb大米GBW10010(GSB-1)0.0610.0800.069±0.070.058±0.080.074±0.03小麦GBW10011(GSB-2)0.0530.0650.058±0.090.051±0.060.071±0.07
表3 豆粉样品回收率实验结果
Table 3 Recovery of soy flour sample

加入量 Spiked(μg/L)SePb测定值 Found (μg/L)Se未校正Not corrected校正CorrectedPb加标回收率 Recovery(%)Se未校正Not corrected校正CorrectedPb000.08±0.060.12±0.05N.D.---111.14±0.081.21±0.081.08±0.06107109108.0222.17±0.072.28±0.071.89±0.0910610894.5
上述结果表明,采用光源干扰因子校正方法可以对Se和Pb同时测定的Se检测结果进行有效校正,校正后的检测结果与标准值相符。

