基于巯基-炔基点击化学的苯硼酸功能化材料的制备及其在糖蛋白/糖肽选择性富集中的应用研究
张丽媛 王立恒 王丽莉 董佩佩 刘和真 赵艳艳*
1(大连医科大学药学院,大连116044) 2(大连医科大学基础医学院,大连 116044)3(大连市第二人民医院骨科康复中心,大连 116001)
1 引 言
蛋白质的糖基化是最重要的翻译后修饰之一,其在细胞表面识别、免疫应答、蛋白质折叠、转运、神经传导等生物转化过程中都起着重要的作用[1]。因此,糖蛋白质组学研究在生物学和临床应用中都具有重要的地位[2,3]。然而,糖蛋白在生物样品中丰度较低,在质谱检测时易被其它非糖蛋白抑制,因此需发展高效的糖肽/糖蛋白的分离富集方法,以提高糖肽/糖蛋白的鉴定效率[4,5]。
目前,糖肽/糖蛋白的分离富集方法主要有凝集素亲和法[6]、肼化学法[7]、亲水相互作用法[8]、硼亲和色谱法[9]和体积排阻法[10]等,这些方法各有优缺点。其中硼亲和色谱法富集糖肽/糖蛋白,是通过调节溶液的pH值使得硼酸亲和材料上的硼酸基团与糖分子的1,2-顺式二羟基产生可逆结合,碱性条件下结合,酸性条件下解离,上样富集条件的pH值对糖肽/糖蛋白的保留起到重要作用[11]。硼亲和色谱法具有显著的优势,如操作简单、富集无偏向性和重现性好等。新型硼酸亲和材料的开发作为硼亲和色谱法的核心领域,引起研究者极大关注。现有的方法多在提高糖蛋白/糖肽富集选择性的同时,兼顾生物相容性,合成操作简便。
点击化学反应具有选择性高、转化率高、条件温和等特点,在诸多领域得到了广泛的发展与应用[12~14]。目前应用最多的点击化学反应是叠氮-炔基加成反应(CuAAC)[15]。然而,CuAAC反应使用Cu作为催化剂,残留的重金属Cu会带来生物毒性,限制了其的应用。无铜催化的“点击化学”巯基-烯基加成反应[16,17]不仅操作简单、反应高效,而且避免了CuAAC反应由重金属Cu带来生物毒性的问题,生物相容性好,适用于硼酸亲和材料的制备。Zhang等[18]采用巯基-烯基点击化学法合成了一种硼酸亲和作用的磁性纳米颗粒材料; 杨帆等[19]采用同样的合成方法合成了一种有机-无机杂化硼酸亲和整体柱,并用于糖蛋白的选择性富集,分离选择性较好。 相比较巯基-烯基的点击化学反应,基于巯基-炔基的反应的功能基团键合量更高。然而,目前没有采用基于巯基-炔基点击化学法合成硼酸亲和材料的报道。硼酸亲和材料的基质有聚合物整体柱[19,20]、纳米颗粒[21,22]、磁珠[18]、金属氧化物[23]等。相比其它类型基质,硅胶是高效液相色谱载体最常用的基质类型,具有更为实用的应用价值,在大规模糖蛋白质组学中的应用研究前景较好。因此,开发生物相容性好、键合量高、制备方法简便的硅胶基质硼酸亲和材料十分必要。
本研究基于巯基-炔基无铜催化的“点击”化学反应,将4-巯基苯硼酸键合到炔基修饰的硅胶表面。制备了一种以硅胶为基质的新型硼酸功能化材料(Thiol-yne boronic acid functionalized material, TYBA),利用红外光谱对材料进行表征,确定键合反应成功。在优化条件的基础上,以HRP、IgG、RNaseB和BSA为研究对象,分别考察材料对糖肽和糖蛋白的富集选择性, 并将TYBA材料应用于实际人血清样品中糖蛋白的选择性富集。
2 实验部分
2.1 仪器与试剂
Ultraflex III MALDI-TOF/TOF MS 质谱仪(德国Bruker 公司); SDS 凝胶电泳槽(北京市六一仪器厂)。
炔基硅胶(实验室自制); 2,2′-偶氮二异丁腈、4-巯基苯硼酸、NH4HCO3、甲酸(分析纯,北京百灵威公司); 冰醋酸、甲醇、乙醇(化学纯,天津市科密欧化学试剂有限公司); 乙腈(质谱级,德国Darmstadt公司); 辣根过氧化物酶(HRP)、核糖核酸酶B(RNaseB)、牛血清白蛋白(BSA)、免疫球蛋白G(IgG)、二硫苏糖醇(DTT)、碘乙酰胺(IAA),2,5-二羟基苯甲酸(2,5-DHB)、尿素(美国Sigma公司); 胰蛋白酶(Madison, WI, 美国); 正常人血清(北京索莱宝科技有限公司); 考马斯亮蓝(Coomassie brilliant blue R-250,北京索莱宝科技有限公司)。
2.2 巯基-炔基硼酸功能化材料(TYBA)的制备
巯基-炔基硼酸功能化材料的合成反应如图1所示,操作过程如下:称取16 mg偶氮二异丁腈(AIBN)加入到含有4-巯基苯硼酸(0.38 g)的甲醇(5 mL)溶液中,然后通过干燥的漏斗向搅拌的反应物中加入0.5 g炔基硅胶(实验室自制,制备方法参照文献[24]),在氮气保护下,65℃持续搅拌反应24 h。 反应体系冷却至室温后,将得到的材料用砂芯漏斗过滤,分别用甲醇和去离子水各洗涤3次,在50℃干燥过夜,即得巯基-炔基硼酸功能化材料(TYBA材料)。

图1 巯基-炔基硼酸功能化材料合成线路图Fig.1 Synthesis route of thiol-yne boronic acid functionalized material (TYBA)
2.3 糖肽富集
2.3.1蛋白质酶解称取0.5 mg HRP,溶于100 μL 含有8 mol/L尿素的50 mmol/L NH4HCO3缓冲溶液中, 56℃反应10 min。加入20 mL 100 mmol/L DTT溶液, 56℃反应1 h。冷却至室温后,将5 μL 50 mmol/L IAA溶液加入到混合物中,并常温避光孵化30 min。将5 mmol/L NH4HCO3溶液与胰蛋白酶以质量比40∶1混合,并在37℃中孵化16 h。所得溶液冷却至室温后,于-80℃保存备用。糖肽富集所用的IgG、RNaseB和BSA的酶解物均用此方法酶解。
2.3.2标准糖蛋白酶解物的富集称取2 mg TYBA材料,加入200 μL 80% ACN溶液,使其成为均匀的混悬液(10 mg/mL)。取50 μL 混悬液与酶解物混合,加入200 μL 80% ACN-氨水溶液(pH 11),室温下涡旋孵化1 h,10000 r/min离心5 min后,弃上清液; 重复加液洗涤1次。再加入200 μL 50% ACN-1% FA溶液洗脱,10000 r/min离心5 min后,上清液冷冻干燥。 加2 μL基质溶液(25 mg/mL DHB, 70% ACN-1% FA)溶解后,进行MALDI-TOF MS 分析,设置线性正离子模式及延迟离子提取方法,延迟时间为90 ns,提取电压为20 kV,每个质谱图由30个激光点的结果加和得到。HRP、RNaseB、IgG的酶解物均用此方法富集。
2.3.3糖蛋白与非糖蛋白酶解液混合物的富集研究对象为HRP-BSA(1∶10,n/n)的酶解液混合物。取50 μL TYBA材料混悬液与酶解液混合物混合,加入200 μL 80% ACN-氨水溶液(pH=11),室温下涡旋孵育1 h,10000 r/min离心5 min后,弃上清液; 重复加液洗涤1次。加入200 μL 50% ACN-1% FA溶液洗脱,10000 r/min离心5 min后,取上清液冷冻干燥。 加2 μL 基质溶液溶解,进行基质辅助激光解吸-飞行时间质谱(MALDI-TOF MS) 分析。所有比例除特别注明外,均为体积比。
2.4 糖蛋白富集
2.4.1糖蛋白与非糖蛋白混合物的富集取3个分别装有50 μL TYBA材料混悬液的EP管,依次加入HRP-BSA(1∶1、1∶10、1∶20,n/n)的蛋白混合溶液进行分析。分别加入200 μL 80% ACN-氨水(pH=11),室温下涡旋孵育1 h,10000 r/min离心5 min后,弃上清液。再加入200 μL 50% ACN-1% FA 溶液洗脱,10000 r/min离心5 min,将所得的洗脱液冷冻干燥,然后进行SDS-PAGE蛋白凝胶电泳。 IgG、RNase B与BSA混合物中的糖蛋白均用此方法富集。
2.4.2多种糖蛋白与非糖蛋白混合物的富集取50 μL TYBA材料混悬液,等摩尔依次加入HRP、IgG、RNaseB和BSA的蛋白溶液混合,再加入200 μL 80% ACN-氨水溶液(pH=11),室温下涡旋孵化1 h,10000 r/min离心5 min后,弃去上清液,重复加液洗涤1次。加入200 μL的50% ACN-1% FA 溶液洗脱,10000 r/min离心5 min,将所得洗脱液冷冻干燥,然后进行SDS-PAGE凝胶电泳。
2.4.3血清样品中糖蛋白的富集取50 μL TYBA材料混悬液与5 μL的正常人血清混合,加入200 μL 80% ACN-氨水溶液(pH=11),室温下涡旋孵化1 h,10000 r/min离心5 min后,弃上清液,重复洗涤1次。再加入200 μL 50% ACN/-1% FA溶液洗脱,室温下涡旋孵化1 h,10000 r/min离心5 min,将所得洗脱液冷冻干燥,然后进行SDS-PAGE蛋白凝胶电泳。
3 结果与讨论
3.1 TYBA材料的表征
基于巯基-炔基的“点击”化学法反应过程如图1所示,4-巯基苯硼酸在氮气保护条件下,以偶氮二异丁腈作为催化剂,键合到炔基硅胶表面。
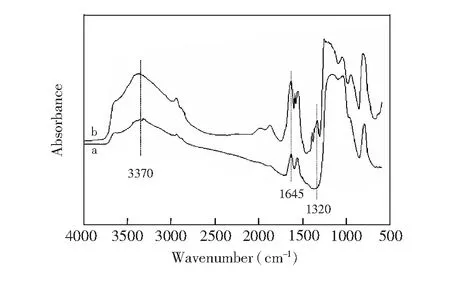
图2 炔基硅胶(a)和TYBA材料(b)的红外图谱Fig.2 Fourier transform-infrared (FT-IR) spectra of (a) alkynyl silicone and (b) TYBA
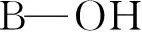
3.2 TYBA材料用于糖肽富集
3.2.1标准糖蛋白酶解物的富集选取两种标准糖蛋白HRP和IgG的胰蛋白酶酶解物作为研究对象,考察所合成的TYBA材料的糖肽富集选择性。首先对TYBA材料的糖肽富集条件进行了优化,硼酸基团可在碱性条件下与糖肽上的糖基结合,在酸性条件下解离。此外,硼酸上的羟基能够提供氢键作用力,因此条件优化过程中同时考虑硼酸亲和作用力和氢键作用力的特点。优化后的上样和孵育条件为高有机相碱性条件,洗脱条件为低有机相酸性条件。
采用MALDI-TOF-MS检测糖肽。以标准糖蛋白HRP和IgG的酶解液为分析对象,考察材料的糖肽富集选择性,结果如图3所示,富集前,HRP酶解液中只检测到5个糖肽信号(m/z3146、3354、3672、3896、4986,图3A); 经TYBA材料富集后,不仅检测到了11个糖肽信号(m/z1843、2001、2531、3146、3208、3322、3354、3672、3896、4057、4986,糖肽信息见表1),糖肽信号强度得到较大程度增强,而且去除了大部分非糖肽杂质的干扰(图3B)。富集前,在IgG酶解液中只检测到3个微弱的糖肽信号(m/z2286、2602、2764,图3C),而经TYBA材料富集后,检测到了8个糖肽信号(m/z2286、2602、2635、2764、2797、2927、2967、3000,图3D,糖肽信息见表2),糖肽信号强度得到较大程度增强,并且去除了大部分非糖肽杂质的干扰。TYBA材料从HRP酶解液中富集的糖肽数量与文献报道的其它材料富集结果有一定差距[20],这是因为TYBA材料采用的是苯硼酸功能基团,其对于糖肽富集选择性弱于文献中所采用的苯并硼氧醇功能基团[25]。尽管如此,所制备的TYBA材料具有较好的糖肽富集选择性,对于HRP和IgG的蛋白酶解液的具有明确的富集效果。整个制备过程未采用重金属,生物相容性好,操作简便,这是TYBA材料作为糖肽选择性富集材料的优势。
图3 MALDI-TOF MS 分析胰酶水解糖蛋白图谱:(A)HRP富集前; (B)HRP富集后; (C)IgG富集前; (D)IgG富集后(图中标注m/z数值均为本研究鉴定出的糖肽信号,未标注m/z数值的信号均为非糖肽信号)Fig.3 Matrix assisted laser desorption ionization time-of-flight mass spectrometry (MALDI-TOF MS) analysis of tryptic digestion of glycoproteins: (A) direct analysis of horseradish peroxidase (HRP); (B) HRP after enrichment; (C) direct analysis of immunoglobulin (IgG); (D) IgG after enrichment. Glycopeptide signals are all marked with m/z, non-glycopeptide signals are not marked with m/z
3.2.2糖蛋白与非糖蛋白酶解物混合物的富集为了进一步验证TYBA材料在非糖肽干扰情况下对糖肽的富集选择性,本研究对HRP-BSA(1∶10,n/n)酶解液混合物进行富集。质谱检测结果如图4所示,富集前从HRP-BSA(1∶10,n/n)酶解液混合物中只检测到2个糖肽信号(m/z3354、3672, 图4A),存在高信号强度的非糖肽杂质峰的干扰; 而酶解液混合物经材料富集后,不仅去除了大部分非糖肽杂质的干扰,还得到了8个高强度的糖肽信号(m/z1843、2531、2851、3146、3354、3672、3896、4986, 图4B)。结果表明,TYBA材料在大量非糖肽干扰情况下仍具有较好的糖肽富集选择性与富集效果。
3.3 TYBA材料用于糖蛋白的富集
3.3.1糖蛋白富集选择性考察选择HRP、IgG、RNaseB作为标准糖蛋白的研究对象,考察TYBA材料对糖蛋白的富集选择性。3种标准糖蛋白结构各有特点,糖型、糖链长度和亲水性大小均有差异。其中HRP中性糖和氨基糖约占18%,主要有甘露糖、木糖和阿拉伯糖等; IgG是血清中免疫球蛋白的主要成分,主要含有中性糖; RNaseB是一种带有甘露糖糖链的糖蛋白。
表1 经TYBA材料富集后鉴定到的HRP酶解物中糖肽信息(糖肽结构信息来源于文献报道[26])
Table 1 Information of glycosylated peptides in HRP after TYBA enrichment (Structure information is from literature[26])

糖肽Glycopeptide糖链结构Glycochain structure氨基酸序列Amino acid sequence富集前Beforeenrichment富集后Afterenrichmentm/z 1843Man3GlcNAc2Fuc1Xyl1NVGLNR√m/z 2001Man4GlcNAc2Fuc1Xyl1NVGLNR√m/z 2531FucGlcNAcSFANSTQTFFNAFVEAMDR√m/z 3146[Hex]3[HexNAc]2[Fuc]1[Xyl]1GLCPLNGNLSALVDFDLR.Oxide√√m/z 3208[Hex]3[HexNAc]2[Xyl]1SFANSTQTFFNAFVEAMDR√m/z 3322[Hex]3[HexNAc]2[Fuc]1[Xyl]1QLTPTFYDNSCPNVSNIVR√m/z 3354[Hex]3[HexNAc]2[Fuc]1[Xyl]1SFANSTQTFFNAFVEAMDR√√m/z 3672[Hex]3[HexNAc]2[Fuc]1[Xyl]1GLIQSDQELFSSPNATDTIPLVR√√m/z 3896[Hex]3[HexNAc]2[Fuc]1[Xyl]1LHFHDCFVNGCI)ASILLDNTTSFR√√m/z 4057[Hex]3[HexNAc]2[Xyl]1QLTPTFYDNSC(AAVESACPR)PNVSNIVR-H2O√m/z 4986[Hex]3[HexNAc]2[Fuc]1[Xyl]1LYN#FSNTGLPDPTLNTTYLQTLR√√
表2 经TYBA材料富集后IgG酶解物中糖肽信息(糖肽结构信息来源于文献报道[26])
Table 2 Information of glycosylated peptides in IgG after TYBA enrichment (Structure information is from literature[26])

糖肽Glycopeptide糖链结构Glycochain structure氨基酸序列Amino acid sequence富集前Beforeenrichment富集后Afterenrichmentm/z 2286[Hex]3[HexNAc]3EEQYNSTYR√√m/z 2602[Hex]3[HexNAc]4[Fuc]1EEQFNSTFR√√m/z 2635[Hex]3[HexNAc]4[Fuc]1EEQYNSTYR√m/z 2764[Hex]4[HexNAc]4[Fuc]1EEQFNSTFR√√m/z 2797[Hex]4[HexNAc]4[Fuc]1EEQYNSTYR√m/z 2927[Hex]5[HexNAc]4[Fuc]1EEQFNSTFR√m/z 2967[Hex]4[Hex7NAc]5[Fuc]1EEQFNSTFR√m/z 3000[Hex]4[HexNAc]5[Fuc]1EEQYNSTYR√

图4 HRP-BSA(1∶10,n/n)富集前(A)和富集后(B)的MALDI-TOF MS 分析图谱(图中标注m/z数值均为本研究鉴定出的糖肽信号,未标注m/z数值的信号均为非糖肽信号)Fig.4 MALDI-TOF MS spectra of tryptic digest of HRP-bovine serum albumin (BSA)(1∶10,n/n). (A) Direct analysis; (B) after enrichment. Glycopeptide signals are all marked with m/z, non-glycopeptide signals are not marked with m/z
3种糖蛋白分别与BSA按照1∶1、1∶10、1∶20的摩尔比混合上样,将洗脱液冷冻干燥,进行SDS-PAGE凝胶电泳分离,结果如图5所示。图5A为HRP的蛋白混合物富集结果,其中2、4、6分别为富集前HRP与BSA以1∶ 1、1∶ 10、1∶ 20的摩尔比混合物的条带,3、5、7为富集后混合物的条带。与富集前相比,TYBA材料富集不仅去除了大量非糖蛋白BSA,而且完全保留了糖蛋白HRP。图5B为IgG的蛋白混合物富集结果,其中2、4、6分别为富集前IgG与BSA以1∶1、1∶10、1∶20的摩尔比混合物条带,3、5、7为富集后混合物的条带,经过富集,不仅去除了非糖蛋白BSA,而且完全保留了糖蛋白IgG。图5C为RNase B的蛋白混合物富集结果,其中2、4、6分别为RNase B与BSA以1∶1、1∶10、1∶20的摩尔比混合物富集前的条带,3、5、7为混合物富集后的条带,经过富集,不仅去除了非糖蛋白BSA,而且完全保留了糖蛋白RNase B。以上结果表明,TYBA材料对糖蛋白具有较好的选择性和富集效果。
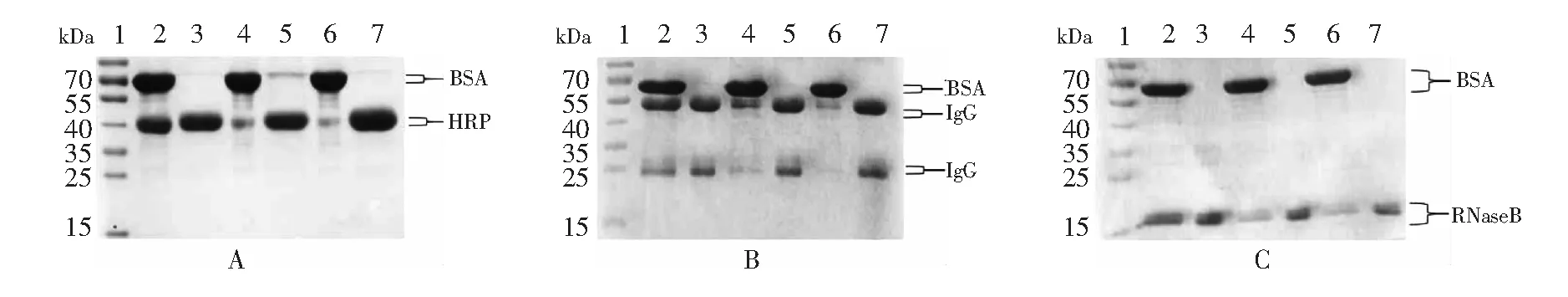
图5 HRP、IgG、RNase B分别与BSA以不同比例混合分离富集的SDS-PAGE凝胶电泳图:(A)1. Marker; 2. HRP∶BSA=1∶1富集前; 3. HRP∶BSA=1∶1富集后; 4. HRP∶BSA=1∶10富集前; 5. HRP∶BSA=1∶10富集后; 6. HRP∶BSA=1∶20富集前; 7. HRP∶BSA=1∶20富集后。(B)1.Marker; 2. IgG∶BSA=1∶1富集前; 3. IgG∶BSA=1∶1富集后; 4. IgG∶BSA=1∶10富集前; 5. IgG∶BSA=1∶10富集后; 6. IgG∶BSA=1∶20富集前; 7. IgG∶BSA=1∶20富集后。(C)1. Marker; 2. RNaseB∶BSA=1∶1富集前; 3. RNase B∶BSA=1∶1富集后; 4.RNase B∶BSA=1∶10富集前; 5. RNase B∶BSA=1∶10富集后; 6. RNase B∶BSA=1∶20富集前; 7. RNaseB∶BSA=1∶20富集后Fig.5 Sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) analysis of enrichment of glycoproteins. (A) 1. Marker; 2. HRP∶BSA=1∶1; 3. HRP∶BSA=1∶1 after enrichment; 4. HRP∶BSA=1∶10; 5 HRP∶BSA=1∶10.after enrichment; 6. HRP∶BSA=1∶20; 7. HRP∶BSA=1∶20 after enrichment. (B) 1. Marker; 2. IgG∶BSA=1∶1; 3. IgG∶BSA=1∶1 after enrichment; 4.IgG∶BSA=1∶10; 5. IgG∶BSA=1∶1 after enrichment 0; 6. IgG∶BSA=1∶20; 7. IgG∶BSA=1∶20 after enrichment. (C) 1. Marker; 2. RNaseB∶BSA=1∶1; 3. RNase B∶BSA=1∶1 after enrichment; 4. RNase B∶BSA=1∶10; 5. RNase B∶BSA=1∶10 after enrichment 6. RNase B∶BSA=1∶20; 7. RNaseB∶BSA=1∶20 after enrichment
3.3.2多种糖蛋白与非糖蛋白混合物的富集效果为了进一步验证本材料同时富集多种糖蛋白的选择性,将此材料应用于多种糖蛋白与非糖蛋白混合物的富集。将HRP、IgG、RNaseB、BSA按照等摩尔比混合上样,洗脱液冷冻干燥后进行SDS-PAGE凝胶电泳分离。如图6所示,与富集前相比,TYBA材料富集去除了非糖蛋白BSA的干扰,3种糖蛋白均得到保留,进一步表明本材料用于富集糖蛋白具有较好的选择性和富集效果。
3.3.3实际样品中糖蛋白的富集效果人血清中主要含有转铁蛋白(Trf)、血清白蛋白(HSA)和免疫球蛋白G(IgG)等,其中Trf、IgG为糖蛋白,HSA为非糖蛋白。将TYBA材料用于正常人血清中糖蛋白的富集,富集前后的SDS-PAGE凝胶电泳结果如图7所示,血清样品在富集前所含蛋白大部分为HSA,含量明显高于Trf和IgG; 经TYBA富集后, 不仅去除了血清中的一些杂质蛋白的条带,非糖蛋白HSA得到较明显的去除,而且糖蛋白Trf和IgG得到了很大程度上的保留。与文献[25]相比,本方法显著提高了糖蛋白HSA的去除效果,表明此材料用于人血清中糖蛋白富集,具有高效性和选择性。
4 结 论
设计并制备了一种基于巯基-炔基点击化学反应的新型苯硼酸功能化TYBA材料,并将其应用于标准和实际样品中糖蛋白和糖肽的选择性富集。结果表明,对标准糖蛋白及其酶解产物中的糖肽,以及人血清样品中的糖蛋白,TYBA材料均展现出优良的富集特异性,具有良好的实际应用前景。
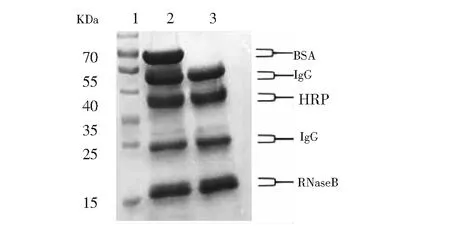
图6 HRP、IgG、RNase B与BSA混合分离富集的SDS-PAGE凝胶电泳图Fig.6 SDS-PAGE analysis of the material applied on the enrichment of glycoproteinsLane 1, Marker; Lane 2, HRP∶IgG∶RNase B∶BSA=1∶1∶1∶1; Lane 3, HRP∶IgG∶RNaseB∶BSA=1∶1∶1∶1 after enrichment

图7 人血清中糖蛋白分离富集的SDS-PAGE凝胶电泳图谱1. Marker; 2. 人血清; 3. 人血清富集后Fig.7 SDS-PAGE analysis of the material appled in the enrichment of human serum1.Marker; 2.human serum; 3. human serum after enrichment

