水稻稻曲病菌PCR快速检测技术及应用
曾 蓉,徐丽慧,吴 雁,高士刚,刘 欣,戴富明
(上海市农业科学院生态环境保护研究所上海市设施园艺重点实验室,上海201403)
稻曲病(Rice false smut)是由稻曲病菌[Ustilasinoideavirens(Cooke)Tak]引起的一种穗部病害,是水稻上最常见的病害之一,发生遍布世界各水稻产区[1]。稻曲病菌有性阶段为Villosiclavavirens(Cooke)Tak,侵染水稻后,能迅速充满整个谷粒,致颖壳基部形成浅黄绿色的菌丝体小块,后膨胀变为墨绿色或深褐色[2-3]。稻曲病能造成严重经济损失,不仅导致水稻产量下降、品质变差,还能在稻粒上产生Ustiloxin-A等6种毒素,人畜误食后会引起食品安全问题[4-6]。因此控制水稻稻曲病的发生,对我国的水稻品质及稻米生产安全显得尤为重要。
目前,沈永安等[7]、Ashizawa等[8]认为土壤中携带稻曲病菌,自然越冬的厚垣孢子可作为初侵染源。然而,黎毓干等[1]、 陈永坚等[3]、刘见平等[9]认为种子带菌是稻曲病的初侵染源,自然感染稻曲病菌的种子的萌发会受到抑制[10-11]。所以,当水稻种子混入稻曲病菌后,田间发生稻曲病的风险增加。本试验建立了基于水稻稻曲病菌的特异性基因序列的PCR快速检测方法,并对生产上的水稻种子进行了快速检测应用,以期为上海市水稻稻曲病的监测预警和快速诊断提供参考依据。
1 材料与方法
1.1 材料
供试菌株:水稻稻曲病菌菌株由浙江省农业科学院植物保护与微生物研究所王艳丽赠送。水稻上其他参考菌株包括禾谷镰刀菌(Fusariumgraminearum)、新月弯孢菌(Curvularialunata)、厚膜孢镰孢菌(Fusariumchlamydosporum),细极链格孢(Alternariatenuissima)、链格孢(Alternariaalternata)、平脐蠕孢(Bipolarissorokiniana)、草茎点霉(Phomaherbarum)、黑孢菌(Nigrosporasp)、立枯丝核菌(Rhizoctoniasolani)、串珠镰刀菌(Fusariummoniliforme)、Epicoccumsorghinum,墨汁鬼伞(Coprinopsisatramentaria)等由本实验室分离保存。
供试种子:上海生产上使用的水稻种子样品(表1)。
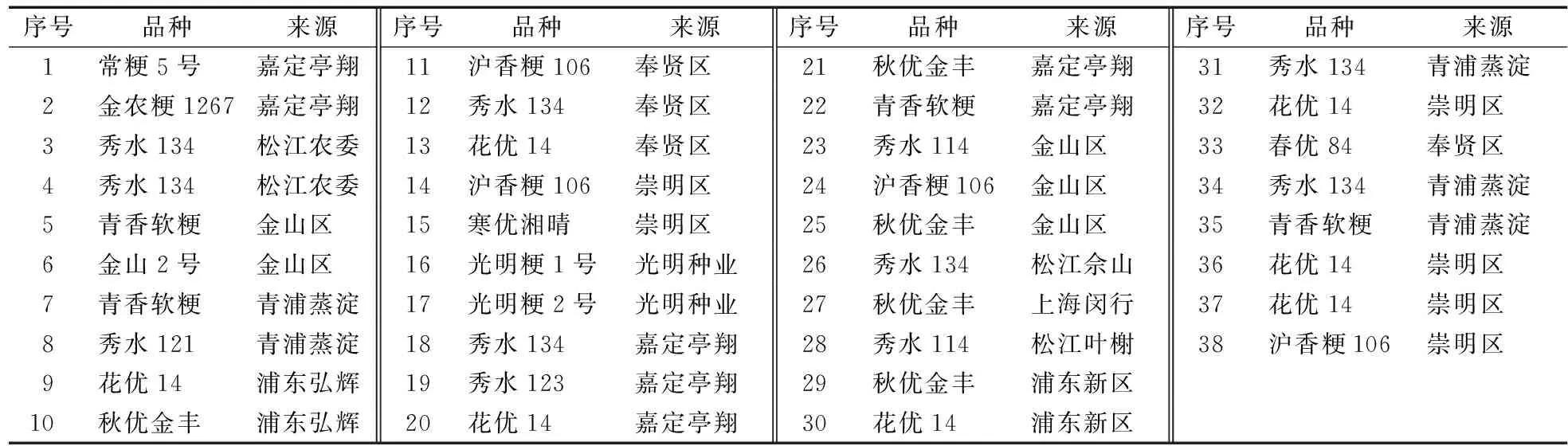
表1 供试水稻种子样品
试剂:Triton X-100,SDS,NaCl,Tris-HCl,EDTA等生化试剂均购自生工生物工程(上海)有限公司;2×EasyTaq PCR SuperMix(+dye),Trans2K Plus II DNA Marker,琼脂糖等分子生物试剂购自北京全式金生物技术有限公司; Quick-DNA PlantSeed购自北京天漠科技开发有限公司。
1.2 方法
菌丝DNA按照Bust n’Grab方法提取[12];待测水稻样品利用Quick-DNA PlantSeed试剂盒(ZYMO)提取。
从GenBank下载U.virens基因组和非冗余数据库((non-redundant database,nr),应用本地BLSATp把U.virens序列逐条与nr进行比对,E-value设置为1×10-10。获得特异性基因,从中挑选出合适的基因并根据其核苷酸序列设计特异性引物。选取引物对UV-788F(GACGATGTTCTGTCCTGTGCG)和UV-788R(GGCTCTTGAAAGGCGTTATCTG)为本研究的扩增引物,拟扩增Accession No.为KDB11756基因部分片段,其包括内含子的序列大小约为788 bp。本研究还以胡茂林等[10]报道的特异性引物对UV279-F(CACACTCCGAAACCCCCCT)和UV693-R(CACATCATTTGCCCCCGTC)为参考,其扩增的目的片段为415 bp。引物由生工生物工程(上海)有限公司合成。
2 结果与分析
2.1 退火温度优化及引物特异性
M:2k plus Marker; 1:55.0 ℃;2:55.7 ℃; 3:56.9 ℃; 4:58.8 ℃; 5:61.1℃; 6:63.0 ℃; 7:64.3℃; 8:65.0 ℃图1 引物退火温度试验Fig.1 The optimum annealing temperatures of UV-788FUV-788R primers
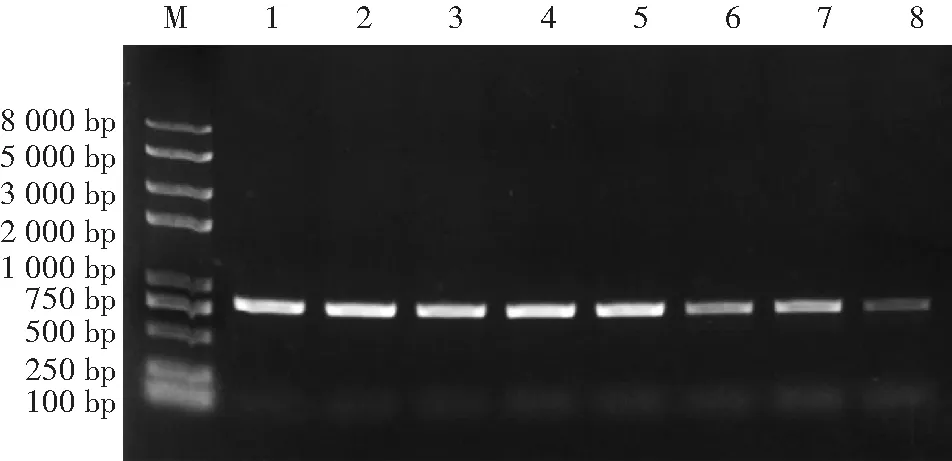
M:2k plus Marker; 1:U.virens;2:F.graminearum; 3:C.lunata; 4:F. chlamydosporum; 5:A.tenuissima; 6:A. alternate; 7:B.sorokiniana; 8:P. herbarum; 9:Nigrospora sp.; 10:R.solani; 11:F.moniliform; 12:E.sorghinum; 13:C.atramentaria;-:健康水稻种子图2 引物特异性试验Fig.2 Primers specificity analysis of U.virens assay
2.2 检测灵敏度

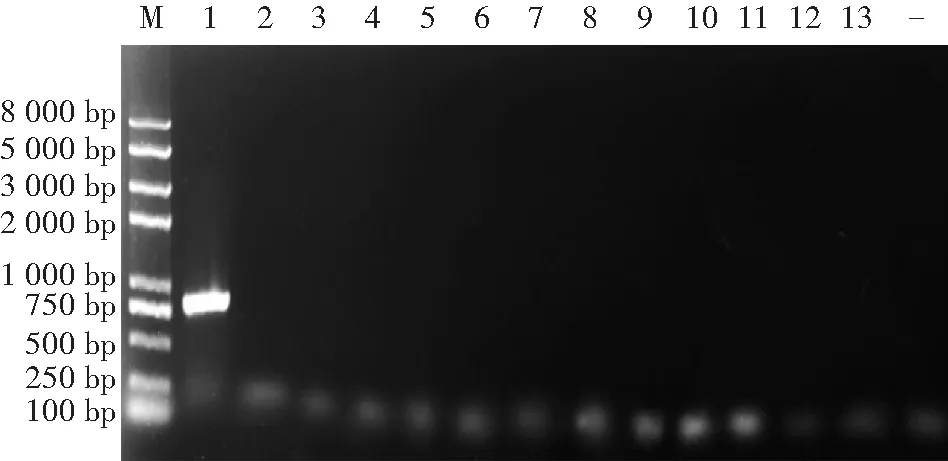
M:2k plus Marker; 1—11:200 ng—200×10-10 ng按1∶10梯度稀释的11个DNA浓度模板;-:健康水稻种子;A:引物对UV-788FUV-788R; B:引物对UV279-FUV279-R图3 PCR检测灵敏度Fig.3 Sensitivity analysis for the detection of U.virens
2.3 种子样品的检测
以上海郊区水稻生产上使用的水稻种子样品为检测对象,利用引物对UV-788FUV-788R检测种子水稻稻曲病的带菌情况。PCR结果显示被检测的38个水稻样品中有13个样品显示为阳性,其余为阴性,部分结果如图4所示。

M:2k plus Marker; 1—22:1—22号种子样品;-:健康水稻种子;+:U.virens DNA阳性对照图4 种子样品的PCR检测Fig.4 PCR detection method application on rice seed
3 讨论
病原真菌的准确鉴定和早期检测是植物病害防治的基础。对于有些难于分离和纯化的真菌病害,传统的分离、检测等不能在菌侵染初期作出快速准确检测,而分子生物学检测技术可以对病菌进行早期诊断及预警,从而可以有效抑制病原菌的传播与病害流行。
真菌的rDNA的ITS(Internal Transcribed Spacer)序列由于其保守性和种特异性,已被广泛的应用于病原菌的鉴定及检测中。但是,ITS序列的保守性往往导致不能特异的区分和鉴定病原物,故利用ITS序列设计引物困难。本研究应用生物信息学方法,对水稻稻曲病菌的全基因组与nr数据库进行比对分析,获得该病原菌的特异性基因后,设计特异性引物用于检测,避免了假阳性的可能。
本研究主要目的是建立水稻种子中稻曲病菌的PCR检测技术,并将其应用于田间或市售种子的检测,最终应用于病害的监测及预警。周永力等[13-14]基于稻曲病菌ITS序列设计了巢式PCR引物,可用于稻曲病菌定性研究。林廷邦[15]也建立了水稻稻曲病PCR和巢式PCR的检测方法,应用于水稻植株和种子的带菌检测。郑静等[16]建立了水稻稻曲病的荧光定量PCR检测方法,理论上最低可检出24 fg的基因组DNA模板量及0.67个分生孢子。巢式PCR和荧光定量PCR检测方法都能十分灵敏的用于病原菌的检测,但巢式PCR有着耗时及易污染的弱点,荧光定量PCR也受限于昂贵的实验设备。本研究建立的水稻稻曲病常规PCR检测方法,为一种特异、灵敏、高效、经济的检测方法,为水稻稻曲病菌的检测及种业健康发展提供了技术支持。

