重组酶聚合酶扩增技术的研究进展及其应用
杜亚楠,赵 笑,范小瑞,张 琪,赵 凯*,许 燕*
(1 上海师范大学生命与环境科学学院,上海200234;2 上海市农业科学院生物技术研究所,上海201106;3 上海市农业遗传育种重点实验室,上海201106)
核酸体外扩增技术是生命科学研究中最常用的技术之一。聚合酶链式反应(Polymerase chain reaction,简称PCR)发明于1983年,目前已经成为应用最为广泛的核酸扩增技术[1]。该技术特异性强、灵敏度高,但需要昂贵的控温循环仪,难以推广到现场检测。
近年来,随着分子生物学技术的不断发展,恒温核酸扩增技术的出现解决了PCR技术在仪器上的局限性。该技术不需要温度循环且反应更加快速,非常适用于资源有限地区的现场检测[2]。目前已报道的的恒温扩增技术有十几种[3]。重组酶聚合酶扩增(Recombinase polymerase amplification,简称RPA)是一种由重组酶、单链DNA结合蛋白和链置换Bsu聚合酶参与的恒温扩增新技术[4],可在23—45℃下连续进行反应,反应时间只需5—20min,特异性强、灵敏度高,非常适用于疾病诊断和现场检测。本文对RPA技术的原理、特点、检测方法进行详细地介绍,并对其在病原体诊断、食品安全检测、基因突变等方面的应用进展进行综述。
1 早期恒温扩增技术的缺点
20世纪以来,生物学家对生物复制机制的研究越来越深入,核酸体外扩增技术得到了快速发展,PCR技术不再唯一不可替代。目前已经报道的恒温扩增技术,除RPA技术以外,还包括环介导等温扩增技术(LAMP)、依赖核酸序列的扩增技术(NASBA)和依赖解旋酶的恒温基因扩增技术(HDA)等。这3种恒温扩增技术特异性强、灵敏度高,但在操作程序、反应温度、反应时间和仪器要求等方面仍然存在各自的弊端(表1)。LAMP、NASBA和HAD虽然无需PCR仪等昂贵的热循环仪,但都需要特定的加热设备。LAMP和NASBA在检测DNA时,都需要对模板进行95℃预变性处理,操作复杂。LAMP和HAD均需在65℃条件下进行退火,而且LAMP需要4—6条引物,设计复杂。另外,LAMP、NASBA和HAD反应时间至少需要60min。总之,LAMP、NASBA和HDA这3种恒温扩增技术都需要特殊的仪器设备和较长的反应时间[5-7]。
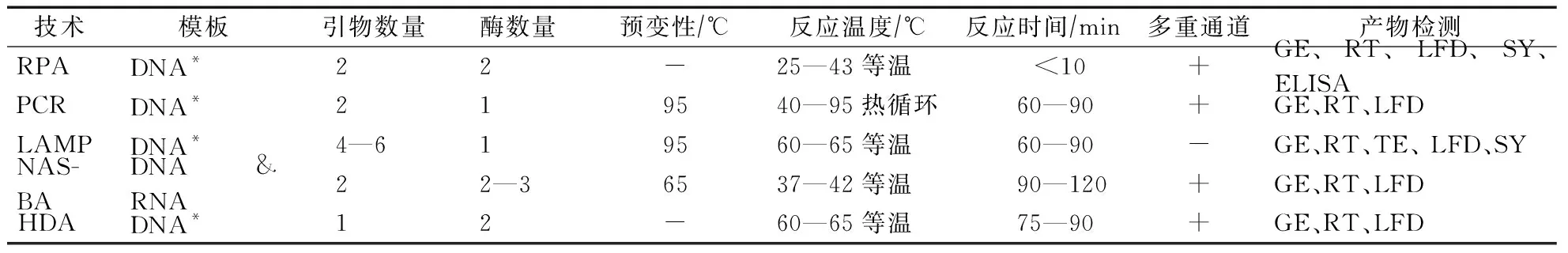
表1 RPA技术与其他核酸扩增方法比较
注:*体系中加入逆转录酶可以扩增 RNA; GE:凝胶电泳;RT:实时荧光监测;TE:浊度法;LFD:侧流层析;SY:染料法
2 RPA技术的原理及特点
2.1 RPA技术的原理
RPA技术是由TwistDx生物技术公司发明的一种体外恒温核酸扩增新技术。该技术主要模仿T4噬菌体内的核酸复制机制[4],依赖重组酶uvsX[8]和单链结合蛋白Gp32在体外恒温条件下实现DNA模板的特异性识别与结合,并通过链置换DNA聚合酶Bsu实现模板DNA的扩增。
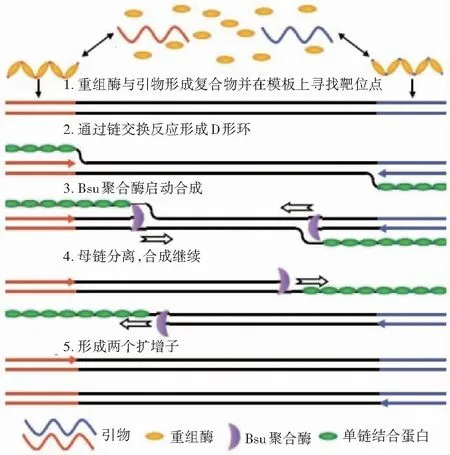
图1 RPA技术的原理Fig.1 RPA technology principle
RPA技术的原理见图1[9]。在ATP的参与下,重组酶uvsX与上游引物(或下游引物)相结合形成重组酶引物复合体,上游引物重组酶复合体能够正向(下游引物重组酶复合体反向)扫描双链DNA模板并识别与引物同源的靶序列,一旦找到,重组酶就可以使此位置的靶序列双链DNA解链,并发生链置换反应,形成D形环结构。这时,单链结合蛋白Gp32与被置换单链结合,防止置换的单链被进一步替换。与此同时,重组酶uvsX离开引物的3’端,链置换DNA聚合酶 Bsu与引物的3’端结合启动链延伸,形成新的互补链。在这个过程中,上游引物和下游引物同时进行反应,最终产生一个完整的扩增子。合成的扩增子可以作为新的模板,最终实现DNA模板的指数扩增。在25—43℃[10,11]恒温条件下,10min内就可以获得可检出的扩增产物[12]。在RPA反应中加入逆转录酶,就可以对 RNA模板进行一步法RT-RPA扩增[13]。
2.2 RPA引物设计
RPA技术的关键在于引物的设计。与传统PCR引物不同,RPA的引物在设计时,一般以30—35 bp长度为宜。引物过短,会降低反应重组率;引物过长(45bp),虽然可以使用,但易形成二级结构。扩增片段最好控制在100—200 bp。其他设计规则可参考常规PCR引物设计[14]。RPA扩增产物长度的下限主要由RPA引物决定,通常扩增产物的长度不低于70bp。目前标准TwistAmp试剂盒只适用小于500bp的扩增子,对100—200bp的模板扩增效果最佳。如果需要设计探针,那么在设计扩增引物时应该留下足够的空间。
2.3 RPA技术的优点
(1)RPA技术在37—42℃恒温条件下进行核酸扩增,既不需要PCR和LAMP中的预变性步骤,也不需要PCR中的热循环及LAMP和HAD中65℃退火高温步骤。这一特点使RPA操作更加简单,无需热循环仪器,减少了所需能量和成本。
(2)RPA反应非常快速,在5—20min就可以完成,远远快于PCR、LAMP、NASBA、HDA等技术。
(3)RPA可以进行多重反应,同时快速检测多种样品。
(4)RPA技术操作简单,RPA TwistAmp®Basic 试剂盒的基础反应体系含有 DNA 扩增所需的重组酶uvsX、单链结合蛋白Gp32、链置换DNA聚合酶Bsu和缓冲液,仅需在Basic 试剂盒的基础反应体系中加入引物和模板即可反应[2]。 RPA反应可以与多种检测方法结合,如与逆转录酶结合可实现RT-RPA扩增,与探针结合可实现实时荧光定量 RPA、侧流层析RPA等。
(5)RPA技术非常适用于现场样品检测。对检测设备要求低,甚至可以利用人体体温对样品进行检测;对检测样品要求低,只需要使用简单的裂解液裂解1 min就可以用作模板,非常适合实地检测。
(6)RPA技术的特异性很好,灵敏度高(1—10拷贝)[4,10],可以与实时荧光定量PCR相媲美[15]。
2.4 RPA反应装置的便携化
RPA最佳反应温度为37—42℃,因此其加热设备能耗较低。近几年,为了简化RPA反应装置,研究者尝试利用物理或化学反应供热[10,16],但易受环境影响且需要良好的保温设备。人体体温为37℃左右,因此可以利用人体温度孵育,手握或放于腋下。此方法非常适用于现场快速检测。
虽然RPA技术可以恒温反应,但该技术仍需要简单的加热设备。近年来,一系列一体化反应和检测装置陆续推出[17-18]。一体化反应装置如Lutz等[17]设计的基于箔片的离心微流控芯片,内含预存的液体和冻干粉反应试剂,以及一个可以在37℃孵育的实时荧光检测装置。一体化检测装置如全封闭式靶核酸扩增物快速检测装置,将RPA反应与侧流层析技术结合,在封闭条件下快速检测扩增产物,非常方便,而且可以避免交叉污染[19]。
2.5 RPA技术的缺点
(1)RPA产物在进行琼脂糖凝胶电泳检测时,必须对产物进行纯化,以避免产物以外其他成分造成的拖带;(2)目前没有专门的软件能够对RPA的引物和探针进行设计和筛选;(3)RPA技术所需要的引物和探针较长,无法对短序列核酸进行检测;(4)反应温度在37℃左右,反应时间短,在同时检测大量样品时,不易控制反应的同时进行。
2.6 RPA技术的成本分析
RPA商业化液体基本试剂盒的成本约为30元(人民币,下同)反应,PCR的试剂成本大约1元反应,LAMP约3元反应。虽然RPA试剂成本较高,但RPA无需昂贵的PCR温度循环仪,只需在常温条件(37℃)下恒温反应5—20min即可。Maria等[20]对RPA和PCR的试剂和时间成本分别进行了比较,发现RPA结合核酸粗提法与PCR的试剂成本相当,如果考虑时间成本,RPA每个反应的总成本比PCR要低得多。虽然LAMP也是恒温反应,但仍然需要65℃退火60min,无法进行多重反应,其成本与RPA相比并没有明显的优势。
3 RPA产物的检测方法
3.1 凝胶电泳检测
RPA基础反应体系除了需要添加重组酶uvsX、单链结合蛋白Gp32、DNA聚合酶Bsu外,其余成分与PCR相同。RPA的扩增产物也是DNA,可以用琼脂糖凝胶电泳进行检测。为了避免体系中其他成分对电泳的影响,产生拖带,需要对扩增产物进行酚-氯仿抽提后进行琼脂糖凝胶电泳,去掉引物、酶等干扰检测的成分。经过EB 染色,在紫外光下,通过凝胶成像仪对目的条带进行检测分析[4];也可以用AxyPrep PCR清洁试剂盒对产物进行纯化,效果比酚-氯仿抽提法更好。
3.2 实时荧光定量RPA
与RPA基础反应体系相比,实时荧光定量RPA是通过加入一个核酸外切酶Ⅲ(exonuclease Ⅲ,即exo)和 exo 荧光探针(根据酶的名称命名为 exo 探针)对模板扩增实现实时监测。exo 荧光探针上有一个脱碱基位点类似物——四氢呋喃(THF)位点,在该位点两侧的胸腺嘧啶上分别标记一个荧光基团和一个淬灭基团,此时荧光强度很低。当探针与靶序列结合时,THF位点就会被核酸外切酶Ⅲ识别并酶解,将荧光基团与淬灭基团分开,使荧光基团荧光强度增强,以此实现模板扩增过程的实时监测。TwistAmp exo探针法就是根据这个原理设计的。使用便携式荧光检测仪(Twista,TwistDX,Cambridge,UK )可在10—20min内检测到荧光曲线,其灵敏度可达到1—10拷贝[4,10]。
3.3 侧流层析(RPA-LFD)检测
RPA-LFD方法是在RPA基础反应体系中加入核酸外切酶Ⅳ(endonuclease Ⅳ,即nfo)、nfo探针(根据酶的名称命名为 nfo 探针)和反向引物(标记生物素或地高辛)。nfo探针也有一个THF位点,其5’端带有荧光基团,3’端带有阻断物。其原理是核酸扩增产物被生物素标记后可以和FAM荧光基团标记的特异性探针杂交。核酸外切酶Ⅳ可以识别并切开nfo探针的THF位点,产生自由的羟基端与DNA聚合酶结合启动延伸过程。最终形成的FAM和生物素双标记的扩增产物,可以使用侧流层析法如“夹心法”的侧流试纸条进行检测。
侧流试纸条上有一条检测线和一条质控线,检测线上含有生物素抗体,对照线上含有固定抗体。其原理是扩增子的FAM与抗FAM抗体的金标物结合后,形成免疫复合物。免疫复合物在试纸条上会进行层析扩散。检测线上的生物素配体可以捕获含有生物素扩增子的免疫复合物并显色。不含生物素的免疫复合物继续扩散,被质控线上的固定抗体捕获,形成具有颜色的质控线。LF-RPA在37—39℃下,一般5—15min便可通过肉眼观察检测线和质控线的颜色来判断检测结果,适用于现场简单快速检测[18]。RPA的产物需要稀释才能使用该方法检测,避免反应底物对试纸上抗体的干扰。
3.4 染料法检测
染料法是使用SYBR GreenⅠ染料对RPA产生的DNA双链进行染色,以此实现对结果的可视化观察。扩增产物双倍稀释后,在微型紫外手电筒的帮助下,就可以通过肉眼观察结果。阴性样品保持无色,阳性样品变为荧光绿色。RPA与染料法结合的方法利用人体体温就可以完成反应,只需10 min即可完成样品的检测过程,因此RPA与染料法结合的方法非常适用于样品的现场检测[12]。
3.5 RPA-ELISA
RPA-ELISA技术是将RPA技术与ELISA技术相结合,将标记的产物与微量滴定板中的5’-生物素化探针(或链霉素亲和素)进行杂交,用比色免疫分析法进行扩增产物分析。RPA-ELISA技术不需要热循环,为常规应用提供了一种灵敏、特异和经济的方法,在资源有限的环境中非常有效[21]。
4 RPA技术的应用
4.1 RPA在病毒检测上的应用
Rohrman等[18]应用RPA-LFD技术快速检测HIV,并成功应用此方法检测干血渍中提取的DNA,非常适用于HIV的现场快速检测。Wahed等[22]将RT-RPA技术应用于手足口病病毒(FMDV)的快速诊断。在埃及2013年的FMDV爆发中,该技术被成功应用于现场FMDV的快速检测和疫情控制。Euler等[23]研发的RPA检测板可以在6—10min内同时检测多种病毒,包括埃博拉病毒、马尔堡病毒、裂谷热病毒、苏丹病毒和天花病毒。该方法特异性强,与人类基因组无交叉反应,检测多种病毒的灵敏度较高,为16拷贝。RPA在植物病毒中的应用也越来越多,Londoo等[20]采用改进的RPA方法检测菜豆金黄花叶病毒属的3种病毒。该方法采用0.5 molL NaOH粗提法获取菜豆黄色花叶病毒、番茄斑点病毒和番茄黄叶卷曲病毒DNA的粗提液,直接用于RPA检测。试验证明RPA检测这3种病毒具有特异性,而PCR不能够检测到粗提液中的DNA病毒。此外,RPA还被应用于玫瑰丛簇病毒、犬细小病毒、腺病毒、黑蜂王台病毒、对虾WSSV和IHHNV病毒等动植物病毒的检测。
4.2 RPA在细菌检测上的应用
2010年,Lutz等[17]最早将RPA与基于铂片的离心微流控盒相结合,对金黄色葡萄球菌的耐药基因(mecA)进行全自动分析,可在20min内检测低至10拷贝的DNA。2014年,Boyle等[9]应用实时荧光定量RPA检测结核分枝杆菌复合群(MTC)的DNA。该方法可以在20min内检测到低至 6.25 fg的DNA模板,其准确性也远远大于荧光显微镜检测。2017年,Kim等[24]应用RPA方法在10min内就可以直接特异地检测到鸡蛋和鸡肉中的沙门氏菌,灵敏度是实时荧光定量PCR方法的100倍。在病毒检测中提到的RPA检测板[23]不仅能检测多种病毒,还能同时检测炭疽杆菌、鼠疫耶尔森菌和土拉弗朗西斯菌,显示出RPA在多重检测方面的巨大潜力。
4.3 RPA在寄生虫检测上的应用
2014年,Kersting等[25]采用RPA-LFD技术检测恶性疟原虫,具有较高的特异性和灵敏度,只需38℃恒温反应10min,非常适合现场检测。2015年,Crannell等[26]应用同样的方法快速检测粪便中贾第鞭毛虫的DNA。在从秘鲁收集的10 000份粪便样品中,使用RPA技术与PCR、显微镜分别进行复合检测,显示出73%的灵敏度和95%的特异性。同年Crannell等[27]还进一步开发了多重RPA-LFD方法,同时检测隐孢子虫、阿米巴虫和贾第鞭毛虫,检测限分别为每个反应446条、449条和444条寄生虫。目前还开发了日本血吸虫、环形泰勒虫、伯氏螺旋体和刚地弓形虫侧流层析试纸条,特异性好、灵敏度高,非常适合现场寄生虫检测。
4.4 RPA在单碱基突变检测上的应用
Gootenberg等[28]将一种靶向RNA的相关酶Cas13a与RPA结合应用于即时病原体诊断、基因型分析和疾病监测。其原理是Cas13a能够对目标RNA进行切割,也不会失去活性,而且可以通过 “附带切割”切割其他的非靶RNA。这种技术也被称为“SHERLOCK”。由于SHERLOCK试剂可以以冻干粉的形式长期储存,再结合基于试纸条的检测方法,非常适合于在资源有限地区的疾病现场诊断。Shin 等[29]将RPA与等温固相扩增检测(ISAD)技术结合快速检测癌症单碱基突变。Martorell等[30]开发了一种阻断RPA结合芯片杂交技术检测PIK3CA基因中的突变,如p.E545K和p.H1047L。该技术主要利用一段阻断的寡核苷酸(3’末端的双脱氧胞苷)。该寡核苷酸与野生型基因目标位点可以结合,而与突变基因不结合,从而减少野生型基因被扩增的比例,使突变基因更容易被检测。采用比色法能够在高达95%的野生型DNA的情况下有效地区分PIK3CA基因中的突变,如p.E545K和p.H1047L。该方法已成功用于各种癌细胞系以及肿瘤组织的基因分型。
4.5 RPA在食品安全上的应用
吴建等[12]应用RPA技术检测转基因大豆GTS 40-3-2,使用荧光染料实现反应结果的可视化,结合简单的样品制备,整个检测过程在10 min内就可以完成。Santiago等[21]将RPA技术与ELISA技术结合起来,应用于食品安全方面的检测,如过敏原(榛子、花生、大豆、番茄和玉米)、转基因植物(P35S和TNOS)、食源性致病菌和真菌的检测。RPA-ELISA具有反应迅速、操作简便、环境要求低等优势,非常适合食品现场快速检测以及在基层推广应用。本实验室应用实时荧光定量RPA技术检测转基因玉米Bt11中外源基因的nos终止子,测得其相对检测限约为0.1%,远低于欧盟国家设定的转基因最低限量(0.9%),灵敏度较高,绝对检测限约为50拷贝。目前,本实验室正在进行RPA和RT-RPA结合凝胶电泳法和染料法,在植物病毒和转基因植物检测方面进行研究。
5 展望
虽然RPA技术出现的时间并不长,但是它具有反应时间短、高灵敏度等优越性,引起了生物学家的广泛关注。该技术目前与电泳法、探针法、侧流层析法、染色法、ELISA等方法已广泛应用于病原体诊断、食品安全检测及基因突变等方面。但RPA技术需要较长的引物和探针,而且目前没有专业的软件可以进行RPA引物设计,主要靠大量合成与筛选。但是其低温、恒温和反应快速的优点使它被看做是可以替代甚至超越PCR的核酸扩增技术。
随着对RPA技术研究的深入,可以对RPA基础反应体系基本成分进行进一步探究,寻找重组酶聚合酶的替代品,降低成本。在反应温度方面,虽然是37—42℃恒温反应,但是也需要简单的加热设备。可以通过进一步的研究,在不影响其特异性、灵敏度和反应速度的基础上,拓宽反应的温度范围,结合集核酸简单抽提、反应、检测一体化装置的研究,使其更加完善,更好地应用于生命科学的各个领域。

