氟化聚合物/双微胶囊自修复防污涂层的研究
董岸杰,张朋生,叶展鹏,邓联东,张建华
氟化聚合物/双微胶囊自修复防污涂层的研究
董岸杰1, 2,张朋生1,叶展鹏1,邓联东1,张建华1
(1. 天津大学化工学院,天津 300072;2. 天津化学化工协同创新中心,天津 300072)
针对水下涂层材料在使用过程中产生的微裂纹难以及时修复和海洋生物污损问题,设计开发了一种氟化聚合物/双微胶囊的环氧树脂复合涂层(PFG/Dual-MCs/ER),该复合涂层具有微裂纹自修复和抗生物黏附的双重功能.采用原位乳液聚合法制备了包裹环氧树脂和稀释剂的聚脲醛微胶囊(ER-MCs),采用溶剂蒸发法制备了包裹水下环氧固化剂的聚甲基丙烯酸甲酯微胶囊(UEH-MCs),采用自由基聚合法制备了甲基丙烯酸六氟丁酯(HFBM)与甲基丙烯酸缩水甘油酯(GMA)的无规共聚物(PFG).将两种微胶囊包埋在环氧树脂涂层中并在表面接枝上PFG,制备出PFG/Dual-MCs/ER复合涂层.表征了微胶囊和PFG的结构组成,并检测了涂层的自修复和抗蛋白黏附性能.结果表明,PFG/Dual-MCs/ER复合涂层具有较好的自修复能力,表面接枝PFG使涂层表面对牛血清白蛋白的吸附明显减少.因此,这种兼具自修复和抗蛋白黏附性能,易于制备的PFG/Dual-MCs/ER复合涂层在海洋设施防护领域具有较好的应用前景.
微胶囊;自修复;氟化聚合物;防污涂层
海洋生物污损是指海洋中的细菌、藻类等吸附在各种水下设施表面而极大地影响设施使用性能的现象.通常,浸泡在海水环境中未经处理的表面会在几分钟内吸附有机分子并在表面形成条件膜,随后附着各种海洋生物,严重损害船体和水下设施,维护成本也大幅增加[1-3].有机锡类防污涂层的开发曾是海洋防污领域的一大进展,以其优良较长效的防海洋生物污损性能和价廉易得,得到了广泛的应用.由于有机锡类有毒成分不断排入水中,致使水生生物发生畸形、病变,严重破坏了生态系统的平衡.因而有机锡类涂层已经被国际公约明令禁止,目前急需环境友好型防污涂层的开发[4-5].聚乙二醇(PEG)是一种应用最广泛的非特异性的防污材料,但是PEG在有氧或过渡金属离子条件下很容易氧化,在一定程度上限制了PEG在实际生产中的应用[6].由于低表面能和超疏水性赋予的优良防污性能,氟化聚合物作为防生物污损涂层材料得到了重视[7],但氟化聚合物与基体之间的结合是其实际应用中面临的一个难题.
海洋表面防护涂层还面临另一个问题是水下环境中微裂纹的修复.水下设施的表面涂层在冲击或老化的影响下经常发生微裂纹而难以及时修复,容易造成设施的腐蚀.研究人员对涂层的自修复技术进行了大量研究工作[8].目前研究较为广泛的3种自修复技术分别是微胶囊型自修复、微脉网型自修复以及本征型自修复[9].第一代基于微胶囊的自修复材料使用DCPD-Grubbs’催化体系,但Grubbs’ 催化剂价格昂贵并且在空气中容易氧化[10].之后Kamphaus等[11]为了降低成本采用了WCl6催化剂来替代Grubbs’,成功研制出可以提高热稳定性的自修复材料.Wu 等[12]采用原位聚合法分别制备了聚脲醛包裹4种不同液体芯材(分别是己二异氰酸酯、石蜡、二甲苯以及全氟辛基三乙氧基硅烷)的微胶囊.但这些微胶囊体系不适于常温和水下环境的涂层自修复.此外,在水下设备表面经常使用环氧涂层,关于环氧涂层应用的自修复技术也得到了较快发展,如把包有环氧树脂修复剂的微胶囊混入涂层中,利用微胶囊破裂流出的环氧树脂与涂层内的胺类固化剂反应修复裂纹[13]. 此外还有基于光引发聚合的微胶囊修复技术等[14]. 但这些自修复技术仍难以解决水下环境下的涂层自修复问题.
针对上述问题,本文设计制备了包裹环氧树脂及其稀释剂和包裹水下环氧固化剂的两种微胶囊(ER-MCs、UEH-MCs),和一种环氧基修饰的氟化聚合物(PFG),并通过两步连续涂层的简单方法构建了表面接枝PFG的含有两种微胶囊的环氧树脂复合涂层(PFG/Dual-MCs/ER).研究表明,该复合涂层具有较好的微裂纹自修复效果及抗蛋白黏附性能.因此,本研究中双微胶囊与氟化聚合物的结合为水下设施表面的保护提供了新途径,在海洋工业中具有应用前景.
1 实 验
1.1 实验原料
尿素(纯度99%)、甲醛(纯度37%)、三乙醇胺(纯度99.5%)、十二烷基苯磺酸钠(90%)、柠檬酸(99.5%)、甲基丙烯酸缩水甘油酯(GMA,97%)、二乙烯三胺(分析纯)、间苯二酚(99%)和聚乙烯醇(98%),上海阿拉丁生化科技股份有限公司;偶氮二异丁腈(AIBN)、乙酸乙酯、磷酸二氢钠和磷酸氢二钠,分析纯,天津市江天化工技术有限公司;正丁基缩水甘油醚(分析纯)、聚甲基丙烯酸甲酯(注塑级)、甲基丙烯酸六氟丁酯(HFBM,96%,),摩贝生物科技有限公司;牛血清蛋白,BCA蛋白试剂盒,天津艾克泽生物技术有限公司;铁片,天津钢铁集团有限公司.
1.2 实验仪器
pH计,PHS-3C型,上海精密科学仪器有限公司;场发射扫描电子显微镜,HITACHI S-4800型,日本日立公司;红外光谱仪,Bio-Rad FT-IR 3000型,美国Hercules公司;水接触角测试仪,DSA100型,德国KRUSS公司;核磁共振波谱仪,INOVA-500M型,美国Varian公司.
1.3 双微胶囊的制备
环氧树脂微胶囊的制备:将适量的尿素和甲醛混合均一并充分溶解后用碱液调节溶液的pH值为8.5,随后放置到70,℃的恒温油浴锅中反应1,h,形成线性聚脲醛(PUF)预聚物溶液.将上述制得的预聚物溶液倒入环氧树脂及乳化剂混合溶液中,加入酸液调节混合体系的pH值为2.5~3.5,并保温2,h,反应完毕后将产物冷却至室温并除杂后,放置到25,℃真空干燥箱中干燥48,h,得到的粉末状颗粒物即环氧树脂微胶囊(ER-MCs).
水下环氧固化剂微胶囊的制备:将一定量的810水下环氧树脂固化剂和聚甲基丙烯酸甲酯分别加入到一定量的二氯甲烷中,搅拌使其充分溶解,再加入聚乙烯醇溶液并放置25,℃的恒温水浴锅中,乳化分散30,min后蒸发二氯甲烷,除去多余的芯材和壁材杂质,放置到25,℃真空干燥箱中干燥48,h,得到的粉末状颗粒物即水下环氧固化剂微胶囊(UEH-MCs).
1.4 氟化聚合物的合成
向装有氮气保护装置的三口烧瓶中加入一定量的HFBM和GMA及适量的溶剂二氯甲烷,在磁子搅拌作用下使其充分溶解和混合均一.然后将三口烧瓶放入恒温水浴锅中并固定在数显搅拌器上,调整到一定的转速进行搅拌,向烧瓶中缓慢通入干燥氮气,并加热到一定温度下加入AIBN,反应6,h.单体投料及引发剂的量如表1所示,反应结束后,冷却到室温,透析并冷冻干燥后得到纯净的白色粉末产物即含氟聚合物,记为PFG/y(/为单体HFBM与GMA的摩尔比).
表1 制备氟化聚合物的单体和引发剂的用量
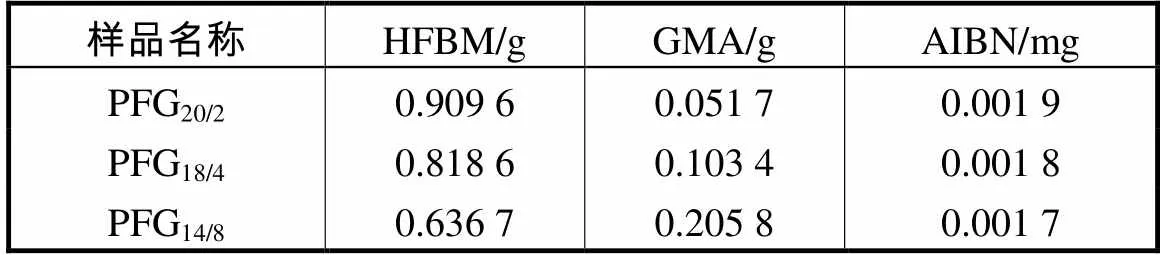
Tab.1 Feed amount of monomer and initiator for synthe-sizing fluorinated polymer
1.5 氟化聚合物/双微胶囊复合涂层的制备
如图1所示,将一定量的环氧树脂E44、二乙烯三胺(DETA)、正丁基缩水甘油醚(BGE)、环氧树脂增韧剂、ER-MCs以及UEH-MCs充分混合后,减压10,min,并将混合物涂布在尺寸为30,mm×70,mm的E235铁片表面,在室温下固化2,h,得到环氧树脂基涂层(Dual-MCs/ER).随后将PFG的乙酸乙酯溶液刷涂在铁片上的环氧树脂涂层表面,反应2,h.反应结束后用大量的乙酸乙酯冲洗掉表面未反应的聚合物,自然冷却至室温,所得涂层即为PFG/Dual-MCs/ER.同样方法制备对照组样品,分别是混合组分中不含有双微胶囊、不含有水下环氧固化剂微胶囊和不含有环氧树脂微胶囊的涂层,分别记为PFG/ER、PFG/ER-MCs/ER和PFG/UEH-MCs/ER.
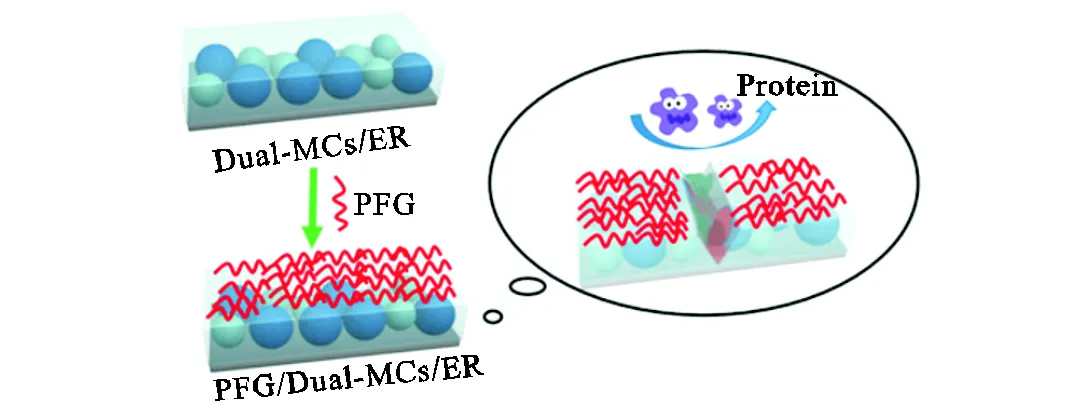
图1 PFG/Dual-MCs/ER涂层形成过程示意
Fig.1 Schematic of PFG/Dual-MCs/ER coating
1.6 结构与性能表征
1.6.1 双微胶囊及涂层的表面形貌表征
采用场发射扫描电子显微镜测试2种微胶囊以及涂层的表面形貌.采用日本日立集团生产的扫描电子显微镜观察2种微胶囊的表面形貌并通过统计法算出微胶囊的平均直径.用导电双面胶将2种微胶囊粉末贴到样品台上,真空环境下镀金90~120,s,然后放在扫描电子显微镜下观察.
1.6.2 双微胶囊的化学结构分析
采用Bio-Rad FT-IR 3000型傅里叶红外光谱仪测定双微胶囊的各组分.固体样品采用溴化钾压片法制备.液体样品采用涂膜法制备,取少量的待测液体样品溶于丙酮并在空白溴化钾表面涂膜,之后放入照射灯下使溶剂完全挥发,测量其透光度.测试条件为室温,波数范围为4,000~500,cm-1.扫描次数为256次.
1.6.3 双微胶囊的核壳质量比测定
环氧树脂微胶囊芯材含量的测定:取一定量的干燥微胶囊称其质量,记为0,并将上述干燥微胶囊充分研磨并放入布氏漏斗中用丙酮冲洗数次直到完全除去芯材,过滤,剩余的微胶囊壳层放入恒温干燥箱中干燥后称其质量,记为1.则环氧树脂微胶囊的芯材含量(ER)的计算式为

(1)
水下环氧固化剂微胶囊芯材含量的测定:将微胶囊近似看成标准的球体,则水下环氧固化剂微胶囊的芯材含量(UEH)的计算式为
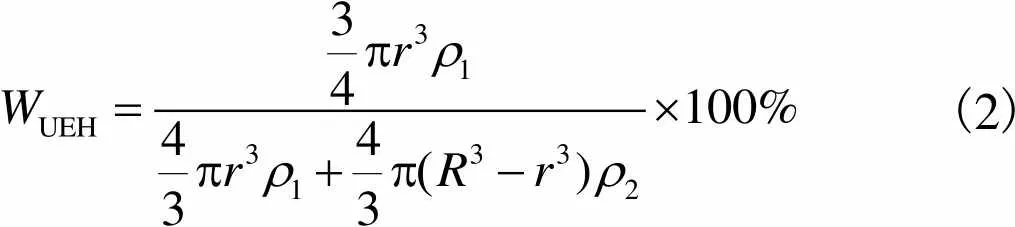
(2)
式中:为芯材的半径;1为芯材材料的密度;为水下环氧固化剂微胶囊的半径;2为壳层材料的密度.
1.6.4 复合涂层的静态水接触角测定
用德国KRUSS生产的DSA100型号的光学接触角测量仪对复合涂层的静态水接触角(WCA)进行测量.室温下采用座滴法测定,即将待测样放置在样品台上,调节样品和摄像机焦距,然后将1,µL的去离子水滴在待测样表面,等待5,s后读数.取3个不同位置的水接触角的平均值为待测样品的最终测试 结果.
1.6.5 复合涂层的蛋白吸附性能测定
采用BCA蛋白试剂盒方法测定复合涂层表面的蛋白吸附.将待测E235铁片(1,cm×1,cm)的不剖光面用锡纸屏蔽.将屏蔽后的铁片放入PBS缓冲溶液(pH=7.4)中浸泡1,h,使其溶胀平衡.然后放置到2,mg/mL BSA的PBS缓冲液(pH=7.4)中,在25,℃的恒温水浴中孵化2,h.去除屏蔽铁片的锡纸并用PBS缓冲液(pH=7.4)轻轻清洗3遍,将每个小待测样放入到装有2,mL PBS缓冲溶液(pH=7.4)的10,mL离心管内,在室温下超声20,min来充分脱附待测样表面上的牛血清白蛋白.按照BCA试剂盒的说明书,取等体积的清洗液和BCA试剂盒工作液充分混合后,用紫外可见分光光度计测定该液体在562,nm波长处的吸光度,利用BSA标准曲线即可确定待测蛋白液的浓度,最终结果取3个平行样的平均值[15].蛋白吸附量(PA)的计算式为

(3)
式中:为测出的蛋白质质量浓度,μg/mL;是蛋白清洗液PBS溶液的体积,mL;表面为待测样铁片单个面的表面积,cm2.
1.6.6 复合涂层的自修复性能测定
本实验中采用机械刀划痕法来模拟复合涂层产生的微裂纹,经机械刀破坏后的涂层置于空气中10,min后并浸入模拟海水中48,h,通过观察涂层表面是否产生锈蚀来表征复合涂层的自修复性能.
2 结果与讨论
2.1 双微胶囊的结构表征
从图2(a)和2(b)可以看出2种微胶囊呈球形结构,且球形表面结构致密.环氧树脂微胶囊ER-MCs表面粗糙,说明脲醛预聚物从水相逐渐交联沉积形成了微胶囊壳层.聚甲基丙烯酸甲酯包裹水下环氧固化剂形成的微胶囊UEH-MCs表面呈凹型蜂窝状结构,粒径分布较宽.2种微胶囊粗糙凹凸表面结构有利于牢固地嵌入环氧树脂基体中.
将干燥的微胶囊粉末用研钵研碎并用丙酮除去内容物,将所得壳层放置在真空干燥箱中48,h,除去丙酮后用扫描电镜观察其断面.从图2(c)和图2(d)可以看出,微胶囊破裂后呈现核-壳结构.通过计算5组不同微胶囊的壁厚并计算平均值,得出ER-MCs和UEH-MCs的囊壁厚分别为5.5,μm和2.5,μm.通过式(1)和式(2)计算得出ER-MCs和UEH-MCs的芯材含量分别是92%,和78%,.
将所制备的环氧树脂微胶囊研碎经丙酮洗涤后分离壳层与芯材物质,然后将固体粉末状的微胶囊及壳层聚脲醛通过溴化钾压片法测试其红外光谱,而液体环氧树脂可以通过溴化钾片表面挥发成膜法测试其红外光谱.图3(a)中的915,cm-1吸收峰为环氧基团的非对称振动吸收峰,而波数为830,cm-1的吸收峰为环氧基团的对称振动峰,证明ER-MCs微胶囊含有环氧树脂.图3(b)上的UEH-MCs红外谱图出现PMMA和水下环氧固化剂(UEH)的特征峰.结合图2破裂微胶囊的扫描电镜图,可以证明环氧树脂微胶囊及水下环氧固化剂微胶囊的成功制备.

图2 双微胶囊及破裂微胶囊的扫描电镜图
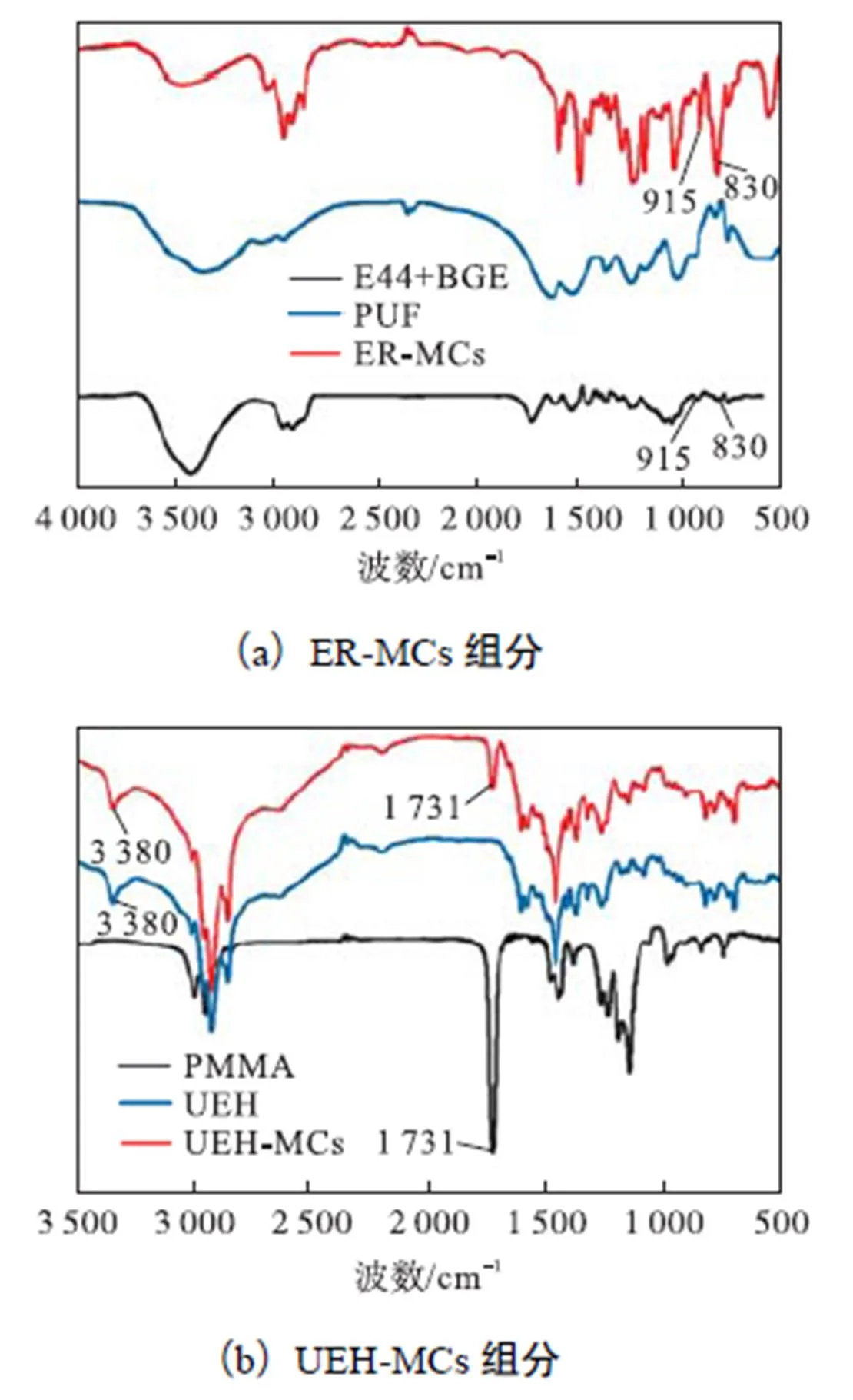
图3 双微胶囊组分的红外光谱
2.2 氟化聚合物的结构表征
为了同时实现聚合物的防污性能及聚合物与基体的黏结,这里选用具有低表面能的烯类含氟单体HFBM和含有环氧基团的烯类单体GMA,通过简单的自由基聚合制备氟化聚合物PFG.通过PFG链上GMA单元的环氧基与环氧树脂涂层中的氨基固化剂发生开环反应,把PFG接枝到涂层表面.
从图4(a)可以看出,3,000~3,040,cm-1范围内为聚合物中甲基及亚甲基的伸缩振动峰,1,750,cm-1处为聚合物中酯基C=O的伸缩振动峰,1,180,cm-1处为聚合物中—CF3基团的伸缩振动峰,905,cm-1和840,cm-1处为聚合物中环氧基团的特征吸收峰.图4(b)为不同组分的PFG的核磁谱图,化学位移为1.0~1.5处的多重峰为与氟化聚合物PFG主链相连接的氢原子(h)及微量的氢原子(i)的吸收峰,1.82处的单峰为氟化聚合物PFG主链上亚甲基氢原子(g)的吸收峰,2.55、2.72处的峰为氟化聚合物PFG中环氧基团亚甲基(e,f)的吸收峰.3.32处的单峰为氟化聚合物PFG中环氧基团次甲基(d)的吸收峰.如图中标记,PFG中各位置氢核在谱图中均有所属,再结合红外光谱结果,表明本实验制备方法已经成功合成了氟化聚合物.
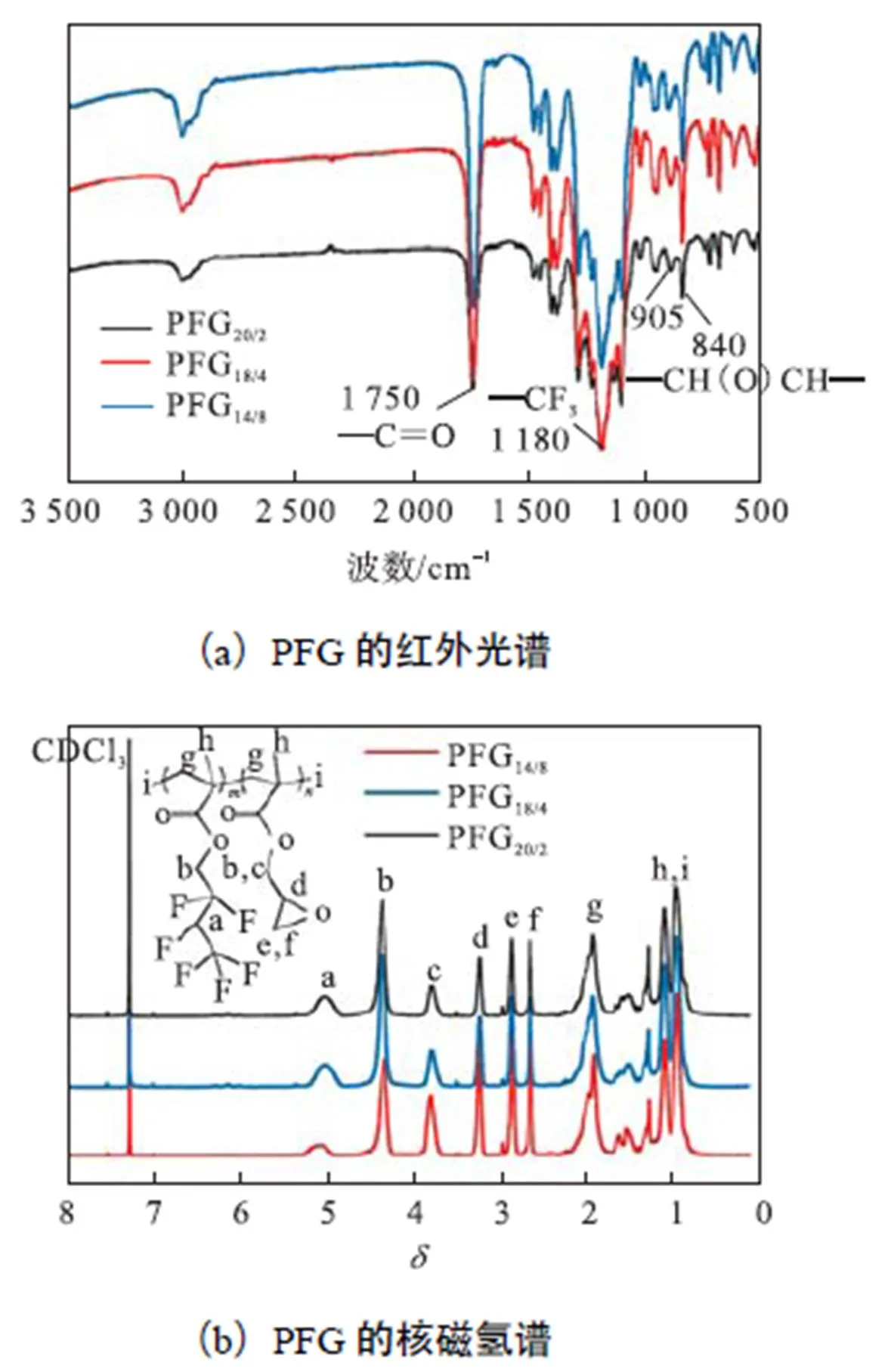
图4 不同摩尔比PFG的红外光谱和核磁氢谱
2.3 涂层的表面形貌
从PFG在Dual-MCs/ER涂层表面接枝前后的表面形貌可以观察出PFG在涂层表面的接枝效果,如图5所示.Dual-MCs/ER表面(见图5(a))呈现出类似蜂窝状凹陷结构,接枝PFG后涂层表面则呈现凸起的粗糙结构,说明PFG接枝到涂层表面.相比PFG20/2和PFG14/8,PFG18/4在Dual-MCs/ER涂层上的接枝效果较好,表面具有更为细密的200,nm左右的凸起结构(见图5(c)).研究表明,涂层表面粗糙的纳微拓扑结构有利于降低生物黏附[16].从理论上分析,PFG链上GMA单元比例越大,可与环氧树脂涂层中氨基固化剂反应的环氧基团就越多,有利于PFG在涂层表面的接枝;但GMA单元比例的增大,使分子链上引入的含氟单元下降,不利于表面的疏水改性,也会影响表面接入的聚合物量.因此PFG18/4可能具有较合适的结构单元比例,使涂层上接入较多的PFG,形成较为致密的表面修饰层.

图5 环氧树脂基涂层及氟化聚合物复合涂层的扫描电镜图
Fig.5 SEM images of the surfaces of Dual-MCs/ER coat-ing and PFG/Dual-MCs/ER coatings
2.4 涂层的接触角测定
接触角是表征材料表面润湿性能的重要参数之一,也是预估表面抗黏附性能的重要参数,超疏水和超亲水表面都表现出较好的抗生物黏附性能.从图6(a)可知,Dual-MCs/ER涂层表面具有一定的亲水性,接触角值为75°.在Dual-MCs/ER涂层表面接入不同组分的氟化聚合物后,水静态接触角都有较大程度的提高,这是由于表面疏水性氟原子的引入. PFG20/2/Dual-MCs/ER、PFG18/4/Dual-MCs/ER和PFG14/8/Dual-MCs/ER复合涂层的水静态接触角分别为105°、115°和100°.PFG18/4/Dual-MCs/ER复合涂层较大的接触角,进一步证明PFG18/4在涂层表面接枝引入了更多的氟化聚合物.

图6 环氧树脂基涂层及氟化聚合物复合涂层的接触角
Fig.6 Contact angles of the surfaces of Dual-MCs/ER coating and PFG/Dual-MCs/ER coatings
2.5 涂层的抗蛋白吸附性能
研究表明,海洋生物污损始于多糖和蛋白质在表面的黏附,所以通过蛋白在材料表面的吸附可初步评价涂层的防污性能.本实验中采用牛血清白蛋白(BSA)进行蛋白吸附性能测试,结果如图7所示.从图7可以看出,未接入氟化聚合物的环氧基涂层表面的蛋白吸附较多,吸附量为57.60,μg/cm2.而接入氟化聚合物后,蛋白吸附量明显降低,这是由于涂层表面引入氟化聚合物后,表面具有很低的表面能,从而抑制蛋白的吸附.PFG18/4/Dual-MCs/ER复合涂层表面的蛋白吸附量最低(13.05,μg/cm2),这与表面接触角的测定结果相符合,与PFG18/4/Dual-MCs/ER复合涂层表面引入了较多的PFG以及具有的纳微米粗糙结构有关.
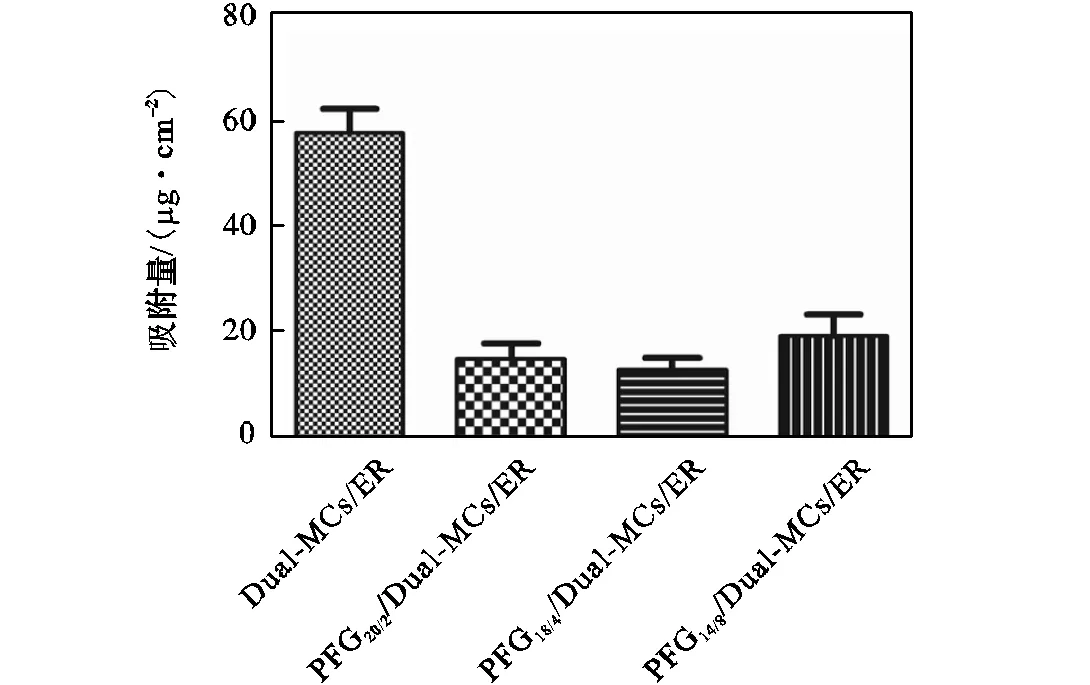
图7 环氧树脂基涂层及氟化聚合物复合涂层的BSA蛋白吸附量
2.6 涂层的自修复性能
为了验证复合涂层的自修复性能,在ER、ER-MCs/ER、UEH-MCs/ER和Dual-MCs/ER形成的涂层表面分别接入氟化聚合物PFG18/4.从图8可以看出,不含及含有一种微胶囊的3组对照组复合涂层PFG18/4/ER、PFG18/4/ER-MCs/ER和PFG18/4/UEH-MCs/ER裂纹处出现了明显的锈蚀,说明对照组复合涂层不具有自修复效果.而含有2种微胶囊形成的复合涂层(PFG18/4/Dual-MCs/ER)在材料产生裂纹后并放置在模拟海水中,复合涂层裂纹处没有锈蚀出现,说明复合涂层具有较好的自修复效果从而抑制海水对铁片的腐蚀.

图8 不同组分的涂层刮痕后48,h自修复实验结果
3 结 语
本文成功制备了分别包裹环氧树脂和水下环氧固化剂的微胶囊,以及环氧基团修饰的氟化聚合物,采用两步涂层法获得了性能优良的氟化聚合物/微胶囊环氧树脂基复合涂层PFG18/4/ER-MCs/ER. PFG18/4/ ER-MCs/ER复合涂层表面具有粗糙的纳米级凸起结构,引入的含氟聚合物具有低的表面能,增加涂层的疏水性,能降低BSA蛋白的表面吸附.此外,划痕法测试表明PFG18/4/ER-MCs/ER复合涂层还具有较好的水下自修复性能.这种具有自修复和抗蛋白黏附双重功能的涂层材料为海洋设施防护提供了新技术,在海洋工业领域具有广泛的应用前,.
[1] Yang W,Lin P,Cheng D,et al. Contribution of charges in polyvinyl alcohol networks to marine antifouling[J]. ACS Applied Material Interfaces,2017,9(21):18295-18304.
[2] Selim M S,Shenashen M A,El-Safty S A,et al. Recent progress in marine foul-release polymeric nanocomposite coatings[J]. Progress in Materials Science,2017,87:1-32.
[3] Kim S,Gim T,Jeong Y,et al. Facile construction of robust multilayered PEG films on polydopamine-coated solid substrates for marine antifouling applications[J]. ACS Appl Mater Interfaces,2017,10(9):7626-7631.
[4] Mieszkin S,Callow M E,Callow J A. Interactions between microbial biofilms and marine fouling algae:A mini review[J]. Biofouling,2013,29(9):1097-1113.
[5] Lejars M,Margaillan A,Bressy C. Fouling release coatings:A nontoxic alternative to biocidal antifouling coatings[J]. Chemical Reviews,2012,112(8):4347-4390.
[6] Herold D A,Keil K,Bruns D E. Oxidation of polyethylene glycols by alcohol dehydrogenase[J]. Biochemical Pharmacology,1989,38(1):73-76.
[7] Schmidt D L,Brady R F,Lam K,et al. Contact angle hysteresis,adhesion,and marine biofouling[J]. Langmuir the ACS Journal of Surfaces & Colloids,2004,20(7):2830-2836.
[8] Kuroki H,Tokarev I,Nykypanchuk D,et al. Stimuli-responsive materials with self-healing antifouling Surface via 3D polymer grafting[J]. Advanced Functional Materials,2013,23(36):4593-4600.
[9] Andersson H M,Keller M W,Moore J S,et al. Self-healing polymers and composites[J]. Springer Netherlands,2007,100(2):19-44.
[10] White S R,Sottos N R,Geubelle P H,et al. Autonomic healing of polymer composites[J]. Nature,2001,409(6822):794.
[11] Kamphaus J M,Rule J D,Moore J S,et al. A new self-healing epoxy with tungsten(VI)chloride catalyst [J]. Journal of the Royal Society Interface,2008,5(18):95-103.
[12] Wu G,An J,Tang X Z,et al. A versatile approach towards multifunctional robust microcapsules with tunable,restorable,and solvent-proof superhydrophobic-ity for self-healing and self-cleaning coatings[J]. Advanced Functional Materials,2014,24(43):6751-6761.
[13] Jin H,Mangun C L,Griffin A S,et al. Microcapsules:Thermally stable autonomic healing in epoxy using a dual-microcapsule system[J]. Advanced Materials,2014,26(2):282-287.
[14] Wang X,Liu D,Li W,et al. Microencapsulation of cholesteric liquid crystal by combined method of solvent evaporation and photopolymerization[J]. Molecular Crystals & Liquid Crystals,2013,571(1):57-66.
[15] Zhang L,Tang M,Zhang J,et al. One simple and stable coating of mixed-charge copolymers on poly(vinyl chloride)films to improve antifouling efficiency[J]. Journal of Applied Polymer Science,2017,134(12):1-10.
[16] Zhang Y,Qi Y H,Zhang Z P,et al. Synthesis of fluorinated acrylate polymer and preparation and properties of antifouling coating[J]. Journal of Coatings Technology & Research,2015,12(1):215-223.
(责任编辑:田 军)
Self-Healing and Antifouling Coating Composed of Fluorinated Polymer and Dual Microcapsules
Dong Anjie1, 2,Zhang Pengsheng1,Ye Zhanpeng1,Deng Liandong1,Zhang Jianhua1
(1.School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2.Collaborative Innovation Center of Chemical Science and Engineering(Tianjin),Tianjin 300072,China)
A dual-function coating with self-healing and antibiofouling properties was prepared by combining two kinds of microcapsules in epoxy coating and surface grafting with fluorinated polymer to resolve the problems of microcracking and marine biofouling of underwater coating materials. A microcapsule,named ER-MCs,with a poly(urea-formaldehyde)shell,entrapped in a mixture of epoxy resin(E44)and n-butyl glycidyl etherwas prepared using in-situ emulsion polymerization.Another microcapsule,named UEH-MCs,with a polymethyl methacrylateshell,entrapped in an underwater epoxy hardener(UEH)was prepared using a solvent evaporation technique.A fluorinated polymer(PFG)was synthesized by conventional free radical polymerization using hexafluorobutyl methacrylateand glycidyl methacrylateas monomers.The two microcapsules were entrapped in the epoxy resin to form a self-healing Dual-MCs/ER coating and whereas PFG/Dual-MCs/ER coating was obtained by casting PFG solution on the incomplete cured surface of the Dual-MCs/ER.The structures of microcapsules and PFG were characterized and self-healing and anti-protein-fouling properties were detected.The results showed that the PFG/Dual-MCs/ER composite coating featured a desirable self-healing capability whereas the grafting of PFG on the surface of Dual-MCs/ER coating significantly reducd the adsorption of bovine serum albumin on the coating surface. Therefore,given its easy fabrication,the PFG/Dual-MCs/ER composite coating,which possesses self-healing and anti-protein-fouling properties,features a promising application in the field of marine facility protection.
microcapsule;self-healing;fluorinated polymer;antifouling coating
10.11784/tdxbz201803093
TQ638
A
0493-2137(2019)02-0122-07
2018-03-26;
2018-05-07.
董岸杰(1964— ),女,博士,教授.
董岸杰,ajdong@tju.edu.cn.
国家基础研究资助项目(2014CB643305);洛阳船舶材料研究所海洋腐蚀与防护国家重点实验室科研基金项目(KF160401).
the National Basic Research Program of China(No. 2014CB643305),the Research Fund of the State Key Laboratory for Marine Corrosion and Protection of the Luoyang Ship Material Research Institute(No. KF160401).

