Ti3Al合金的电化学腐蚀研究及涂层防护
席艳君, 姜海芹, 刘 英
(中原工学院 a.材料与化工学院; b.学报编辑部, 河南 郑州 450007)
在燃烧动力系统中,燃料因含有硫、碳、钾、钠等杂质,在燃烧时会产生SO2、H2S、CO2等,与含O2和NaCl的大气作用形成硫酸盐沉积在材料的表面,这些表面沉积盐会加速材料的腐蚀[1-7]。有研究表明,盐显著加剧了1Cr11Ni2W2MoV钢、Ti60合金、GH2984高温合金、热障涂层等的腐蚀速度[8-13]。Ti3Al合金在高温下具有较高的强度和弹性模量、优良的抗蠕变和抗氧化性能,成为近年来重点开发应用的新型结构材料。作为新一代发动机叶片的潜力材料,Ti3Al在使用过程中不可避免地会在表面沉积硫酸盐和NaCl盐,这些盐同样也会对其产生腐蚀行为,但是有关Ti3Al合金在盐作用下的电化学腐蚀研究甚少。
当燃烧动力系统中产生SO2、H2S、CO2等气体时,若空气相对湿度较大,这些气体会以固体尘埃的形式溶于水膜中,成为离子导电液,这为金属发生电化学腐蚀提供了客观条件,在气候潮湿的热带海洋附近,这种电化学腐蚀现象更为严重。虽然在不同燃料气体介质中金属的腐蚀会有所不同,但有一点是共同的,即在金属与电解液接触的界面上发生阳极溶解破坏的同时,会伴随着溶液中某些氧化剂在金属表面上的还原。因此,本文研究了不同温度下不同盐体系中Ti3Al合金的电化学腐蚀行为,并对腐蚀机理进行了探讨。
近年来,材料的表面纳米化较受关注,通过其对表面的晶粒进行细化,产生大量晶界和位错,在腐蚀过程中会形成高密度的钝化成核点,从而形成较厚的钝化层并降低腐蚀速率。此外,磁控溅射技术是一种高速、低温、低损伤的表面处理技术,它通过在靶阴极表面引入磁场,利用磁场对带电粒子的约束来提高等离子体密度以增加溅射率。因此,本文利用磁控溅射的方法在Ti3Al合金表面开发细晶涂层,以期改善材料的耐电化学腐蚀性能。
1 实 验
将Ti3Al合金板切成15 mm×10 mm×2 mm规格的试样,进行打磨,抛光,超声波清洗。溅射涂层Ti-48Al-8Cr-2Ag,溅射前,用600号砂纸打磨基体样品,之后用丙酮超声波清洗15 min。由于采用旋转溅射,涂层截面是柱状晶结构,故涂层与基体不完全符合垂直特征,涂层厚度约15 μm。
配置25%Na2SO4+75%K2SO4、3.5% NaCl溶液作为腐蚀液。将试样浸入腐蚀溶液内并固定,将甘汞电极作为参比电极,铂电极作为辅助电极,试样作为工作电极,连接成三电极系统,利用Corrtest腐蚀电化学测试系统对系统的电化学性能进行测试,相对开路电位极化范围为±0.2 V,扫描速度为0.2 mV/s。
2 结果与讨论
2.1 Ti3Al表面施加涂层前后在硫酸盐体系中的电化学腐蚀性能
室温下硫酸盐体系中Ti3Al合金施加涂层前后的电化学性能测试结果分别如图1、图2所示。

图1 施加涂层前Ti3Al合金试样在室温下硫酸盐体系中的动电位极化曲线

图2 施加涂层后Ti3Al合金试样在室温下硫酸盐体系中的动电位极化曲线
由图1可知,材料在室温硫酸盐体系中的腐蚀速率较快,阳极极化曲线相对平缓,阳极Tafel曲线斜率较小,随着极化电位的正移,阳极发生快速溶解。
由图2可知,涂层试样在室温硫酸盐体系中呈现逐级钝化现象,即指材料表面因具有稳定的氧化膜而阻止材料和腐蚀介质的直接接触。实际上,钝化并不是完全的溶解停止,而是溶解和钝化达到平衡,或者溶解速度略高于钝化修复速度。在相应不同电极区间,钝化程度不相同。随着极化电位的正移,阳极电流基本维持在一个不变的数值,显示材料具有较好的耐电化学腐蚀性能。有研究表明,在相同条件下,晶粒尺寸降低后,腐蚀电流密度会变大,物体的抗腐蚀性能会降低[14-15]。本实验中的极化曲线出现了交替钝化现象,反映了钝化膜的破坏与修复过程。这可能是因为,涂层中含有少量Cr、Ag等元素,有助于钝化膜的生成,同时能够一定程度上抑制阴极反应,从而减缓腐蚀的进行。通过对图1和图2极化电阻拟合,可得合金的极化电阻Rp为2.607 9×105Ω,而涂层的Rp几乎是合金的5倍,为10.004×105Ω,合金的腐蚀电流密度I0为9.398 1×10-8(A/cm2),而涂层的I0大约是合金的1/4,为2.795 7×10-8(A/cm2),即极化电阻和腐蚀电流密度变化趋势吻合,说明涂层在室温硫酸盐体系中的抗电化学腐蚀性要优于原始Ti3Al合金。
图3和图4是Ti3Al合金施加涂层前后在70 ℃下硫酸盐体系中的电化学性能测试结果。

图3 施加涂层前Ti3Al合金试样在70 ℃下硫酸盐体系中的动电位极化曲线
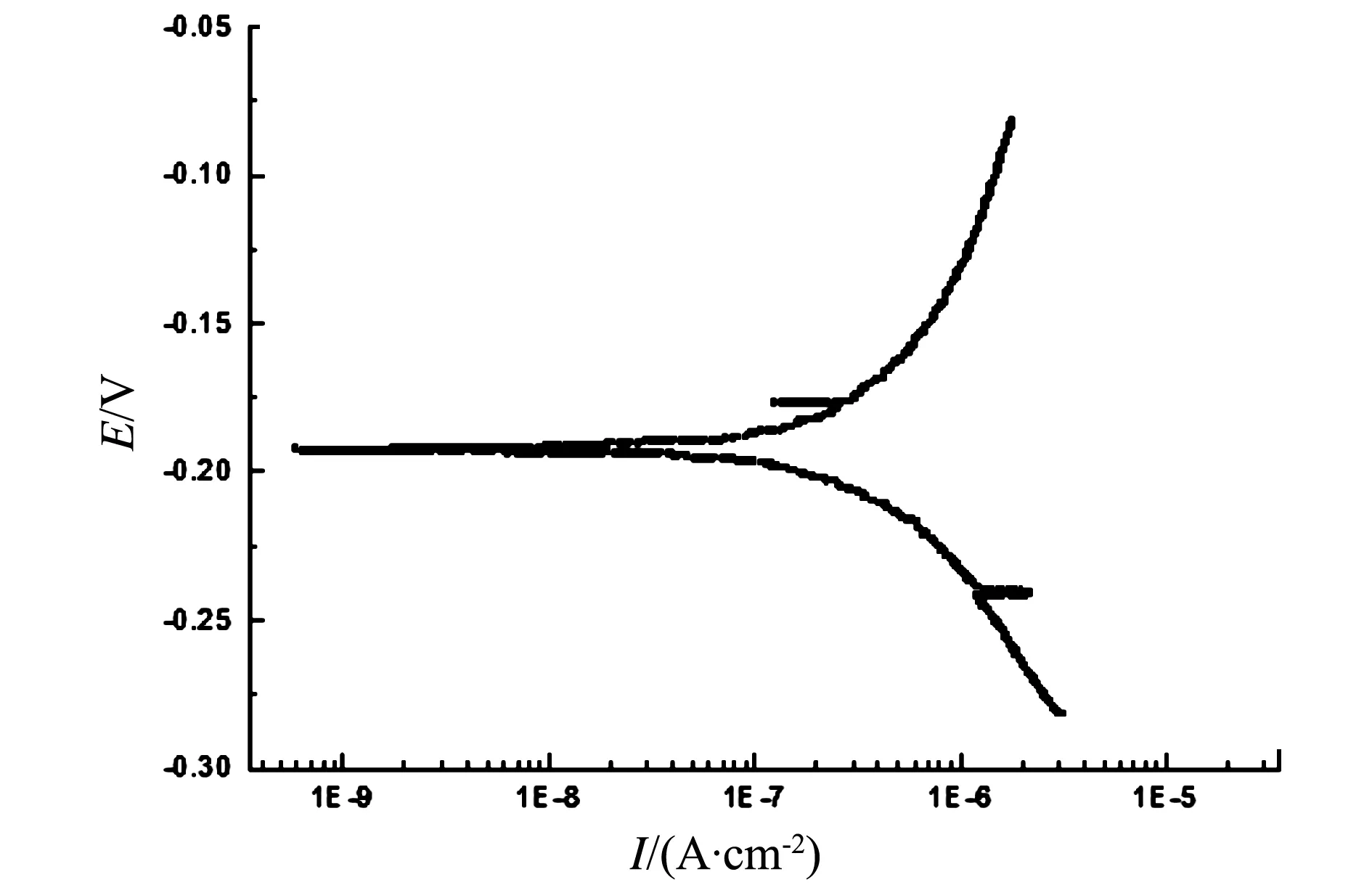
图4 施加涂层后Ti3Al合金试样在70 ℃下硫酸盐体系中的动电位极化曲线
对比图3、图4可以看出,在70 ℃的硫酸盐体系中,合金以及涂层的阳极极化曲线均呈现出了快速溶解的现象,二者均显示了较差的抗电化学腐蚀性能。这可能是因为,在高温下材料表面的活性点增多[16],阳极反应过程加速,同时,溶液中粒子扩散速度加快,致使阴极反应过程也加速,而阴极阳极呈现一对共轭反应,故动电位极化曲线呈现快速溶解现象[17]。对于电化学腐蚀行为,金属作为阳极首先溶解,随后溶解的金属离子沉积在金属表面,形成沉积层。沉积层的形成,阻碍金属正常的溶解,导致钝化膜的形成。而当温度升高后,沉积层便快速溶解,不能再对金属接下来的溶解起到抑制作用,因此,在室温下涂层呈现较好的钝化性能(如图1所示),而在高温下却没有任何钝化特征。通过对图3和图4进行拟合可知,合金的腐蚀电流密度I0为5.605 4×10-9(A/cm2),而涂层的I0约为1.585×10-7(A/cm2),即温度升高后,涂层因为晶粒细小、晶界多而活性增强,故溅射涂层后的Ti3Al合金在70 ℃硫酸盐体系中的抗电化学腐蚀性要劣于原始Ti3Al合金。
2.2 Ti3Al表面施加涂层前后在NaCl体系中的电化学腐蚀性能
图5和图6是Ti3Al合金表面施加涂层前后在室温NaCl体系中的电化学性能测试结果。

图5 施加涂层前Ti3Al合金试样在室温NaCl体系中的动电位曲线
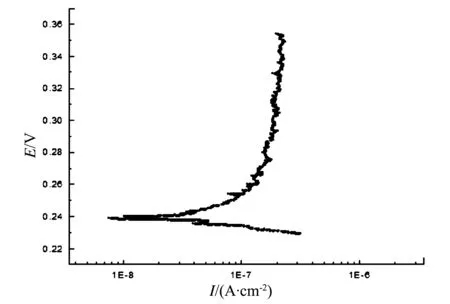
图6 施加涂层后Ti3Al合金试样在室温NaCl体系中的动电位曲线
对比图5、图6可看出,合金在NaCl溶液中能够快速溶解。这是因为,水在电极表面的吸附使体系的总的自由能下降,并且这是瞬间发生的自发过程[18],而无机阴离子也具有吸附能力,但是必须把水分子排斥掉才能吸附于电极表面。竞争吸附时,无机阴离子能够将水分子排挤掉的条件是,使体系总的自由能降低速度较水分子快,而在本研究中,Cl-就有这样的特性。Cl-脱除自己部分的水化外壳,排斥掉原来吸附于电极表面的水分子,与电极表面互相作用,形成共价键或配位键,从而在粒子和电极之间发生电子转移[18]。这样Cl-进入到材料中,使阳极金属离子杂乱移动并变得活跃。即,当溶液中有Cl-存在时,Cl-会替代金属表面上氧的吸附点,当氯的络合物离子取代了稳定的氧化物离子时,便降低了材料阳极溶解过程的活化能,从而使该处的平衡点破坏,成为腐蚀的活性点[18]。因此,合金在NaCl溶液中腐蚀较快。对于涂层而言,涂层表面的致密性在一定程度上阻碍了Cl-的进入,阻止了Cl-对稳定膜的破坏,因此,涂层显示了较好的钝化性能(图6)。
图7和图8是Ti3Al合金施加涂层前后在70 ℃NaCl体系中的电化学性能测试结果。
由图7可以看出,高温下,合金的腐蚀速度较快。这是因为温度升高,Cl-的吸附竞争力增强,材料表面大多区域被氯的络合物离子占据[18],合金的抗腐蚀性减弱。而对于涂层,随着电极电位的正移,材料的阳极腐蚀曲线呈现向右略倾现象(图8),说明涂层在高温NaCl体系中,呈现溶解现象。这是因为溅射涂层的晶粒较细小,晶界数量较多,Cl-在高温下相对较活跃[14,16],这些晶界在高温的NaCl溶液中受到破坏性阴极性离子Cl-的攻击,从而出现涂层溶解现象。通过对图7和图8进行拟合可知,合金的腐蚀电流密度I0为1.405 5×10-9(A/cm2),而涂层的I0大约为2.884 3×10-7(A/cm2),
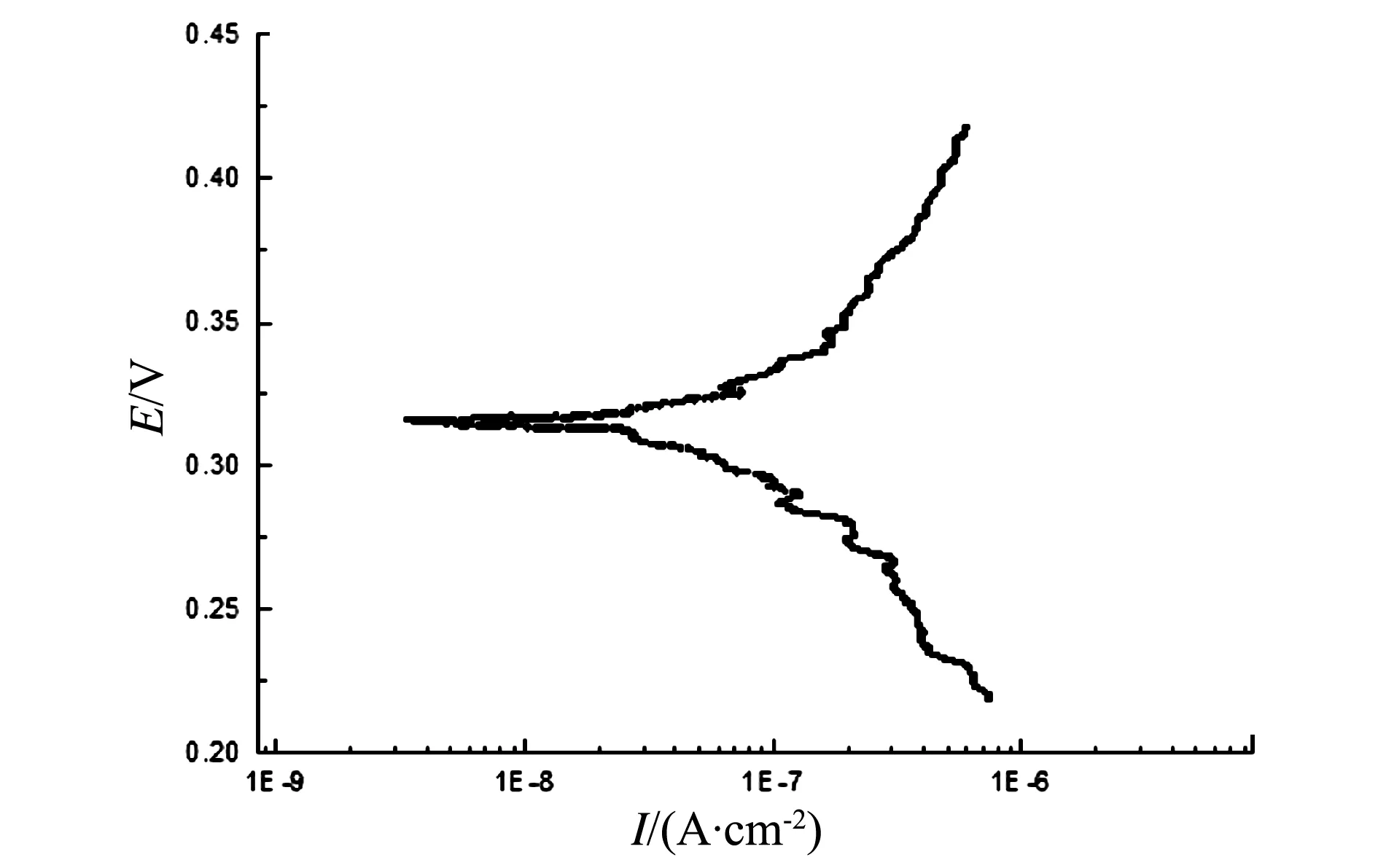
图7 施加涂层前Ti3Al合金试样在70 ℃NaCl体系中的动电位曲线
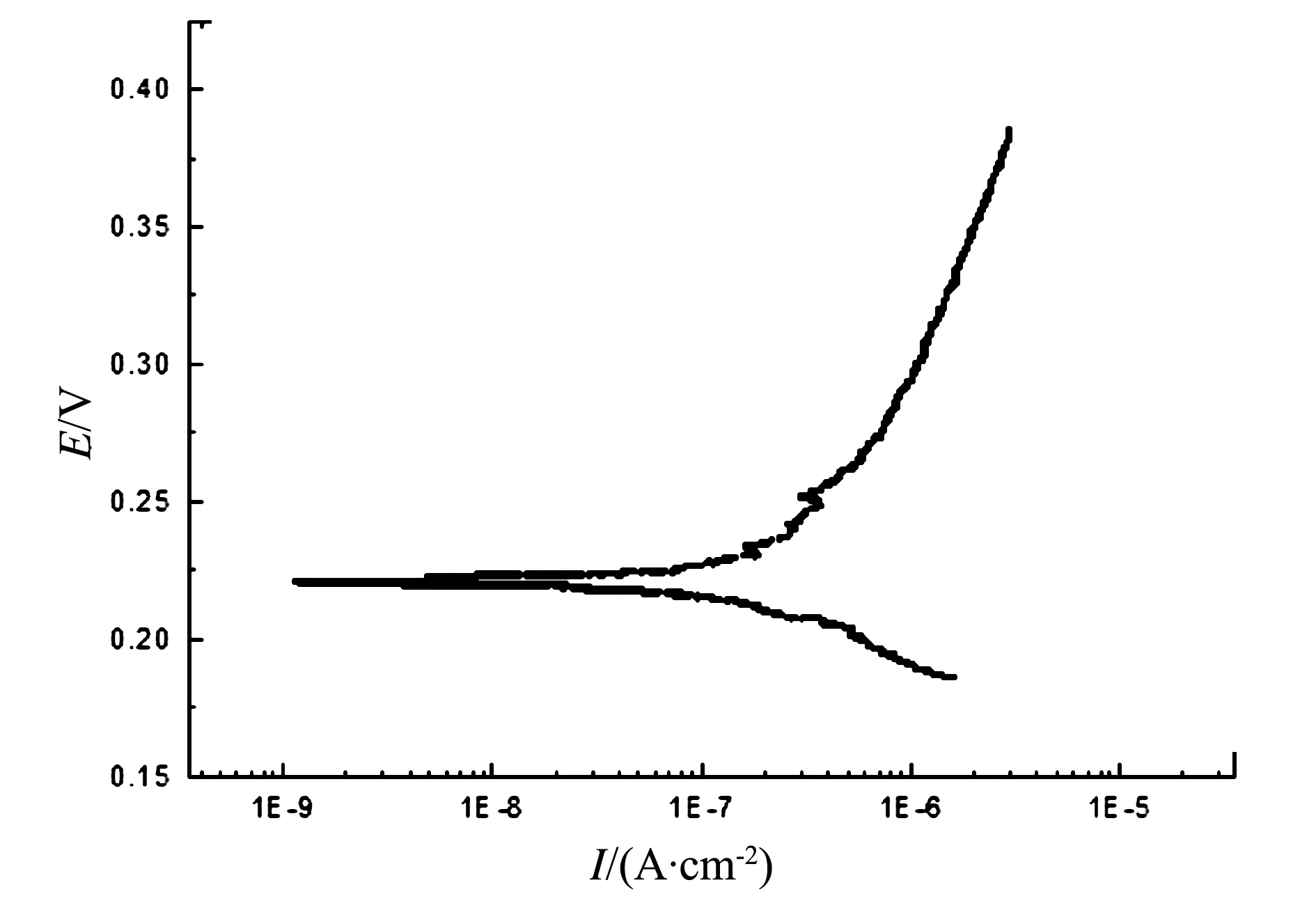
图8 施加涂层后Ti3Al合金试样在70 ℃NaCl体系中的动电位曲线
说明温度升高后,涂层因晶粒细小、晶界多而活性增强,这说明施加涂层后的Ti3Al在70 ℃NaCl体系中的抗电化学腐蚀性要劣于原始Ti3Al合金。
3 结 论
Ti3Al合金在室温硫酸盐和NaCl体系中均显示了快速腐蚀溶解现象。在高温下,Ti3Al合金表面的活性点增多,阳极过程加速,溶液中粒子扩散速度加快,因而也呈现快速腐蚀溶解状态。涂层中含有少量Cr、Ag等元素,有助于钝化膜的生成,同时能够一定程度上抑制阴极反应,从而在室温下减缓腐蚀速度,改善合金的抗电化学腐蚀性能。高温下,不论是在硫酸盐体系还是在NaCl体系中,涂层对基体的电化学腐蚀性能影响都不大。

