超声波辅助双水相萃取鲍鱼内脏的β-葡萄糖苷酶
(厦门医学院,福建厦门361021)
鲍鱼是一种海洋贝类,只有半面外壳,属单壳软体动物,体型扁而宽,以摄食海藻和浮游生物为生[1]。鲍鱼的天然产量很少,但随着技术的发展,鲍鱼人工繁殖已经成功实现。近年来,随着我国水产行业的不断发展,鲍鱼养殖技术的应用和完善,我国的鲍鱼产量也在不断增加,而在鲍鱼的加工过程中会产生大量的下脚料,如鲍鱼内脏、鲍鱼壳等,对于这些下脚料的处理以及高效应用问题也引起人们的关注。鲍鱼内脏占鲍鱼总质量的30%左右,其中含有大量的蛋白酶、纤维素酶、淀粉酶等[2],如何合理运用这些廉价而又丰富的天然海洋资源是十分值得研究的。
β-葡萄糖苷酶(β-glucosidase,CE3.2.1.21)又称β-D-葡萄糖苷水解酶,别名纤维二糖酶、龙胆二糖酶和苦杏仁苷酶。它属于纤维素酶类,是一种能催化水解芳基和烃基与糖基原子团之间的糖苷键生成葡萄糖的酶。β-葡萄糖苷酶对于纤维素的降解作用显著,对于工业生产有十分重要的作用[3]。
双水相萃取技术(aqueous two phase extraction,ATPE)作为近几年发展较为迅猛的新型液-液萃取技术,与传统分离技术相比具有高含水量(70%~90%)、分相时间短、条件温和、易于工艺放大和连续操作等优点,在快速的将大量杂志去除的同时还能较好的保护生物活性物质,使其不易变性失活[4-5]。目前双水相萃取技术已应用于蛋白质、生物酶、菌体、细胞以及氨基酸、抗生素等生物小分子物质的分离、纯化[6]。
目前已有研究运用常规的冷提取方法分离纯化出鲍鱼内脏中的β-葡萄糖苷酶[7-8],本研究则是在最佳冷提取条件下,加入超声波破碎辅助常规方法提取鲍鱼内脏中β-葡萄糖苷酶,并设计正交试验法找到最合适、最高效的超声辅助条件,在此基础上,加入双水相萃取技术,探究萃取效果最佳的双水相系统组成,以求达到更高的提取率和回收率,为相关酶的提取纯化、酶学性质的研究提供便利,同时也为鲍鱼内脏的开发利用提供一定的理论依据。
1 材料与方法
1.1 原料与试剂
皱纹盘鲍内脏:厦门大学海洋与地球学院提供,-20℃下冷冻储藏待用;对硝基苯基-β-D-葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG):北京索莱宝科技有限公司;对硝基苯酚、碳酸钠、磷酸氢二钠、柠檬酸、乙酸、乙酸钠、氢氧化钠(均为分析纯):国药集团化学试剂有限公司。聚乙二醇(polyethylene glycol,PEG)600、1 000、1 500、2 000、4 000、6 000:上海麦克林生化科技有限公司。
1.2 仪器与设备
高速组织捣碎机(A25乳化机)::上海欧河;Scientz-ⅡD超声波细胞破碎机:宁波新芝生物科技有限公司;3-18K高速冷冻离心机:德国sigma;AF100制冰机:意大利斯科茨曼;Epoch 2酶标仪:BioTek Instrum ents,Inc.。
1.3 超声波辅助提取的试验方法
1.3.1 鲍鱼内脏的预处理
取一定质量的鲍鱼内脏,以1∶4的质量比加入预冷的乙酸-乙酸钠缓冲液(0.1 mol/L,pH=4.5),在冰浴中用组织捣碎机匀浆后待用[5]。
1.3.2 超声辅助粗酶液的提取
将上述预处理液等量分装至小烧杯中,放入超声波破碎机中,采用冰浴冷却法,一次超声时间5 s~10 s,间隔时间5s~10 s,处理一定时间后取出,放置于冰浴中浸提一段时间,用高速冷冻离心机离心(10 000 r/min,4℃,15 min),取上清液。
1.3.3 酶活力的测定
酶活定义:一定条件下,1 mL酶液在1 min内水解p-NPG 产生 1 μmol对硝基苯酚(p-nitrophenol)定义为一个酶活力单位(U)。采用p-NPG比色法,在403 nm处的吸光值来测定β-葡萄糖苷酶的酶活力大小[9]。计算公式如下:
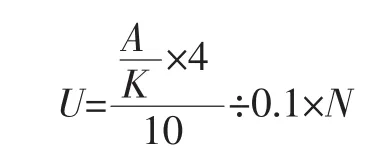
式中:U为β-葡萄糖苷酶酶活性,U/mL;K为曲线斜率;A为403 nm处的平均吸光度;为对硝基苯酚的量,μmol;4 为反应体系的总体积,mL;10 为反应时间,min;0.1为加入的酶量,mL;N为稀释倍数。
1.3.4 超声辅助鲍鱼内脏粗酶液提取工艺的单因素试验
以β-葡萄糖苷酶酶活力为指标,探究超声波辅助处理鲍鱼内脏对β-葡萄糖苷酶提取的影响,分别考察以下4个因素:超声的预处理液体积、超声波功率、超声时间、超声后浸提时间。
1.3.5 超声辅助鲍鱼内脏β-葡萄糖苷酶提取工艺的正交试验
在单因素试验的基础上,选取影响试验的3个主要因素:超声波功率、超声总时间、超声后浸提时间作为考察因素,在各因素选取3个最佳的水平条件,采用L9(34)正交试验表进行设计,做三因素三水平正交试验,以确定β-葡萄糖苷酶超声辅助提取的最佳工艺条件。正交表设计见表1。
1.4 双水相技术萃取粗酶液中β-葡萄糖苷酶
1.4.1 PEG/(NH4)2SO4双水相体系相图的制作
在室温下,将 6 种分子量的 PEG(600、1 000、1 500、2 000、4 000、6 000)分别配置成一定质量比的溶液待用。准确称取一定量某一分子量的PEG溶液,加入试管中置于天平上,然后逐滴加入一定质量分数的(NH4)2SO4溶液,充分混合,直至出现浑浊为止,静置或离心后能分离成相,记录加入的(NH4)2SO4溶液的质量,从而计算出PEG、(NH4)2SO4和水在体系中的质量分数。
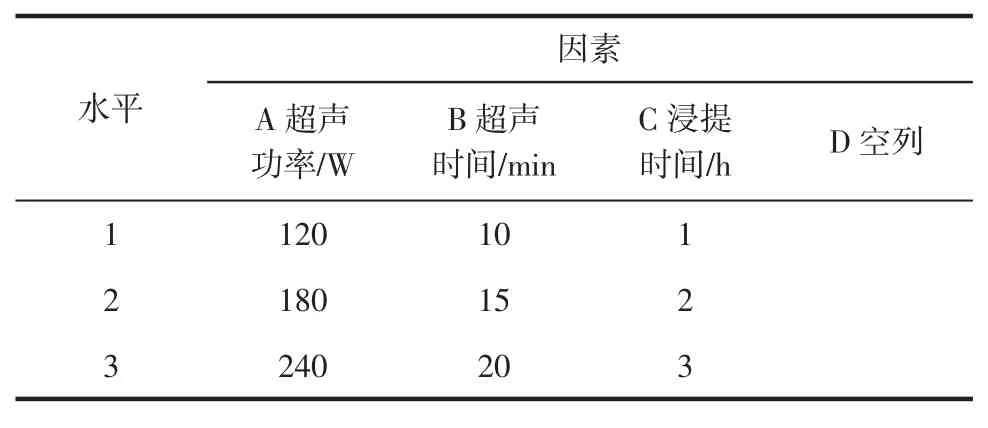
表1 超声辅助提取β-葡萄糖苷酶正交试验因素水平Table 1 Orthogonal test of the ultrasonic assisted β-glucosidase extraction factors and their levels
1.4.2 β-葡萄糖苷酶双水相萃取
体系总质量固定为10 g,按上述成相条件,准确称取一定量的PEG溶液和(NH4)2SO4溶液于干燥的试管中,加入1 mL粗酶液,混匀后3 000 r/min低温离心3 min,记录上下两相的体积比,分别测定上下两相的酶活。
1.4.3 双水相萃取法中各参数的计算[10]
相比R=下相体积/上相体积;分配系数K=下相酶活/上相酶活;萃取率Y/%=(R×K)/(1+R×K)×100
2 结果与讨论
2.1 对硝基苯酚标准曲线
对硝基苯酚标准曲线见图1。
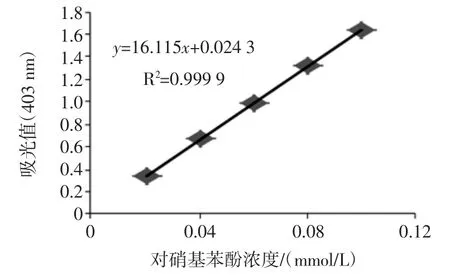
图1 对硝基苯酚标准曲线Fig.1 p-Nitrophenol standard curve
如图 1,回归方程为 y=16.115x+0.0243,R2=0.999 9,斜率K=16.115。
2.2 鲍鱼内脏β-葡萄糖苷酶超声辅助提取工艺的单因素试验
2.2.1 超声的预处理液体积对酶活的影响
在超声功率为240 W,超声时间为15 min,超声后冰浴浸提1 h的条件下,测定不同体积的预处理液进行超声波处理对其酶活力的影响,结果见图2。
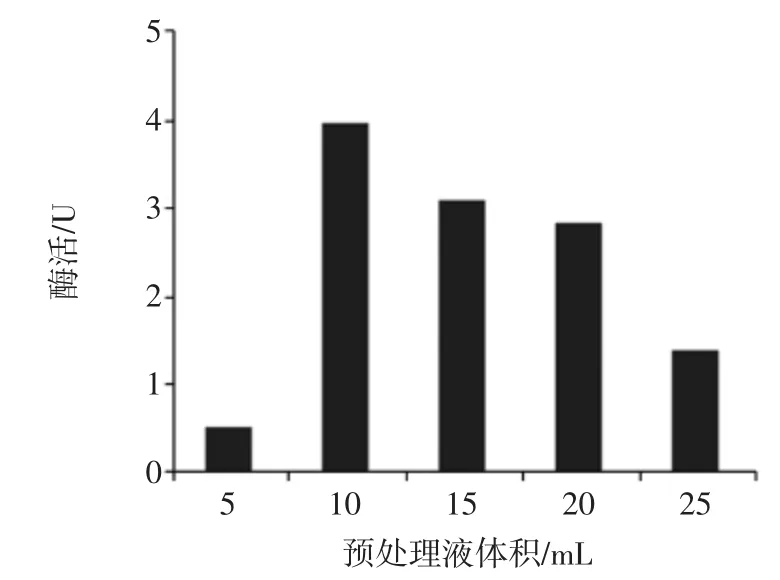
图2 超声的预处理液体积对酶活的影响Fig.2 The effect of ultrasonic pretreatment liquid volume on enzyme activity
由图2可知,根据预处理液体积的递增,酶活力呈现先增大后减少的趋势,当预处理液量过少时,超声发热过快导致酶活大量损失;而当预处理液量过大时,破碎率下降,导致目标酶浓度降低,总酶活降低。因此,选择适当的预处理液体积进行试验才能较客观明显的反映出不同的超声因素和条件下酶活的变化,因此选择10 mL的预处理液进行后续的相关试验较为合适。
2.2.2 不同超声波功率对酶活的影响
在预处理液体积为10 mL,超声时间为20 min,超声后冰浴浸提1 h的条件下,测定不同超声功率对粗酶液酶活力的影响,结果见图3。
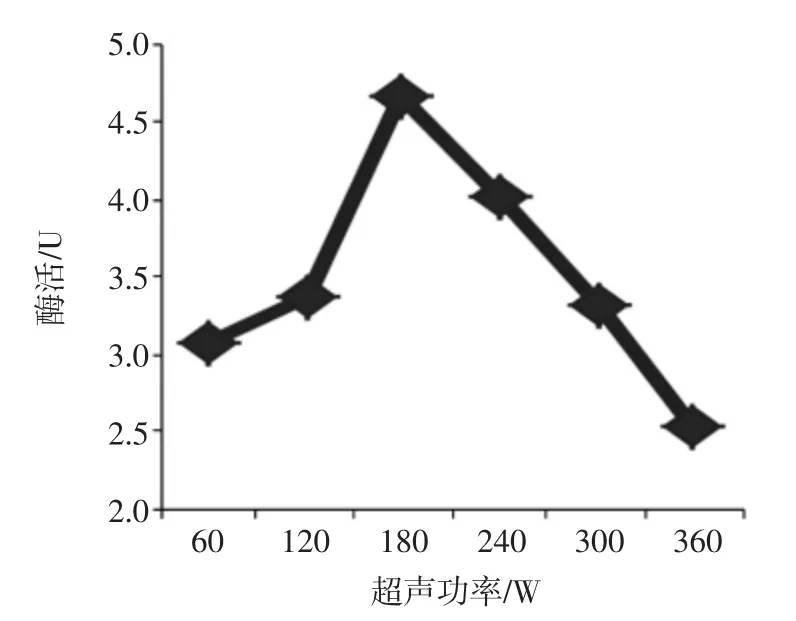
图3 超声波功率对酶活的影响Fig.3 The effect of ultrasonic power on enzyme activity
由图3可知,当超声功率小于180 W时,随着功率的增加,细胞破碎效果越好,目标酶的酶活力呈逐渐增大的趋势;当超声功率大于180 W后,酶活力则随着功率的增大呈逐渐下降的趋势。该结果产生可能是由于10 mL体积的预处理液在超声功率在180 W附近时,细胞破碎率较高,且能保持较好的酶活性,而随着功率的不断增加,破碎率增大的同时,破碎时产生的热量导致更多的酶变性失活,且变性速度大于破碎释放目标酶的速度。所以处理10 mL预处理液时,超声功率在180 W时是较适宜条件。
2.2.3 不同超声时间对酶活的影响
在预处理液体积为10 mL,超声功率为180 W,超声后冰浴浸提1 h的条件下,测定不同超声时间对粗酶液酶活力的影响结果见图4。
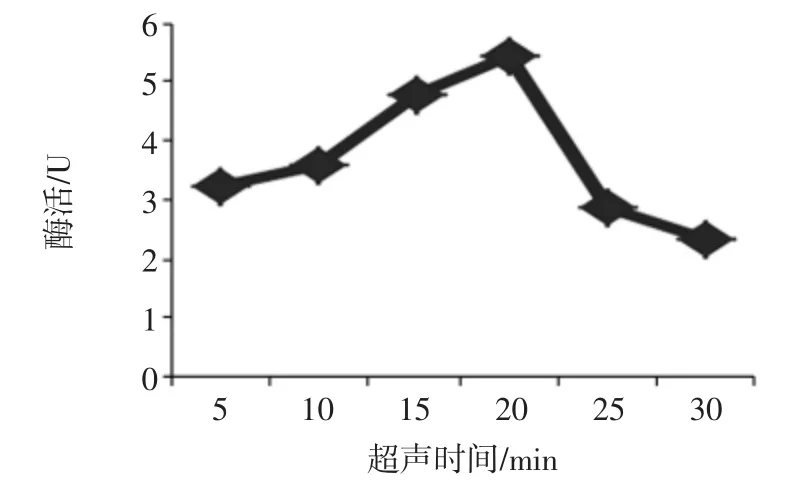
图4 超声时间对酶活的影响Fig.4 The effect of ultrasonic time on enzyme activity
由图4可知,当超声时间少于20 min时,酶活随着超声时间的增加而增大;当超过20 min后,酶活随着时间的增加而呈下降趋势。该结果产生的原因可能是超声时间过短时(少于20 min)细胞破碎率较低,目标酶释放量随着时间增加而增加;当超声时间超过20 min后,超声引起的发热导致目标酶开始大量变性失活导致酶活不断丧失。所以选择超声处理时间为20 min为较最适宜条件。
2.2.4 超声后的浸提时间对酶活的影响
在预处理液为10 mL,超声功率为180 W,超声处理时间为20 min的条件处理后,考察浸提时间的长短对粗酶液酶活的影响结果见图5。
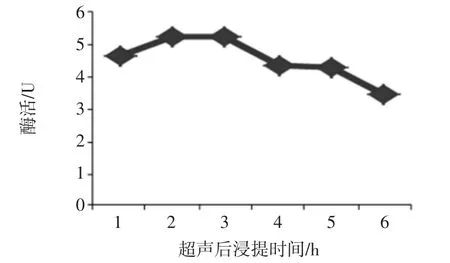
图5 超声后浸提时间对酶活的影响Fig.5 The effect of extraction time on enzyme activity
由图5可以看出,随着浸提时间的增加,目标酶活呈现先增大后减小的趋势。在浸提时间为3 h时,酶活力相对较高。因此超声处理后浸提时间为3 h为较适宜条件。
2.3 鲍鱼内脏β-葡萄糖苷酶超声辅助提取工艺的正交试验
试验结果如表2所示。方差分析见表3。
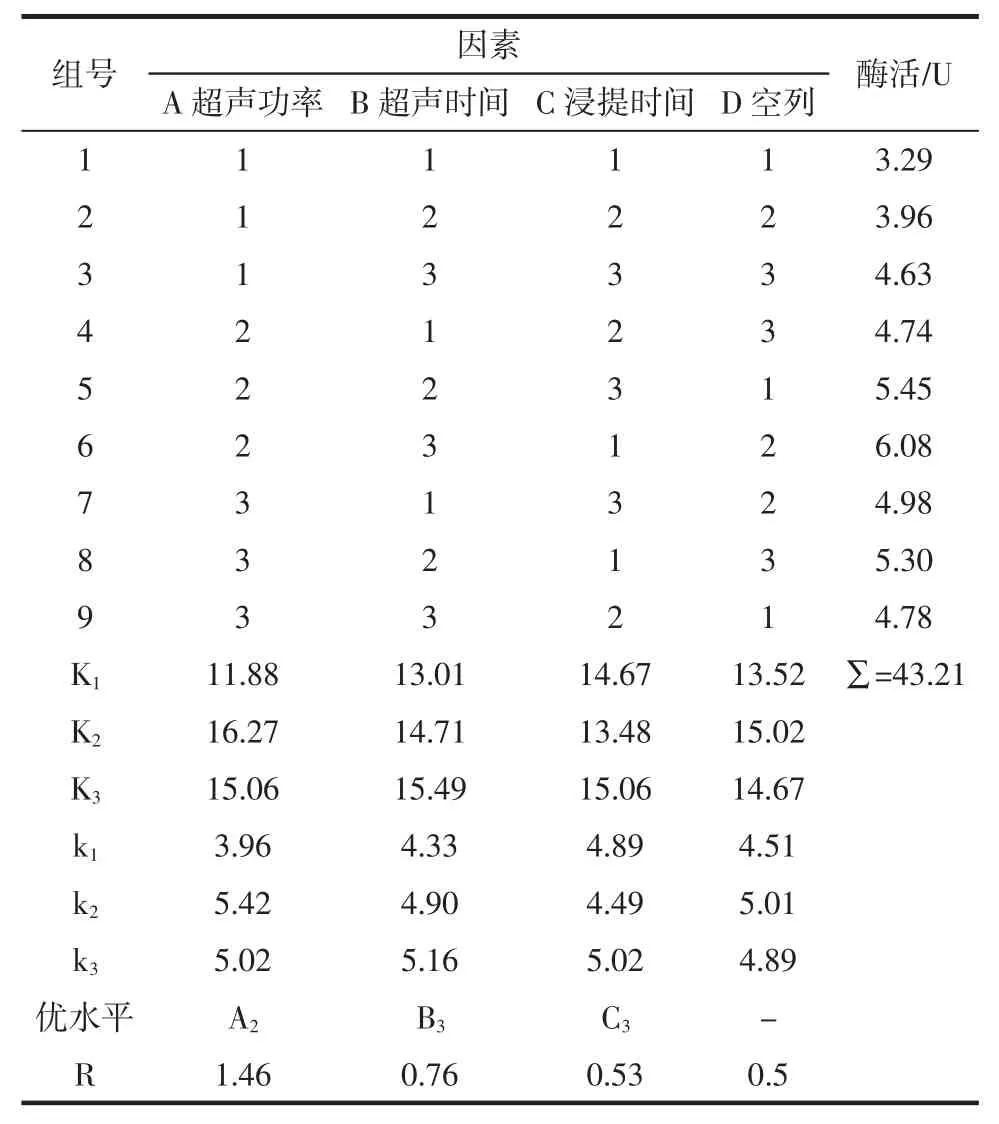
表2 超声辅助提取β-葡萄糖苷酶正交试验结果Table 2 The result on the orthogonal test of the ultrasonic assisted β-glucosidase extraction
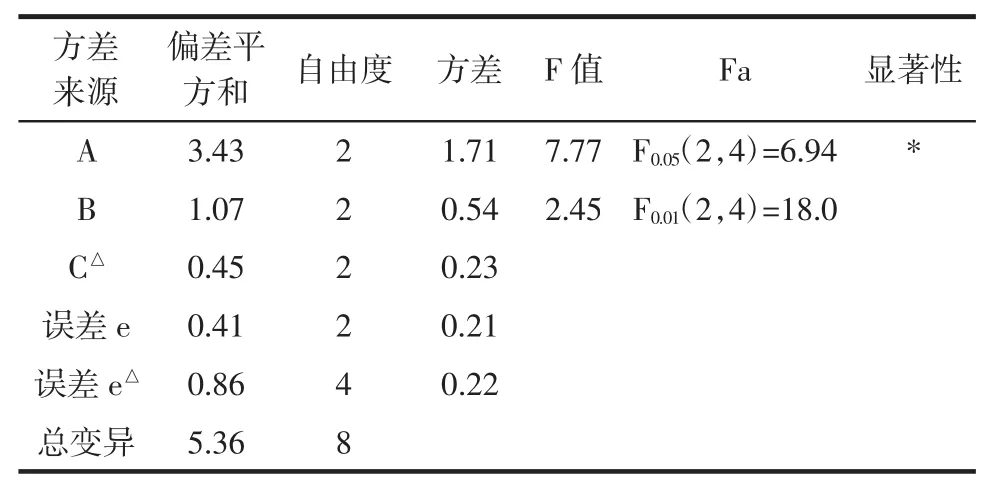
表3 正交试验方差分析表Table 3 Analysis of variance of orthogonal test
根据极差R值可见,RA>RB>RC,所以超声波辅助提取鲍鱼内脏β-葡萄糖苷酶的影响因素主次顺序为:超声频率>超声时间>超声后浸提时间。即超声频率影响最大,其次是超声的时间,超声后浸提时间则影响较小。
试验指标的影响规律和趋势,由图6所示。
由表2的极差分析结果可以看出,在超声辅助鲍鱼内脏β-葡萄糖苷酶的提取过程中,影响目标酶酶活的因素按影响大小排序依次为A>B>C,即超声功率>超声时间>超声后浸提时间。由表3的方差分析可以看出,其中,超声功率对目标酶的提取具有显著性影响,超声时间对其影响并不显著,而超声后浸提时间可视为误差所致,可不作为影响因素。
由表2及图6可以得出最佳的条件水平组合为A2B3C3,即当超声功率为180 W,超声时间为20 min,超声后浸提时间为3 h时为最佳工艺条件;但根据上述极差结果以及提取过程中各类成本的综合考虑,可将浸提时间缩短至1 h作为最佳条件。
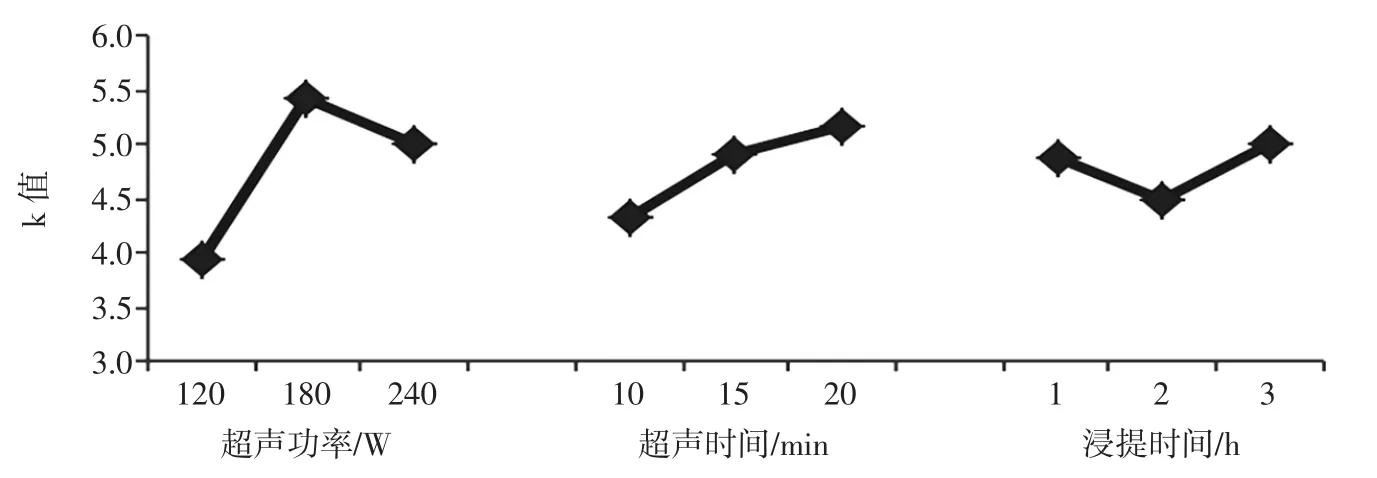
图6 因素与指标趋势图Fig.6 Factors and index trend chart
2.4 验证试验结果
由上述结果可知,正交试验结果与单因素试验结果一致,但根据方差分析及综合成本考虑,缩短浸提时间至1 h进行验证试验,即超声功率为180 W,超声时间为20 min,超声后浸提时间为h;与最佳工艺组合(超声功率为180 W,超声时间为20 min,超声后浸提时间为3 h)进行比较,结果如表4所示。
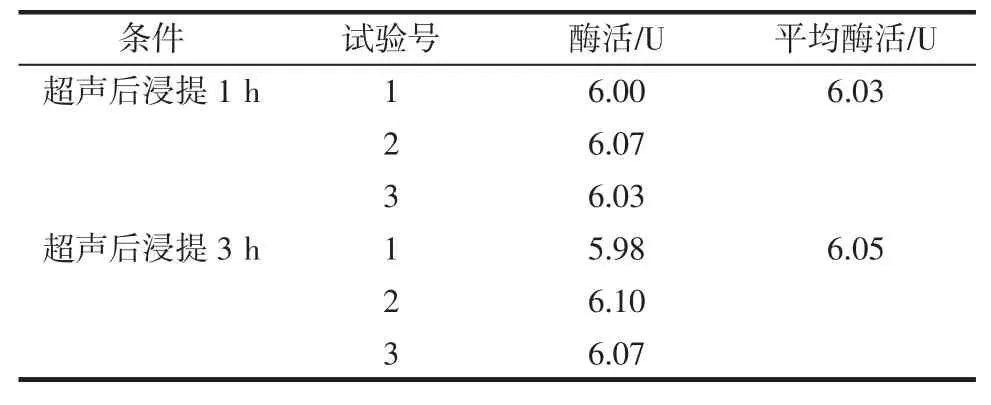
表4 最优提取工艺验证试验结果Table 4 The optimal extraction process validation test results
表4结果可见,超声后浸提1 h的平均酶活基本与浸提3 h的平均酶活没有显著区别,但超声后浸提1 h能大大缩短时间和材料成本,故可作为最佳条件。
2.5 双水相体系中各因素对粗酶液中β-葡萄糖苷酶的萃取效果的影响
2.5.1 双水相体系相图
图7是不同分子量的PEG与(NH4)2SO4的双水相相图,曲线上的点为临界点,曲线下方不分相,上方为两相区。PEG在上相富集,下相则为(NH4)2SO4。
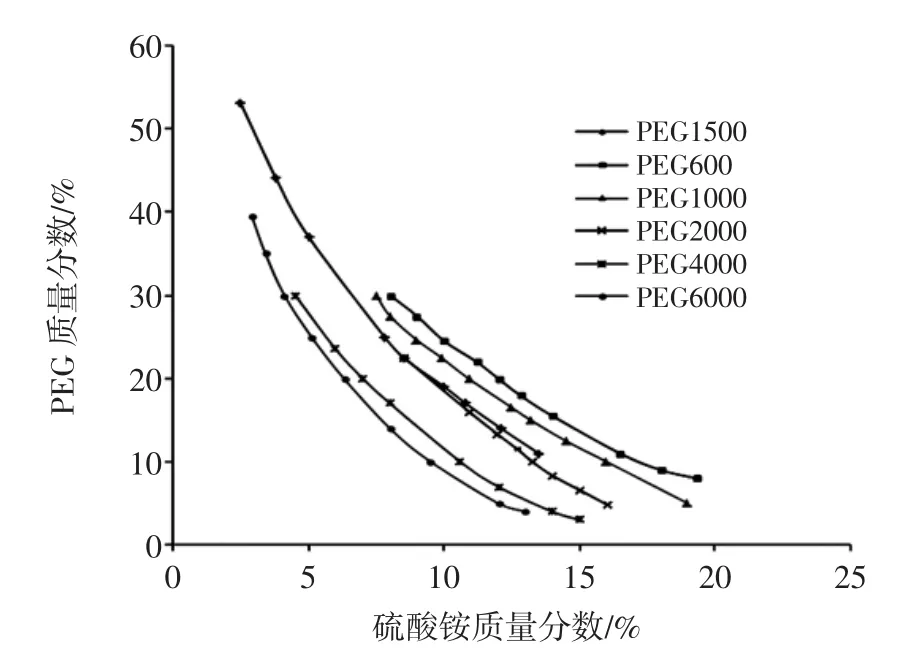
图7 PEG/(NH4)2SO4双水相体系相图Fig.7PEG/(NH4)2SO4aqueous two-phase system phase diagram
从图7中可以看出,当(NH4)2SO4质量一定时,PEG分子量越大越容易形成双水相体系;当PEG分子量一定时,(NH4)2SO4过低时难以成相,过高时则易饱和难以溶解,所以在选择PEG分子量、质量分数和(NH4)2SO4需考虑三者的相互关系[11]。
2.5.2 PEG分子量对萃取的影响
根据相图,固定(NH4)2SO4的质量分数为16%,选择不同分子量的 PEG(600、1 000、1 500、2 000、4 000、6 000),并将其质量分数也固定为16%,组成双水相体系,考察相关各项参数的变化情况,结果如表5所示。
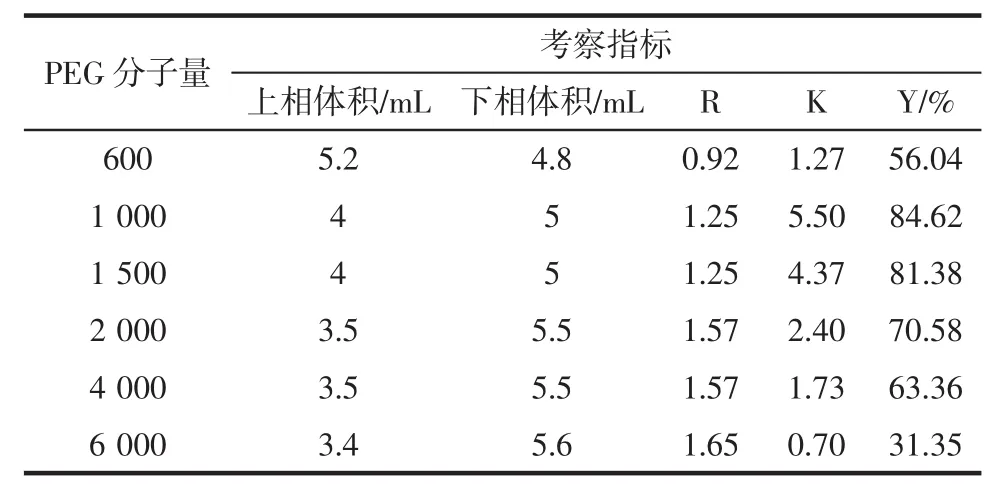
表5 PEG分子量对β-葡萄糖苷酶萃取的影响Table 5 The effect of the molecular weight of PEG on βglucosidase extraction
试验发现,β-葡萄糖苷酶的分配系数足够大,第一次萃取就能大量富集分配至下相(NH4)2SO4相,而杂蛋白和细胞碎片都停留在上相PEG相,有较好的分配效果。由表5可知,当PEG分子量较小或较大时,分配系数K和萃取率Y均较小;当PEG分子量为1 000时,分配系数K和萃取率Y均最大。这种现象出现的原因是随着PEG分子量增加,疏水性增大,成相时分配的水分就越少,上相体积减小,下相体积增大;此双水相体系中,当PEG分子量较小时,β-葡萄糖苷酶能较多的富集在下相,即(NH4)2SO4盐相,且能保持较高酶活力,但随着PEG分子量增大,β-葡萄糖苷酶会逐渐向上相富集,但由于上相杂蛋白、细胞碎片等杂质过多,加上PEG疏水性增大,最终可能导致酶活大量损失,且难以与其他杂质分离,所以分配系数和回收率逐渐减小;但当PEG分子量过小时(600),该体系萃取效果不佳,杂质与目标酶并未有明显分离,所以PEG分子量为1 000时,分配系数最大,下相对目标酶的萃取率最高。
2.5.3 PEG1000质量分数对萃取的影响
固定(NH4)2SO4的质量分数为16%,考察不同质量分数的PEG1000对β-葡萄糖苷酶萃取的影响,结果如表6所示。
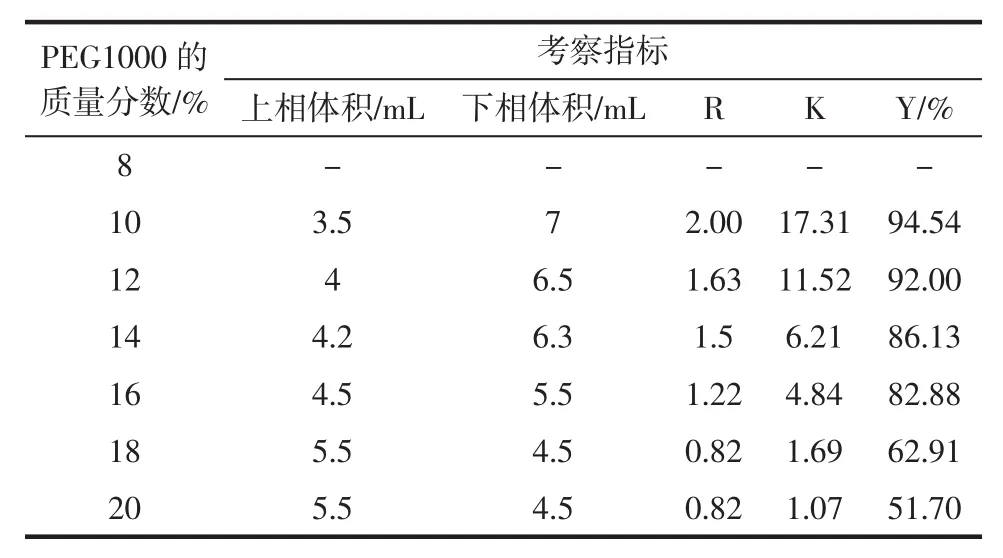
表6 PEG1000质量分数对β-葡萄糖苷酶萃取的影响Table 6 The effect of the mass fraction of PEG1000 on βglucosidase extraction
根据表6结果表明,体系中PEG1000的质量分数为10%时萃取效果最好。当PEG质量分数小于10%时体系不成相,随着PEG质量分数的增加,两相体积比逐渐减小,分配系数和萃取率也随之下降。所以选择PEG1000的质量分数为10%萃取效果最佳。
2.5.4 (NH4)2SO4质量分数对萃取的影响
根据上述结果,固定PEG1000的质量分数为10%,考察不同质量分数的(NH4)2SO4对β-葡萄糖苷酶萃取效果的影响。结果如表7所示。
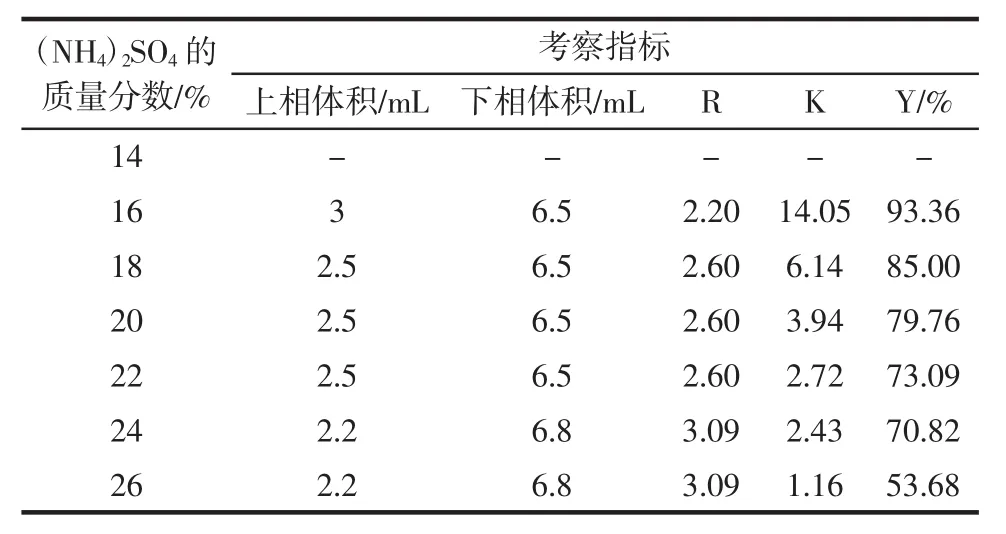
表7 (NH4)2SO4质量分数对β-葡萄糖苷酶萃取的影响Table 7 The effect of the mass fraction of(NH4)2SO4on βglucosidase extraction
根据表7的结果可以看出,当(NH4)2SO4的质量分数小于16%时,体系不成相;随着硫酸铵质量分数逐渐增大,下相体积增大,分配系数逐渐减小,萃取率也呈现明显下降趋势,这是因为硫酸铵属于强电解质,浓度过高时会中和蛋白质表面电荷,破坏表面的水化膜,不利于目标酶的提取。所以选择质量分数为16%的(NH4)2SO4最为合适。
2.5.5 双水相体系的pH值对萃取的影响
根据上述结果,确定双水相体系组成为PEG1000质量分数为10%,(NH4)2SO4质量分数为16%,考察体系的pH值对萃取效果的影响,由于(NH4)2SO4在碱性条件下易水解,从而破坏双水相的稳定性,所以pH值选择的考察范围为3~7之间。结果如图7所示。
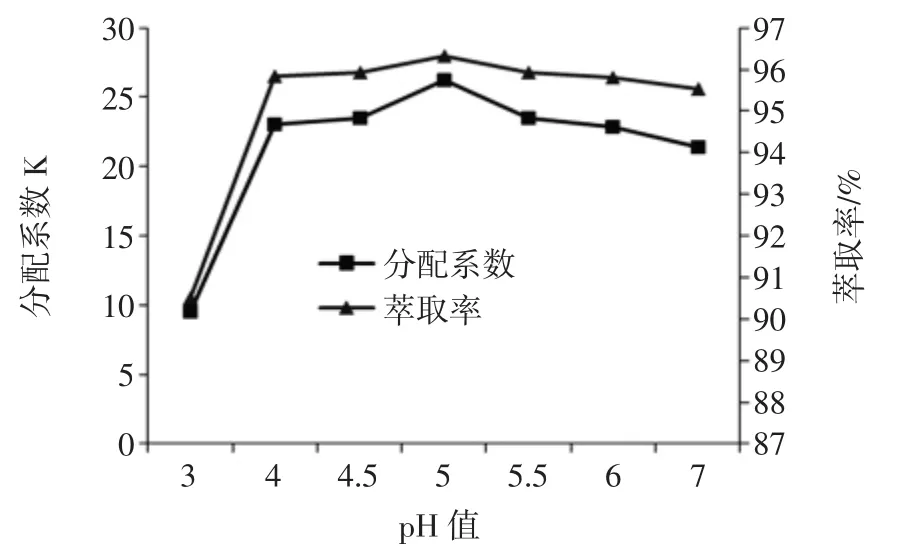
图7 pH值对β-葡萄糖苷酶萃取的影响Fig.7 The effect of pH on β-glucosidase extraction
该双水相体系的pH值由(NH4)2SO4决定,其显弱酸性,使该体系形成的自然pH值为5。由图7可以看出,随着pH值逐渐增大,其分配系数和萃取率呈现先增大后降低的趋势,当pH值为5时,β-葡萄糖苷酶的分配系数和萃取率最佳。
3 结论
通过单因素试验和正交试验可以确定出一套较为优化的超声辅助提取鲍鱼内脏中β-葡萄糖苷酶的工艺条件,同时可以得出各因素对酶活的影响大小:超声功率对酶活有显著性影响,超声时间则影响较小,超声后浸提时间基本不作为影响条件。通过最终的验证试验确定超声辅助鲍鱼内脏中β-葡萄糖苷酶提取的最佳工艺条件为:10 mL的鲍鱼内脏预处理液,在超声波功率为180 W,超声时间为20 min,超声后浸提时间为1 h。该工艺条件下,能从鲍鱼内脏中获得比常规冷提取方法获得的活力更大的β-葡萄糖苷酶,且综合成本较低。
通过考察鲍鱼内脏粗酶液中的β-葡萄糖苷酶在PEG/(NH4)2SO4双水相体系中的分配规律,可以得出对目标酶具有最佳萃取效果的双水相体系为质量分数为 10%PEG1000,质量分数为 16%的(NH4)2SO4,体系pH值为5(自然)。与传统方法相比,双水相萃取不但有较高的提取率,还能进一步去除大量的杂质,达到分离纯化的效果,同时还能保持目标酶较高的活性,是一种高效环保又节约的分离提取方法。后续试验还将对该方法的盐种类及其他条件进行探究,并通过正交试验确定最优组合。该研究能为海洋生物下脚料中有效生物活性物质的分离提取提供一种新的方法和思路,对未来的工业化生产打下基础。

