吡格列酮对2型糖尿病合并非酒精性脂肪肝大鼠肝组织SIRT1、UCP2表达的影响
李 楠,徐 静,成淑英,王 翔,农晰婷
(1西安市中心医院内分泌科,西安 710004;2西安交通大学医学院第二附属医院内分泌科;*通讯作者,E-mail:xujingjdey85@163.com)
2型糖尿病、肥胖、胰岛素抵抗三者密切相关,而肥胖合并2型糖尿病患者常伴发脂肪肝[1]。目前对于2型糖尿病(type 2 diabetes mellitus disease,T2DM)合并非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的发生、发展过程仍未能完全明确,可能与胰岛素抵抗、氧化应激、能量代谢等密切关联,但确切机制尚未明确。Sirt1是一种与代谢有关的基因,能够调节能量代谢、众多基因的转录及细胞衰老,它是一种保守的烟酰腺嘌呤二核苷酸依赖的组蛋白/非组蛋白去乙酰基酶[2]。UCP2是线粒体内膜的蛋白之一,它能将机体代谢作用于合成ATP的能量转变为热量,并对机体能量平衡涉及的体质量、静止代谢率和食物转化效率等性状具有显著的影响[3]。目前国内外对SIRT1、UCP2与机体代谢关系的研究较多,它们参与肥胖、胰岛素抵抗、糖尿病等代谢性疾病的病理过程及机体能量和物质代谢平衡的调节,但有关SIRT1、UCP2在T2DM合并NAFLD中的表达研究及药物干预方面的报道较少。且吡格列酮作为胰岛素增敏剂改善胰岛素抵抗作用研究颇多,也有报道其参与改善脂肪肝的发生、发展及抵抗炎性细胞的浸润作用,但其作用于T2DM合并NAFLD方面的具体研究仍较少。本研究主要通过吡格列酮的干预,分析T2DM合并NAFLD大鼠SIRT1、UCP2表达变化,探讨吡格列酮对T2DM合并NAFLD治疗的可能机制。
1 材料与方法
1.1 动物模型的建立及分组
8周龄雄性SD大鼠60只,清洁级,体质量198-225 g,购于西安交通大学医学院实验动物中心。饲养于标准环境,温度18-26 ℃,湿度50%-60%。随机分为对照组、模型组和吡格列酮组。对照组给予基础饲料喂养,模型组给予高脂及高糖饲料喂养(基础饲料82%,猪油10%,蔗糖5%,胆酸钠0.5%,胆固醇2.5%),制成颗粒料,控温烘干。第12周末,模型组大鼠空腹时腹腔注射链脲佐菌素(30 mg/kg)[4],对照组腹腔注射同样体积的柠檬酸缓冲液。抽取模型组大鼠经10%的水合氯醛麻醉后取肝脏行病理学形态观察,肝脏有明显的脂肪变性,并且胞质内存在大量脂滴空泡,需连续两次以上测得大鼠的空腹血糖≥7.8 mmol/L[5],合并胰岛素抵抗者,确定为2型糖尿病合并非酒精性脂肪肝模型。第15周时,依据大鼠体质量,参照人与大鼠每千克体质量等效剂量折算系数,计算大鼠给药剂量,吡格列酮组给予吡格列酮10 mg/(kg·d)灌胃[6],正常对照组和模型组给予等体积生理盐水灌胃,药物干预共持续8周。实验中1只大鼠被随机选做肝脏病理切片,观察造模成功情况,1只大鼠造模不成功,3只大鼠灌胃期间死亡,共有55只大鼠完成全部实验(共22周)。
1.2 主要试剂与仪器
主要有链脲佐菌素(Sigma,美国),游离脂肪酸试剂盒(RANDOX,英国),胰岛素检测试剂盒(R&D,美国),全自动生化分析仪(型号7170,日本日立公司),SIRT1、UCP2兔抗大鼠多克隆抗体(北京博奥森生物有限公司),real-time PCR试剂盒(Fermentas,加拿大),PCR仪(BIO-RAD,美国),实时荧光定量PCR仪(Applied Biosystems,美国)。
1.3 血清学指标测定
实验结束(22周末)时使用全自动生化分析仪测定各组空腹血糖(FBG)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、游离脂肪酸(FFAs);ELISA法测定空腹胰岛素(FINs)。
1.4 肝脏组织形态学观察
大鼠经10%的水合氯醛麻醉,取肝组织,10%甲醛固定;常规石蜡包埋,切片、HE染色,中性树胶封片,光镜,观察各组大鼠肝脏组织形态学的变化。
1.5 免疫组织化学检测SIRT1、UCP2的表达
石蜡切片脱蜡至水;3% H2O2室温孵育5-10 min;蒸馏水冲洗,PBS浸泡5 min;滴加5%-10%正常的山羊血清封闭,室温孵育10 min;滴加一抗(SIRT1、UCP2稀释浓度均为1 ∶100),4 ℃过夜;PBS洗5 min×3次;滴加二抗,37 ℃孵育10-30 min;PBS冲洗,5 min×3次;滴加适量的碱性磷酸酶标记的链霉卵白素工作液,37 ℃孵育10-30 min;PBS洗5 min×3次;显色剂显色3-15 min;行自来水充分冲洗,复染,脱水,透明,最后封片。阴性对照选用PBS,阳性反应表现为胞质内出现棕黄色颗粒,分别测定SIRT1及UCP2的平均积分光密度值(AIOD)。
1.6 实时定量PCR检测SIRT1、UCP2的表达
Fast法提取肝组织总RNA,逆转录为cDNA,应用RT-PCR法检测肝组织SIRT1及UCP2 mRNA表达水平。基因引物的序列分别为:SIRT1上游:5′-TCATTCCTGTGAAAGTGATGACGA-3′,下游:5′-CTGCCACAGTGTCATATCATCCAA-3′,序列号:NM-012238.4,长度为196 bp。UCP2上游:5′-GCTGGTGACCTATGACCTCAT CAA-3′,下游:5′-GTACTGGCCCAAGGCAGAGTTC-3′,序列号:NM-003355.2,长度为172 bp。内参β-actin上游:5′-GGAGATTA CTGCCCTGGCTCCTA-3′,下游:5′-GACTCATCGTACTCCTGCTTGC TG-3′,序列号:NM-005159.4,长度为150 bp。循环条件:50 ℃ 2 min,95 ℃ 10 min;然后95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环,使用相关软件进行数据分析。
1.7 统计学处理
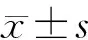
2 结果
2.1 三组血清学指标比较
实验结束时,模型组大鼠FBG、TC、TG、LDL-C、ALT、AST、FFAs、FINs均较正常对照组显著升高(P<0.05);吡格列酮组大鼠FBG、TC、TG、LDL-C、ALT、AST、FFAs、FINs均较模型组减低,均有统计学差异(P<0.05,见表1)。

表1 实验结束时各组大鼠血清学指标比较Table 1 Comparison of serum markers at the end of experiment between three
2.2 大鼠肝组织病理学改变
染色后,通过光镜观察到对照组大鼠肝细胞形态规则,并且结构完整。模型组大鼠肝细胞高度气球样变及脂肪变性,胞质中有大量脂滴空泡,均为中至重度脂肪肝。吡格列酮组大鼠肝组织与正常对照组相比较,仍可见轻至中度气球样变及脂肪变性,但与模型组比较,气球样变及脂肪变性程度均减轻,胞内脂滴数量明显减少,同时细胞体积缩小,炎性细胞的浸润程度和坏死灶也相对缩小(见图1)。

A.正常对照组 B.模型组 C.吡格列酮组
2.3 免疫组化SIRT1、UCP2的表达结果
图片中被染色的SIRT1、UCP2阳性信号为棕黄色颗粒,结果显示:模型组SIRT1表达的AIOD值较正常对照组明显减少(P<0.05),吡格列酮组SIRT1表达的AIOD值较模型组增加(P<0.05);而模型组UCP2表达的AIOD值较正常对照组明显增加(P<0.05),吡格列酮组UCP2表达的AIOD值较模型组减少(P<0.05,见表2,图2)。
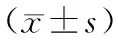
表2 各组SIRT1、UCP2 AIOD的比较Table 2 Comparison of SIRT1, UCP2 AIOD between three
2.4 实时定量PCR检测SIRT1 mRNA、UCP2 mRNA的结果
模型组SIRT1 mRNA表达显著低于正常对照组,差异有统计学意义(P<0.05);吡格列酮组SIRT1 mRNA表达显著高于模型组(P<0.05);而模型组UCP2 mRNA表达显著高于正常对照组(P<0.05);吡格列酮组UCP2 mRNA表达显著低于模型组(P<0.05,见表3)。
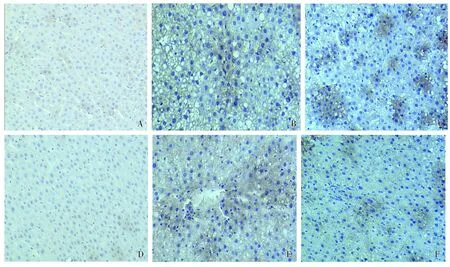
A.正常对照组SIRT1表达;B.模型组SIRT1表达;C.吡格列酮组SIRT1表达;D.正常对照组UCP2表达;E.模型组UCP2表达;F.吡格列酮组UCP2表达
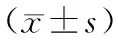
表3 各组SIRT1、UCP2 mRNA表达的比较Table 3 Comparison of SIRT1, UCP2 mRNA between three
3 讨论
随着2型糖尿病、非酒精性脂肪肝发病率的不断增加,目前认为胰岛素抵抗是引起非酒精性脂肪肝的重要原因之一。本研究通过对大鼠喂养高脂高糖饮食及小剂量链脲佐菌素腹腔注射法成功地建立T2DM合并NAFLD大鼠模型,T2DM合并NAFLD大鼠在实验中血糖升高,血脂、转氨酶及游离脂肪酸均升高,产生明显的胰岛素抵抗。肝脏病理结果显示肝组织出现明显的脂肪变性。
本实验通过免疫组化法观察到T2DM合并NAFLD组大鼠肝脏SIRT1的表达较正常对照组减低,UCP2的表达较正常对照组增加;real time-PCR法对T2DM合并NAFLD组大鼠肝脏SIRT1、UCP2在mRNA水平上的表达变化进行统计,SIRT1 mRNA表达较正常对照组降低,UCP2 mRNA表达较正常对照组增加,表明SIRT1与UCP2的异常表达可能在T2DM合并NAFLD起着关键作用。有研究表明SIRT1通过PGC1-α通路促进糖异生相关基因的表达并抑制着糖酵解相关基因的表达,而SIRT1的活性受到NAD+影响,因此SIRT1极有可能是通过感知肝细胞中的NAD+水平的方法,来发挥调控机体葡萄糖代谢及营养平衡功能的作用[7]。在长期高脂高糖饮食状态下,通过热卡限制使动物SIRT1的蛋白表达水平不断增高,可以改善肝脏的脂肪变性和促进其合理的能量代谢[8]。本研究表明UCP2 mRNA表达较正常对照组增加,有学者提出UCP2的表达可能与胰岛素抵抗、对ATP合成的调控相关联[9]。T2DM合并NAFLD时存在明显IR、FFAs升高、转氨酶增高及糖、脂代谢紊乱,通过产生的高胰岛素血症、糖脂毒性致使SIRT1表达下调及其活性减低[10],未能有效地改善肝脏脂质沉积,进一步促进脂肪肝的发展。IR的存在、FFAs升高及脂质代谢的紊乱,使得肝细胞内SIRT1表达下调,失去了对UCP2的抑制,进而UCP2表达可以增强。诱导UCP2上调表达,可能是机体的一种适应性反应,但是UCP2的过度表达,使其活性增加,氧化磷酸化解偶联作用增强,ATP合成作用下降,同时ATP过度的消耗,使得肝细胞对于坏死显得尤为敏感[11]。
PPAR-γ作为一个关键的调节因子,在脂肪形成和堆积时通过调节特殊的脂肪基因表达来改善脂类物质的代谢,同时也操控着更多的中间型转录因子的表达。SIRT1表达受限,有可能造成与NcoR和视黄酸及SMRT相互作用减弱,抑制PPAR-γ的作用被解除[12],脂肪动员受阻,继而出现明显的肝脏脂肪变。NAFLD中的肝细胞UCP2表达增强可能与氧化应激增强、高脂饮食、FFAs增多、胰岛素抵抗等诸多因素密切相关,NAFLD时UCP2基因在肝细胞中的表达会有增加,对机体能量和物质代谢平衡起重要的调节作用,但同时在机体受损伤时,它也是主要的靶组织。有研究表明PPAR-γ被活化后,可通过阻止胰岛细胞中UCP2表达的增加,从而使基础胰岛素水平保持平稳,以及胰岛素分泌水平保持正常[13]。吡格列酮通过与PPAR-γ核受体转录因子结合而改善胰岛素敏感性,它不仅可以抑制肝脏脂肪沉积及肝细胞损伤,而且可以改善肝纤维化。近年来对吡格列酮改善脂肪肝的发生、发展及抵抗炎性细胞浸润作用的研究有了进一步发现,包括改善脂肪组织中胰岛素的敏感性,减轻肝细胞的脂肪堆积;选择性地作用于PPAR-γ,调节葡萄糖、脂类代谢,更好地减轻胰岛素抵抗等。本实验发现给予大鼠行吡格列酮治疗后,该组大鼠血脂、血糖、肝功、胰岛素水平、游离脂肪酸水平均较模型组改善,肝脏病理显示脂肪变性减轻。同时本实验还发现吡格列酮可以促进SIRT1表达,同时降低UCP2表达。这可能与PPAR-γ可以在转录水平调节肝脏SIRT1、UCP2的表达有关。但它们如何在T2DM合并NAFLD发生、发展中起作用尚不清楚,有待于更进一步的研究。
综上所述,关于T2DM合并NAFLD的发病机制仍需进一步探讨,本实验样本量局限,SIRT1、UCP2的研究结果可能受到影响,但是本研究对T2DM合并NAFLD的药物治疗方面可能会有一定程度的启示作用,有可能会对该疾病的治疗带来新发现。

