PHD3对缺氧状态A549细胞株中HIF-1α表达及其生物学特性的影响
楚 晓,周 超,王伟青,向 明,刘 辉
(1复旦大学附属上海市第五人民医院胸外科,上海 200240;2上海市胸科医院,上海交通大学附属胸科医院胸外科;*通讯作者,E-mail:jesus8@163.com)
非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的大部分,其发病率呈逐年上升的趋势。近几年来肺癌的靶向治疗得到飞速发展,成为肺癌治疗的有效方案[1]。但目前靶向治疗的靶点较少[2]。因此,寻找更多的治疗靶点基因,对于肺癌的治疗具有重要意义。
实体肿瘤的快速生长会形成缺氧环境,而缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是促进肿瘤血管形成,使肿瘤细胞得以存活和生长的关键因子[3]。研究发现,HIF本身并不能直接感受氧分压的变化,而脯氨酰酸羟化酶(prolyl hydroxylase,PHD)才是真正直接感受氧分压的分子,并对保持HIF-1α数量的稳定发挥重要作用[4]。现己证实,在哺乳动物细胞中有三种类似的酶PHDl、PHD2和PHD3,有研究认为PHD3可能在较重程度缺氧或长时间缺氧时发挥调节HIF-1α的作用[5]。故本研究提出假设:在缺氧状态非小细胞肺癌细胞中,PHD3随着缺氧状态的加重而表达升高,通过正向调控HIF-1α的表达,进而促进肿瘤生长。为了验证上述假说,本研究首先建立缺氧状态非小细胞肺癌细胞模型,观察不同缺氧程度下PHD3、HIF-1α的表达变化;改变该模型中PHD3的表达水平,观察PHD3对HIF-1α表达的调控作用及对其生物学特性的影响,旨在为非小细胞肺癌靶向治疗提供新的潜在靶点。
1 材料和方法
1.1 细胞株及主要试剂
A549细胞购自中国科学院上海生命科学研究院细胞库。BCA试剂盒(碧云天生物技术研究所),HRP-羊抗兔二抗、HRP-羊抗鼠二抗(美国Jackson),DAB试剂盒(北京中杉金桥生物技术有限公司),Annexin Ⅴ凋亡检测试剂盒(美国BD),RNA提取试剂盒(中国TAKARA),SYBR GREEN kit、RT-PCR反应膜(美国ABI),CoCl2(中国国药集团化学试剂公司),GAPDH抗体、HIF-1α抗体、PHD3抗体、PKM2抗体(美国Proteintech),PHD3-siRNA(上海拓然生物科技有限公司),Transwell小室、基质胶(美国Corning)。
1.2 A549细胞缺氧模型建立
A549细胞培养在DMEM+10%胎牛血(FBS)+1%双抗的培养基中,培养条件为37 ℃,5% CO2恒温恒湿培养箱。细胞计数板计数,6孔板中每孔2×105个细胞。37 ℃,5% CO2培养,细胞培养过夜。加终浓度为200 μmol/L的氯化钴(CoCl2)分别处理12 h和24 h,并设立对照组。加RIPA裂解液收集蛋白,用于后续实验。
1.3 Western blot检测PHD3、HIF-1α蛋白表达
收集缺氧培养的A549细胞及转染或siRNA干扰处理结束后的各组细胞,用RIPA裂解液裂解,提取细胞总蛋白。BCA法测定各组样本蛋白浓度,沸水浴变性处理后进行聚丙烯酰胺凝胶电泳,转至PVDF膜上,10%脱脂奶粉溶液封闭,分别加入相应一抗4℃孵育过夜,二抗37 ℃孵育45 min。ECL显影,暗室曝光。
1.4 免疫细胞化学检测PHD3、HIF-1α蛋白表达
胰酶消化细胞后重悬细胞于完全培养基中,制备单细胞悬液,计数,37 ℃,5% CO2培养过夜。终浓度为200 μmol/L的CoCl2分别处理12 h和24 h。吸除培养基,PBS洗涤,4%多聚甲醛(PBS配制)固定20 min,使用PBS洗涤细胞除去多聚甲醛。0.5% Triton X-100(PBS配制)室温孵育20 min,内源性过氧化物酶处理:3% H2O2孵育,用10%的与二抗同源的血清(PBS配制)封闭30 min,一抗4 ℃孵育过夜,滴加足够量适宜浓度的羊抗兔二抗(1 ∶1 000),37 ℃,30 min。DAB显色,苏木素染色复染核,中性树胶封片。
1.5 PHD3过表达质粒构建
通过基因合成获得目的片段插入到载体pUC57-Amp,转化到大肠杆菌,取感受态细胞,冰上融化,将重组的产物加入到感受态细胞中冰浴30 min,42 ℃热激75 s,冰浴3 min,加入800 μl LB培养基,37 ℃培养1 h,4 000 r/min离心5 min,去上清,将沉淀全部均匀涂到含有氨苄青霉素的平板上,过夜培养等菌落形成。小量提取质粒(挑取单克隆过夜培养,取过夜培养的菌液,加入离心管中,12 000 r/min离心1 min,尽量吸除上清。依次向留有菌体沉淀的离心管中加入溶液P1,P2,P3,使菌体充分裂解,最终出现白色絮状沉淀。将上一步收集的上清液用移液器转移到吸附柱中,12 000 r/min离心60 s,倒掉收集管中的废液,将吸附柱放入收集管中,依次加入去蛋白液PD,漂洗液PW,并分别离心、去掉废液、再离心后,将吸附柱开盖,置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液,将吸附柱置于一个干净的离心管中,向吸附膜的中间部位滴加洗脱缓冲液EB,室温放置2 min,12 000 r/min离心2 min,将质粒溶液收集到离心管中。测序鉴定后,将提取的质粒pUC57-BX647792和载体PCDNA3.1通过Hind Ⅲ/XhoⅠ酶切过夜,用琼脂糖凝胶回收试剂盒切胶回收,4 ℃连接过夜,转化到大肠杆菌,通过酶切鉴定后,质粒提取试剂盒大提质粒,-20 ℃保存。
1.6 PHD3过表达的A549细胞制备
胰酶消化处理细胞,离心,计数。细胞接6孔细胞培养板,用250 μl Opti-MEM稀释1 000 ng质粒,吹吸混匀,轻轻颠倒混匀转染试剂,用250 μl Opti-MEM稀释10 μl LipofectamineTM2000,轻吹吸混匀,室温静置5 min。混合转染试剂和质粒稀释液,吹吸混匀,室温静置20 min。转染复合物加入到6孔板中,转染6 h后更换新鲜培养基,细胞板置于37 ℃、5% CO2培养箱中培养48 h。收取细胞用于RT-PCR和Western blot实验检测过表达效果。
1.7 siRNA法制备PHD3低表达的A549细胞
胰酶消化处理细胞,离心,计数,细胞接6孔细胞培养板,用250 μl Opti-MEM稀释siRNA(转染细胞的终浓度为100 nmol/L),轻轻吹吸混匀。轻轻颠倒混匀转染试剂,用250 μl Opti-MEM稀释10 μl LipofectamineTM2000,轻轻吹吸混匀,室温静置5 min。混合siRNA稀释液,轻轻吹吸混匀,室温静置20 min。转染复合物加入到6孔细胞板中,500 μl/孔,前后轻摇细胞板混合均匀。转染6 h后更换新鲜培养基。37 ℃、5% CO2培养48 h。收取细胞用于RT-PCR和western blot实验检测沉默效果。
1.8 real-time PCR检测PHD3、HIF-1α基因表达
收集各组细胞,使用总RNA提取试剂盒提取样本总RNA,并通过反转录PCR合成cDNA样本,根据人PHD3、HIF-1α基因序列和内参β-actin序列,使用Primerpremier 5.0软件设计相应引物。取上述cDNA产物作为模板,采用real-time PCR,检测HIF-1α基因表达。
1.9 CCK-8法检测细胞增殖能力
细胞弃去细胞培养基,胰酶消化后,离心弃上清。细胞计数板计数,铺板。96孔板中每孔1×104个细胞,转染siRNA或PHD3过表达质粒。转染6 h后,每孔加入10 μl CCK-8溶液,37 ℃继续培养1 h。在酶联免疫检测仪OD 450 nm测量吸光值。计算细胞增殖活力。
1.10 Transwell细胞迁移实验检测细胞迁移能力
细胞铺6孔板,每孔2×105个细胞。细胞计数板计数,用含有1%FBS的DMEM培养基制备细胞悬液,调整细胞至5×105个/ml。10% FBS的培养基置于细胞培养皿的下室,每孔600 μl。在上孔准确加入1×105个细胞/孔,细胞悬液体积200 μl。置于37 ℃ 5% CO2细胞培养箱中培养24 h。待培养时间结束后,弃去上室液体,小心取出上室,用湿棉签擦去未穿过膜的细胞。4%中性甲醛固定10 min,结晶紫染色10 min,PBS洗3次,干燥,直接取下小室,显微镜下检测穿过膜的细胞(200×)。
1.11 Transwell细胞侵袭实验检测细胞侵袭能力
无菌条件下取出稀释好的基质胶,冰浴融化,加入到(24孔)聚碳酸酯膜上,37 ℃放置至胶完全凝固。每孔加入200 μl培养基使胶重构。将10%FBS的培养基置于细胞培养皿的下室,制备好的细胞悬液,调整细胞至5×105个/ml,在上孔准确加入1×105个细胞/孔,细胞悬液体积200 μl。置于37 ℃ 5% CO2细胞培养箱中培养24 h。弃去上室液体,小心取出上室,用湿棉签擦去未穿过膜的细胞。4%中性甲醛固定10 min,结晶紫染色10 min,取下小室,显微镜下检测穿过膜的细胞(200×)。每张膜的中央部分和边缘部分各随机取3个视野,计算每个视野内的细胞数。
1.12 统计学分析
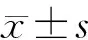
2 结果
2.1 缺氧状态A549细胞中PHD3和HIF-1α的表达
建立A549细胞缺氧模型,模拟非小细胞肺癌肿瘤内部缺氧状态,并通过Western blot检测了缺氧状态下的肺癌细胞中PHD3和HIF-1α的表达。缺氧A549细胞中HIF-1α的表达水平随着缺氧时间延长而增加,而PHD3的表达随着缺氧时间的延长而降低(见图1A)。免疫细胞化学染色显示,缺氧A549细胞中PHD3的表达水平降低(见图1B)。
2.2 缺氧状态A549细胞中PHD3的过表达及低表达对HIF-1α的调控
通过质粒转染建立PHD3的过度表达的缺氧培养A549细胞模型(见图2A),通过siRNA干扰建立PHD3的低表达的缺氧培养A549细胞模型(见图2B)。PHD3的过表达显著抑制HIF-1α的表达(见图3A),抑制PHD3表达可增加HIF-1α的表达(见图3B)。

图1 缺氧状态A549细胞中PHD3和HIF-1α的表达Figure 1 The expression of PHD3 and HIF-1α in hypoxic A549 cells by Western blot and immunohistochemistry
2.3 PHD3的过表达及低表达对肺癌细胞增殖、迁移、侵袭的影响
与对照相比,在缺氧条件下过表达PHD3的A549肺癌细胞的增殖,侵袭显著降低(P<0.05,见图4)。与对照相比,在缺氧条件下低表达PHD3的A549肺癌细胞的增殖,迁移和侵袭显著增加(P<0.01,见图5)。
3 讨论
缺氧与许多癌症(包括肺癌)的预后和肿瘤控制有关[6]。本研究探讨了在非小细胞肺癌中,PHD3表达对HIF-1α表达的影响,以及PHD3的表达变化对非小细胞肺癌细胞系A549的细胞生物学特性,以研究PHD3在非小细胞肺癌中的作用机制和作为靶向治疗靶点的潜力。CoCl2是一种缺氧模拟剂,通常用于体外诱导缺氧[7]。用CoCl2处理A549细胞后,HIF-1α的表达显着增加,而PHD3的表达相对降低。这与之前的研究[8-10]一致,表明本试验中的非小细胞肺癌细胞缺氧模型的构建是成功的。PHD3作为氧感受器,对肿瘤微环境中的缺氧状态非常敏感,当肿瘤微环境中氧浓度下降后,PHD3的活性受到抑制,HIF-1α无法被羟基化,从而对HIF-1α的诱导分解降低,导致HIF-1α的大量累积,从而结合HIF-1β,进入细胞核发挥转录因子的功能,在非小细胞肺癌细胞的增殖、转移、侵袭等方面发挥重要的作用[11,12]。HIF-1α由于缺氧时脯氨酰羟化酶(PHD)活性降低而积累,通过调节细胞周期蛋白和细胞周期蛋白依赖性激酶抑制剂与c-Myc相互作用以控制细胞周期[13]。HIF-1α还调节小胶质细胞的迁移[14]。此外,已经证明抑制HIF-1α表达可以减少非小细胞肺癌NCI-H157细胞的增殖和侵袭[15]。已发现PHD3表达增加通过多种机制抑制细胞增殖,包括EGFR调节[16]和HIF-1信号传导[17]。本研究结果提示,HIF-1α的表达与非小细胞肺癌耐受缺氧环境,维持肿瘤的存活和生长密切相关,并且作为重要的氧感受器和HIF-1α的重要调节器,PHD3过度表达,抑制了HIF-1α的表达,PHD3低表达时,HIF-1α的表达明显增强,同时对非小细胞肺癌细胞的生物学特性也产生明显影响:在缺氧条件下的A549细胞在PHD3过表达时,增殖、迁移和侵袭显著降低(P<0.05);在PHD3低表达时,增殖、迁移和侵袭显著增加(P<0.01)。
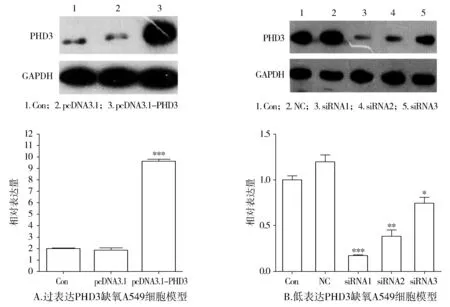
Con:对照组;NC:阴性对照;与Con组比较,*P<0.05,**P<0.01,***P<0.001

图3 过表达或低表达PHD3的A549细胞中HIF-1α的表达Figure 3 Expression of HIF-1α in A549 cells after over-expression or low expression of PHD3
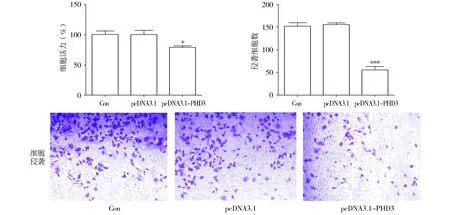
Con:对照组;NC:阴性对照;与对照(Con)组比较,*P<0.05,**P<0.01,***P<0.001

Con:对照组;NC:阴性对照;与对照(Con)组比较,*P<0.05,**P<0.01
综上所述,PHD3的表达变化能够影响非小细胞肺癌的HIF-1α基因的表达,同时对肿瘤细胞的增殖、迁移和侵袭等生物学特性产生重要影响,因而PHD3可能成为非小细胞肺癌靶向治疗的新的潜在的靶点。

