CT脑中线移位对恶性大脑中动脉梗塞去颅瓣减压术预后评估
宁清灵 林惠花 徐志华 段阳* 杨本强 关靖宇
(1锦州医科大学沈阳军区总医院研究生培养基地, 辽宁 沈阳 110016; 沈阳军区总医院: 2放射诊断科; 3神经外科,辽宁 沈阳 110016)
恶性大脑中动脉梗塞(malignant middle cerebral artery infarction, MMI)是指大面积脑梗塞所致严重脑水肿和颅内压升高,导致神经功能不断恶化,甚至发生脑疝危及生命,复发率、致残率和死亡率均高[1]。目前MMI的临床治疗标准不一且预后差,是神经急诊临床工作的难题之一,其治疗原则和方法存在争议。国外临床证实去颅瓣减压术治疗可降低患者的死亡率并改善神经及运动功能[2-6]。但是早期评估和预测还没有统一的标准。SANG-BEOM JEON等[7]研究认为MMI患者行去颅瓣减压术手术前后中线测量作为患者预后早期评估指标有显著意义,中线移位程度减轻预示预后良好;国内鲜有报道。本研究旨在通过NECT的影像指标初步探讨去颅瓣减压术手术前后中线结构移位对MMI者预后进行评估和分析,为进一步指导临床对MMI选择治疗方案奠定研究基础。
对象与方法
一、一般资料
研究对象为我院2012年12月至2017年2月收治的37例(男25例,女12例)经确诊为MMI且行去颅瓣减压术治疗的患者。纳入标准:①影像学表现为大面积脑梗塞,有严重脑水肿;②临床神经功能评估不断恶化,临床采取去颅瓣减压术治疗;③患者行去颅瓣减压手术前后均进行常规NECT(non enhanced CT, NECT)扫描检查。
二、临床资料
所有患者入院后均进行积极内科治疗,由于患者病情不断恶化发展为MMI,内科治疗效果欠佳,行去颅瓣减压术。手术指征:诊断明确,梗塞面积大,非手术治疗无效,术前检查无禁忌症(血常规、血液生化、凝血等指标正常)。对患者术后随访3个月情况进行改良Rankin量表(modified Rankin scale, mRS)评分,定义mRS评分<5分为预后良好,mRS评分≥5分为预后不良。采集患者发生恶性脑梗塞的危险因素(高血压、高脂血症、糖尿病、高同型半胱氨酸血症、心脏病)、入院时格拉斯哥昏迷指数(Glasgow coma scale, GCS)和美国国立卫生研究缘卒中量表(NIH stroke scale, NIHSS)评分以及外科手术去颅瓣面积大小。
三、影像学检查
所有纳入研究的患者都进行了常规CT(GE Discovery CT750 HD)扫描,以听眦线为基线行横断面平扫,层厚5 mm,层距5 mm,120 KV,250 mA。所有患者NECT检查图像质量均符合质控要求。中线移位测量由两位经验丰富的神经放射诊断医师共同完成。测量脑中线结构移位标志为大脑镰,测量基线为额顶骨正中骨脊连线。测量透明隔最大移位处至测量基线的垂直距离。分别测量术前、术后脑中线移位情况(检查时间为术前2 h内,术后2 h内),并求两者的差值(后者-前者),以差值作为中线移位减轻与否的标准。去颅瓣减压手术前后中线移位程度减轻(差值≤-1 mm),无变化(-1 mm<差值<1 mm),增加(差值≥1 mm)[7]。
四、统计学方法
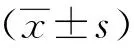
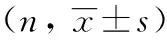
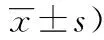
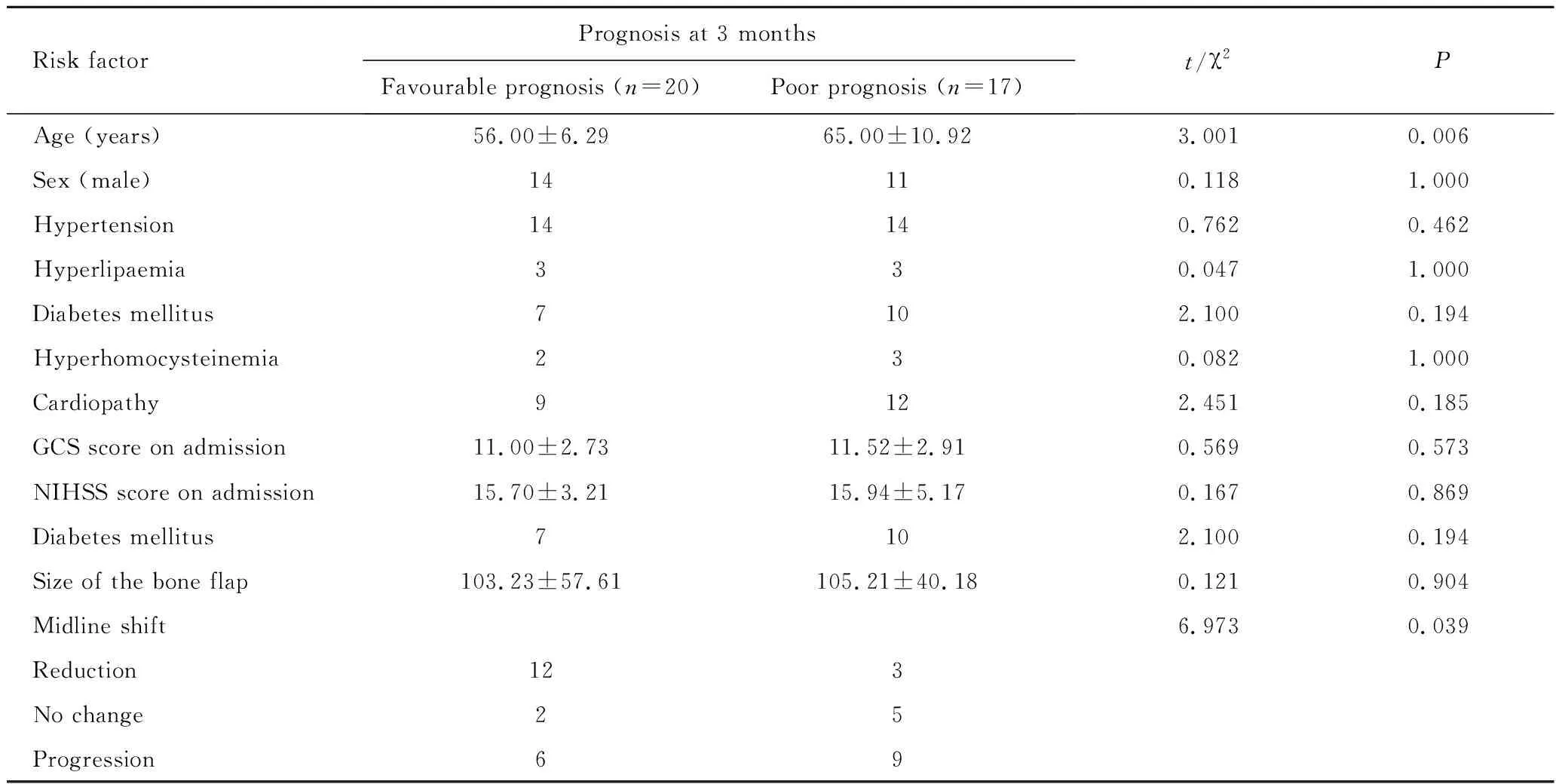
Risk factorPrognosis at 3 monthsFavourable prognosis (n=20)Poor prognosis (n=17)t/χ2P Age (years)56.00±6.2965.00±10.923.0010.006 Sex (male)14110.1181.000 Hypertension14140.7620.462 Hyperlipaemia330.0471.000 Diabetes mellitus7102.1000.194 Hyperhomocysteinemia230.0821.000 Cardiopathy9122.4510.185 GCS score on admission11.00±2.7311.52±2.910.5690.573 NIHSS score on admission15.70±3.2115.94±5.170.1670.869 Diabetes mellitus7102.1000.194 Size of the bone flap103.23±57.61105.21±40.180.1210.904 Midline shift6.9730.039 Reduction123 No change25 Progression69
结 果
恶性脑梗塞的高危因素与去颅瓣减压术预后关系详见表1,除年龄之外,其他危险因素P>0.05,差异无统计学意义。术后随访3个月预后不良共17例(45.9%),中线移位减少者3例,中线移位无变化者5例,中线移位增加者9例;预后良好20例(54.1%),中线移位减少者12例,中线移位无变化者2例,中线移位增加者6例;经χ2分析, χ2=6.973,P=0.039,差异有统计学意义。
讨论
MMI是由于大脑中动脉内栓子脱落或者心源性栓子栓塞发生的进行性恶化的脑梗塞,MORI K等[8-9]认为对于大脑中动脉梗塞所致的大面积脑梗塞,传统的溶栓和抗凝治疗不但不适宜,更易导致出血性转化;由于梗塞区域的血管痉挛以及血脑屏障的破坏,病灶区域的血流可能进一步减少,形成脑内窃血现象,加重脑水肿的发生和发展,目前临床对MMI的治疗主要是采取积极内科非溶栓治疗,但是MMI梗塞面积大,严重脑水肿和颅内压升高,导致神经功能不断恶化,虽然经过积极的内科治疗,死亡率仍居高不下[10-11]。探索MMI新的治疗方案成为神经科医师临床工作的重心之一,去颅瓣减压术是恶性脑梗塞治疗进展的一大突破,去颅瓣减压术对MMI改善神经运动功能有积极的影响[2-6]。但是,目前对于术后早期评估缺乏有价值的影像评估预测指标,而不能对术后患者进行早期评估以及及时调整治疗方案。我们研究提示去颅瓣减压手术前后NECT图像中线移位程度与MMI预后有着密切的关系,中线移位程度减低预示着患者预后良好。本研究结果显示MMI患者去颅瓣减压术后NECT图像上中线减轻≥1 mm者预后良好,年龄小者较年龄大者预后好。
MMI患者去颅瓣手术后中线移位减轻的病理生理机制值得我们推敲。颅脑是一个骨性封闭结构,可扩张容积有限,当颅内压力不对称性增高时可出现中线移位甚至脑疝。去颅瓣减压术去除患者大脑患侧部分颅骨,术后行人工硬膜减张缝合,一方面扩大颅脑容积,这是手术释放颅内高压的直接作用,使一部分脑组织突出于颅骨外,使偏移的中线结构向正常方向回复;另一方面这也使得发生梗塞脑组织代偿能力提高[12];在NECT上表现为大脑中线移位程度减轻,见图1、图2。在MMI患者中大脑中线结构移位是因为脑组织缺血缺氧导致脑组织严重水肿而颅内压升高,恶性脑梗塞主要的死亡原因是难以消除的脑组织肿胀,在NECT上表现为中线移位[13-14]。MMI术后脑中线移位减轻使脑组织生理功能有得以恢复的条件,这与我们所提出的观点相一致。
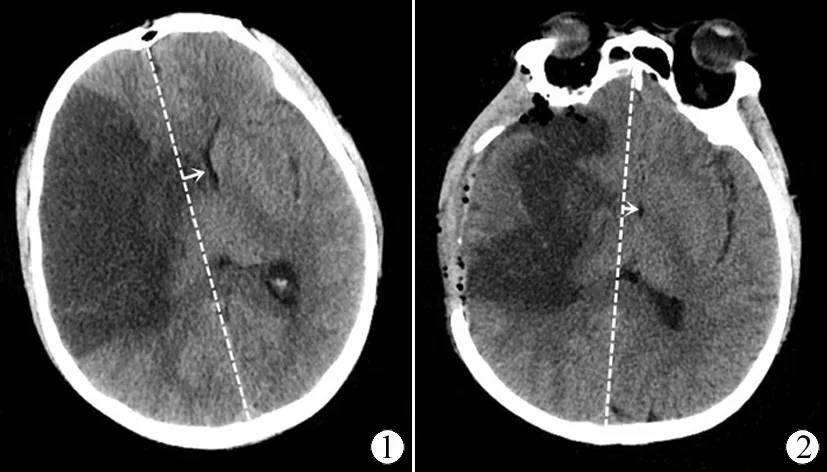
图1 去颅瓣减压术前,脑组织严重水肿,脑中线移位结构向左侧移位(10.6 mm)
Fig 1 Before the decompressive hemicraniectomy, brain edema was severe, and the shift structure of the brain was shifted to the left (10.6 mm)
图2 去颅瓣减压术后,脑组织肿胀减轻,移位脑中线移位部分恢复 (6.7 mm)
Fig 2 After the decompressive hemicraniectomy, the swelling of the brain tissue was reduced, and the translocation was partially restored (6.7 mm)
再者,去颅瓣减压术使颅内力降低,静脉回流增加,部分受压血管再通,再灌注通路形成,这为神经及运动功能恢复提供保障。颅内压降低使静脉回流通畅,血管源性脑水肿可通过静脉回流消除,脑肿胀程度进一步减轻,表现为中线结构移位程度减轻。有文献报道发生脑梗塞6 h后会发生细胞毒性水肿,24~48 h后发生血管源性脑水肿,临床出现颅内高压症状多在2~3 d以后[15]。梗塞区域脑组织血管痉挛,再加上脑组织肿胀导致颅内高压使梗塞脑组织血供进一步减少,阻止脑梗塞病情进展是治疗脑梗患者首要目标,而降低颅内压是关键。
然而本研究结果预后良好患者中还出现了术后中线结构移位不变以及增加者,这些患者可能正处于迟发的血管源性脑水肿期,去颅瓣减压术所提供的代偿空间并不能抵消脑组织正在发展的脑水肿,因此大脑中线结构移位程度并未减轻。但是脑组织生理状态还是得到改善,最后结局并没有向预后不良方向发展。所以术后MMI患者脑中线移位程度仍可用于初步判断预后。
本研究结果还显示年龄与恶性脑梗塞患者去颅瓣减压术预后有关系,年龄大者比年龄小者预后差[16]。随着年龄的增长,脑组织的代偿能力降低,血管脆性增加,导致年龄大者较年龄小者恢复能力差,因此脑梗塞预后较差。
本研究对象为恶性脑梗塞患者,未进行MRI以及脑灌注检查,不能用更加精准的检查手段进行校正,在影像学检查手段上有待完善。但是NECT普及度高,可获得性良好。另外,样本含量小,在未来的研究中需要扩大样本量及更加完善的临床数据进一步研究。
总之,本研究认为NECT图像上中线移位程度的减轻可作为MMI去颅瓣减压术预后的早期预测指标,指导临床对MMI患者术后早期评估及治疗。
——书写要点(三)