脑缺血模型中皮层Sirt3与自噬蛋白LC3表达的相关性
李建荣 蒋晓帆 张磊 岳康异 黑悦
(空军军医大学西京医院神经外科,陕西 西安 710032)
缺血性脑卒中(ischemic stroke, IS)后神经元不仅发生凋亡与坏死,还可发生自噬。目前研究发现,IS后自噬水平增高,同时一类线粒体去乙酰化酶在神经元损伤后表达亦增高[1-3]。沉默信息调节因子3(silent information regulator, SIRT3)是线粒体的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)依赖的去乙酰化酶家族成员,广泛存在于线粒体基质和细胞核中[4-5]。我们推测SIRT3可能通过调控线粒体自噬影响IS后皮层缺血区细胞的转归[6]。SIRT3定位于线粒体,在肝脏、心肌、大脑等高表达[7-8]。然而,SIRT3在缺血性脑卒中如何发挥作用及其机制,目前尚未得到明确肯定。
为了进一步研究SIRT3对小鼠缺血再灌注模型皮层区域神经元细胞自噬及凋亡的影响,本研究使用小鼠大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)法建立脑缺血再灌注损伤模型,取再灌注3 h、24 h、3 d、7 d四个时间点,利用免疫荧光和蛋白印迹法观察LC3和SIRT3的共定位以及损伤后的变化趋势情况,分析两者的相关性。
材料与方法
一、实验动物和分组
全部健康成年C57BL/6J小鼠(20~22 g)32只,由第四军医大学实验动物中心提供。实验动物随机分为4组,即脑缺血再灌注3 h、24 h、3 d、7 d组,每组8只。实验过程中如遇死亡则另行补齐。
二、小鼠脑缺血再灌注模型的制作
术前12 h禁食不禁水,用腹腔麻醉(10%水合氯醛,3 mg/kg)麻醉小鼠,游离左侧颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)和颈内动脉(internal carotid, ICA),结扎ECA和CCA近心端,动脉夹夹闭CCA远端,在CCA结扎与夹闭两处之间用动脉剪剪一小口,将浸于肝素生理盐水中的尼龙线栓(头端直径为0.23 mm)沿CCA插入ICA,约12 mm,然后结扎颈总动脉固定线栓,然后缝合皮肤。整个手术过程中室温保持在22~25 ℃。术后将动物置于放有清洁垫料的饲养盒中,自由饮水、进食。
三、间接免疫荧光染色
5组中各取3只进行染色。无痛麻醉后剪开腹腔暴露心脏,以200 mL生理盐水灌注后用4%多聚甲醛灌注固定。常规石蜡包埋,冠状切片(厚度为2 mm)。石蜡切片常规脱蜡止水,pH=6.0的柠檬酸修复液进行抗原修复;磷酸盐缓冲液(phosphate buffered saline, PBS)漂洗3次,每次6 min;加入0.3% H2O2溶液封闭内源性过氧化酶15 min;PBS漂洗3次,每次6 min;加入驴血清封闭1 h后甩去血清分别加入兔抗SIRT3(1 ∶500,Abcam,美国)和 小鼠抗LC3(1 ∶500,Sigma,美国)抗体,在4 ℃冰箱中赋予过夜,洗脱。滴加荧光二抗(Invitrogen,1 ∶2 000,山羊抗兔和山羊抗小鼠)孵育3 h,洗去二抗并孵育4, 6-二脒基-2-苯基吲哚(4', 6-Diamidino-2-Phenylindole, Dihydrochloride, DAPI)染色液10 min,在荧光显微镜下观察分析。观察采用单盲、双人分析单个低倍镜下(×20)阳性细胞个数(取10个切片×10个视野的平均数)。
四、皮层区域蛋白样品制备和蛋白印迹检测
提取皮层核心缺血区蛋白样品,蛋白裂解液冰上裂解15 min后,4 ℃ 12 000 r/m离心30 min。BCA蛋白定量后-20 ℃保存待用。分别取60 μg各组蛋白样品进行蛋白电泳(10% SDS-PAGE)和转模(NC膜)。与LC3(1 ∶2 000)、SIRT3(1 ∶400)、β-Actin(兔抗,1 ∶2 000,Abcam,USA)抗体结合过夜,然后与辣根过氧化物酶标记的二抗(1 ∶20 000)结合孵育1.5 h,显色压片后使用Gel-Pro analyzer软件进行图像分析。
五、统计分析
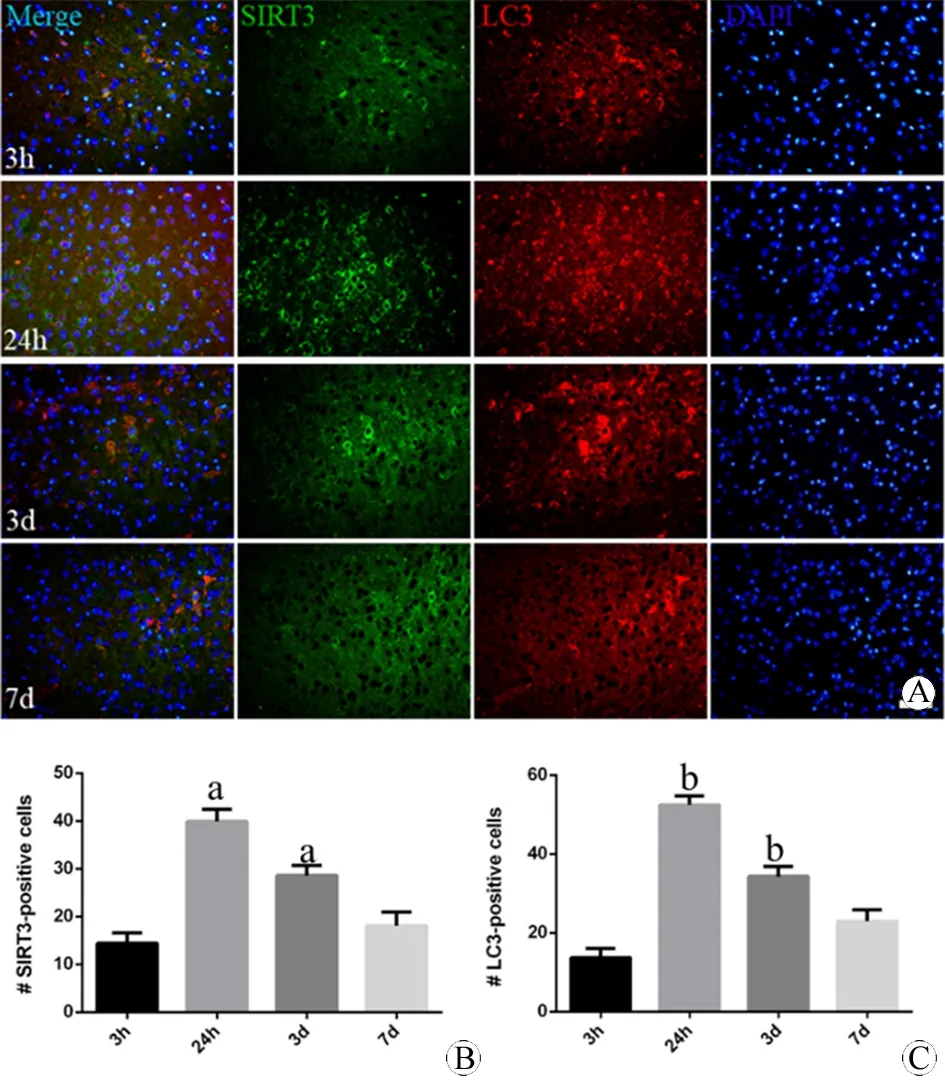
图1 不同时间点小鼠皮层损伤区域SIRT3和LC3表达的免疫荧光变化 (DAPI, ×200)
Fig 1 The expression of SIRT3 and LC3 in the damage part of cortex of mouse at different times using immunofluorescence (DAPI, ×200)
A: The expression of SIRT3 (green) and LC3 (red) at 3 h, 24 h, 3 d and 7 d; B: The quantification of the expression of SIRT3; C: The quantification of the expression of LC3.
aP<0.05,vs3 h (SIRT3);bP<0.05,vs3 h (LC3).
N=3 per group. Scale bar=40 μm.
结 果
一、间接免疫荧光
建立小鼠模型后取再灌注3 h、24 h、3 d、7 d四个时间点,观察小鼠急性期大脑皮层损伤核心区域SIRT3和LC3的表达,如图1所示。SIRT3表达在损伤过程中呈现动态上调,抛物线状变化。再灌注24 h达到高峰(P<0.01vs3 h),3 d时缓慢下降,但仍较3 h表达较高(P<0.05vs3 h)。LC3亦呈现相似改变,于24 h达到高峰(P<0.01vs3 h),3 d时缓慢下降,但仍较3 h表达较高(P<0.05vs3 h)。另外,两者表达存在共定位现象。
二、蛋白印迹
收集4组蛋白样品后,同样观察缺血再灌注后3 h、24 h、3 d、7 d四个时间点的SIRT3和LC3的蛋白表达变化趋势,如图2所示。SIRT3表达在损伤过程中呈现动态上调,抛物线状变化。再灌注24 h达到高峰(P<0.01vs3 h),3 d时缓慢下降,但仍较3 h表达较高(P<0.05vs3 h)。LC3亦呈现相似改变,于24 h达到高峰(P<0.01vs3 h)。
三、Spearman相关性分析
取小鼠缺血再灌注3 h,24 h,3 d,7 d四个时间点的SIRT3(此为参数x1)和LC3(此为参数y1)阳性细胞数,采用Spearman相关性分析,得出r=0.6887,P=0.0065<0.01。另外,取3 h、24 h、3 d、7 d四个时间点的SIRT3(此为参数x2)和LC3(此为参数y2)的相对灰度值,再次采用Spearman相关性分析,得出r=0.7039,P=0.0050<0.01,再次显示两者具有显著正相关。由此得出两者表达具有显著相关性。
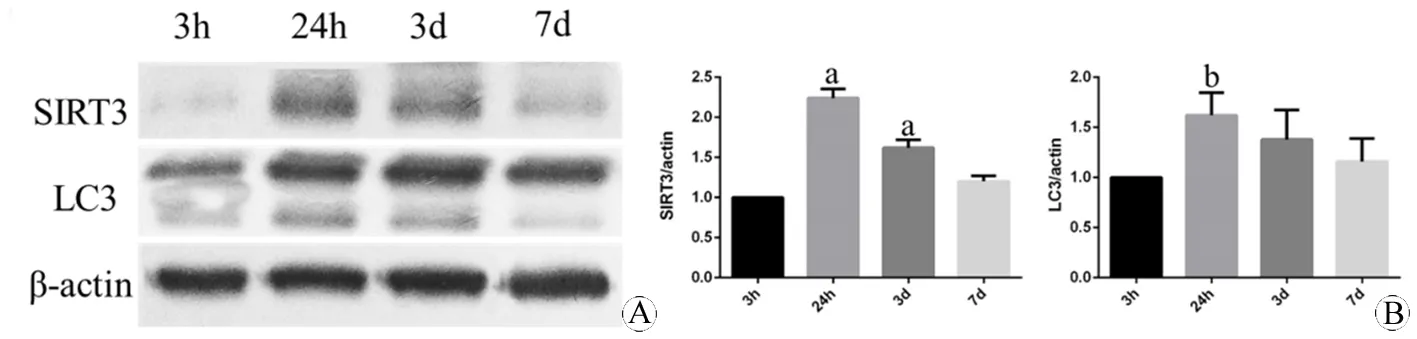
图2 不同时间点小鼠皮层损伤区域SIRT3和LC3表达的蛋白印迹分析
Fig 2 The protein expression of SIRT3 and LC3 in the core damage part of cortex of mouse at different time points using Western blotting
A: The expression of SIRT3 and LC3 at 3 h, 24 h, 3 d, 7 d; B: The quantification of the expression.
aP<0.05,vs3 h (SIRT3);bP<0.05,vs3 h (LC3).
N=3 per group.
讨论
缺血性脑卒中占全部脑卒中病例的75%以上,幸存者往往伴有不同程度的神经功能障碍,给个人及社会带来沉重的负担,近30年来,IS后脑缺血损伤机制及脑保护作用研究成为世界性的难点和热点问题[9]。而IS后皮层缺血区域细胞不仅发生凋亡与坏死,还可发生自噬[10]。已有研究证实,原代培养的神经元损伤模型中,伤后1 h、3 h、6 h、12 h 和24 h 作为观察时间点,自噬相关分子LC3Ⅱ和Beclin-1的表达随时间变化逐渐增高[2]。而在早期氧糖剥夺/再灌注应激情况下,细胞会启动自噬机制来清除受损线粒体,这时自噬足以避免大量凋亡因子释放进入胞质,对细胞起到一定保护作用[2,11]。
作为自噬的标志分子,LC3Ⅱ的表达的高低与发生自噬的程度成正比[6],本研究蛋白印迹结果表明,LC3Ⅱ和SIRT3在缺血损伤后表达量逐渐上升,自噬被激活,再灌注24 h达到峰值后随着时间的延长有所下降,但整体仍高于正常对照组。显然SIRT3在自噬表达最高时其表达量亦最高,并且两者有共定位表达。
线粒体自噬是神经元自噬的主要形式,在神经元转归中扮演重要角色。而目前研究发现,SIRT3可以通过多种途径调控自噬水平[6,12],对细胞产生保护作用:①SIRT3可通过去乙酰化叉头蛋白O3A (folk head protein 3a, FOXO3a) 进而上调众多抗氧化酶,包括过氧化氢酶(catalase, CAT)和锰超氧化物歧化酶(Mn-superoxide dismutase, MnSOD)等,增加ROS 清除率[13-14];也可通过激活异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH2)和谷氨酸脱氢酶(glutamate dehydrogenase, GDH),促进还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)生成,NADPH 最终通过还原谷型胱甘肽清除活性氧类成分 (reactive oxygen species, ROS);②SIRT3 可去乙酰化线粒体电子传递链中的组分,包括复合辅Ⅰ(NADH脱氢酶)、复合物Ⅱ(琥珀酸脱氢酶)及复合物Ⅲ的成分,从而调节ROS 的产生[15]。进一步,在原代培养大鼠皮层神经元中SIRT3通过抑制线粒体钙摄取和促进线粒体生物发生发挥神经保护作用,SIRT3增加皮层神经元对氧化性急性损伤的抵抗能力[13]。总而言之,本研究说明MCAO急性期皮层区域SIRT3对自噬水平可能的诱导作用,而产生的对神经元的保护。
目前本研究发现:①小鼠脑缺血再灌注损伤模型中,皮层区域SIRT3表达先增高后降低,呈抛物线状;②自噬相关蛋白LC3-2的表达与SIRT3呈现相关性(Spearman相关性分析,P<0.05),均在24 h呈现高峰;③免疫荧光发现LC3-2和Sirt3有共定位表达。而SIRT3和LC3之间的如何联系尚未可知。下一步实验将调控SIRT3表达(过表达或抑制)进一步证实LC3以及细胞凋亡的相应变化,阐明两者的潜在的联系和分子信号通路。