电针对Beagle犬展神经损伤后小胶质细胞活化状态的影响
王蕾 张毅 王旭东 叶子
(南通大学第二附属医院:1急诊中心; 2神经外科; 3中医科,江苏 南通 226001)
颅内感染、肿瘤、颅脑外伤、眼部病变等常出现导致展神经损伤,损伤后局部微环境代谢复杂,而神经细胞高度分化、再生能力低,影响了患者的生活质量[1]。迄今尚缺乏促进其功能修复的有效措施,显微外科手术修复不尽满意,相关的基础研究目前也存在异议。针对病因治疗外,电针刺激是一种较好的康复治疗方法[2]。小胶质细胞是中枢神经系统的免疫吞噬细胞,在伤害性应激状态下迅速反应,释放大量的细胞因子,而研究得出炎症反应是影响神经损伤后功能恢复的关键[3]。小胶质细胞在不同的微环境中可以出现不同的细胞表型:M1型与M2型。在神经细胞损伤后可激化为M1型,诱导免疫炎症反应,但过多的炎症反应因子同时也会导致正常细胞的损伤及凋亡[4]。M2型小胶质细胞主要抑制机体过度的免疫反应,促进炎症修复,保证神经修复与再生[5]。故抑制炎症刺激对神经细胞的过度打击,调控小胶质细胞M1型与M2型动态平衡成为神经功能保护作用机制的焦点。基于以上背景,本实验以电针刺激为核心,利用小胶质细胞为切入点,采用Western Blot技术明确展神经中M1、M2型标志分子的表达,进一步探讨电针刺激展神经修复的机制。
材料与方法
一、实验对象
选用健康Beagle犬(6月龄,n=36),雌雄各半,体重(15.0±0.5) kg,由南通大学医学院动物实验中心提供,许可证号SCXK(苏):2008-0010。实验动物饲养于单独的犬房,可自由走动,保证适宜的温度进行饲养,饲养2 w进行实验。随机分为3组,每组12只:假手术组(A)、损伤组(B)和电针处理组(C)。实验动物治疗4 w取材进行Western Blot检测展神经小胶质细胞M1、M2型标志分子的表达水平。动物的处理遵守国家健康协会制定的实验动物使用指南。实验分组:假手术组(A):Beagle犬麻醉后,仅暴露分离展神经,术中不进行神经损伤处理,缝合切口皮肤,在电针刺激时进行束缚,连续2 w,每次持续15 min。损伤组(B):Beagle犬麻醉后,制作展神经损伤模型,在电针刺激时进行束缚,连续2 w,每次持续15 min。电针处理组(C):12只Beagle犬展神经损伤模型建立后进行电针刺激,每次持续15 min连续2 w。参数设置:刺激脉冲频率 5 Hz,时程 0.1 ms,刺激强度 1.0 V。
二、实验方法
1.展神经损伤动物模型制作:术前12 h禁食后注射3%戊巴比妥钠(1 mL/kg)静脉麻醉。将Beagle犬置于手术台进行侧卧位,固定试验动物头颅,耳缘牵向尾侧固定,麻醉充分开颅后皮瓣翻向外侧切除大脑半球,保留中脑组织,经颞肌附着处纵向切开。经颞底入路开颅,骨窗尽量靠近颅底,扩大骨窗范围从眶后到颧弓前,并沿颞骨窗下缘切开硬脑膜沿斜坡向上外方做一创口约3.5 cm×3.5 cm。经岩颞韧带下方进入海绵窦充分暴露深部的展神经。用有齿止血钳挤压夹闭展神经30 s后直视钳压处组织菲薄,切断展神经轴突但维持神经鞘膜完性,以犬眼球呈内斜视表明造模成功。
2.电针刺激:C组展神经损伤模型制完成后将2个电极(5F导管)分别置入神经损伤处两侧。向外方牵拉上下眼睑,在睑板与球结膜交界处充分暴露外直肌,将电极均插入外直肌,植入深度约3.0 mm,间距约4.0 mm,缝合切口固定电极。游离端自眼眶后下方引出固定,形成回路,术后连续2 w给予电针刺激,每次持续15 min。参数设置:脉冲频率为5 Hz,时程 0.1 ms,强度1.0 V。A及B组仅束缚,不刺激。
3.Western Blot检测小胶质细胞的M1、M2分子表达:取上述Beagle犬各分组每组12只,用10%水合氯醛进行深度麻醉后,迅速用手术剪剪下展神经节段,在低温无菌冰盘上进行操作,分离出少许神经组织置于1 mL匀浆器球状部位,尽量充分剪碎组织。加入含苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)的400 μL单去污剂裂解液裂进行匀浆。裂解30 min后在4 ℃下12 000 rpm离心10 min,取上清分装置于-20 ℃保存。提取小胶质细胞的总蛋白,通过NanoDrop定量,取40 μg蛋白进行SDS-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel, SDS-PAGE)电泳,将蛋白以恒定电流30 mA,电转90 min转移到聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,TBST洗膜3次,然后5%TBST脱脂奶粉的以60 rpm的速度封闭60 min,加入一抗4 ℃冰箱孵育过夜(一抗的浓度:白细胞介素1β(interleukin 1β,IL-1β)为1 ∶200,诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)为1 ∶3 000,精氨酸(arginase)为1 ∶1 000,脑源性神经营养因子(brain derived neurotrophic factor, BDNF)为1 ∶200,一抗孵育完成后TBST漂洗3次,再移至新杂交袋中,与荧光标记二抗(1 ∶20 000)常温孵育60 min,TBST充分清洗后以增强化学发光法(enhanced chemiluminescence, ECL)显影并拍照,进行条带灰度分析。
三、统计分析
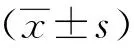
结 果
一、Beagle犬展神经电刺激损伤模型建立
Beagle犬展神经暴露清楚(箭头所示),术后均生存良好,无感染、角膜溃疡等并发症,展神经损伤后,犬眼球呈内斜视(图1、2)。
二、Western Blot 结果
将三组实验动物治疗4 w取材进行Western Blot检测展神经小胶质细胞M1、M2型标志分子的表达水平。
B组的iNOS的表达较A组比较增加(P<0.05),C组的iNOS与A组无统计学差异(P>0.05);其中与B组相比,C组iNOS降低(P<0.05);同时B、C组的IL-1β的表达较A组比较均增加(P<0.05),其中与B组相比,C组IL-1β降低(P<0.05)。而与A组相比,B、C组Arginase表达均增加(P<0.05),其中C组的Arginase较B组表达增加(P<0.05),BDNF在B、C组的表达均增加(P<0.05),C组的BDNF较B组表达增加(图3)。

图1 Beagle犬展神经
Fig 1 Nerve of Beagle dog model
图2 展神经损伤后眼球位置
Fig 2 The position of the eyeball after nerve injury
图3 电针刺激对小胶质细胞M1、M2型标志分子表达
Fig 3 Expression of M1 and M2 marker molecules on microglia stimulated by electroacupuncture
表1 电针刺激对小胶质细胞M1、M2型标志分子表达比较
Tab 1 Comparison of electroacupuncture stimulation on expression of M1 and M2 type markers in microglia

GroupiNOSIL-1βArginaseBDNF Group A0.11±0.930.02±1.290.25±1.140.05±1.08 Group B0.31±0.89a0.09±1.15a0.38±1.03a0.49±0.78a Group C0.14±1.01b0.05±0.91ab0.67±0.89ab0.82±0.68ab
Note:aP<0.05,vsGroup A;bP<0.05,vsGroup B.
讨论
外展神经损伤病因较为复杂,由多种因素导致支配神经受损引起眼球运动受限。目前的显微外科手术治疗展神经损伤的临床疗效有了较高的进步,但对于严重神经损伤的功能恢复仍不是满意的解决方案。而针刺的基础研究及临床试验均发现,电针刺激神经损伤有效地提高受损神经功能恢复率[6]。通过减轻损伤细胞炎症反应、抑制神经细胞凋亡、改善代谢微环境,调节炎性因子释放,从而促进神经再生、阻断炎症级联反应[7]。目前较多学者在针刺治疗周围神经损伤的研究主要集中在面神经和坐骨神经损伤修复,在动眼神经损伤修复亦有相关研究。同时利用电针刺激外展神经麻痹亦取得了较好的疗效,但关于针刺促进外展神经修复机制研究较少。
当内环境细胞因子水平的改变、侵染病原体的类型、刺激的强度与时间等应激状态出现,小胶质细胞最先启动免疫反应。通过产生一系列的免疫受体:①Toll样受体(toll like receptors, TLRs)能够使缺血性损伤恶化,但是缺血性损伤前TLRs短暂激活却能降低继发损伤[8];②核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domains, NODs)、NOD样受体和多种清道夫受体等,对于神经元凋亡及认知功能产生影响,目前主要研究于阿尔茨海默病(Alzheimer disease, AD),同时产生多种炎性因子TNF-α、IL-6、IL-1β、IFN-γ和多种趋化因子[9],表现为M1型。有研究表明M1型小胶质细胞关键性标记物为iNOS。iNOS能够利用精氨酸产生NO,与过氧化物反应形成过氧亚硝基阴离子,产生细胞毒性[10]。在消灭病原体的同时,还通过氧化应激反应释放氮基团与活性氧自由基对神经元起到强烈的神经毒性作用[11]。而IL-1β与IL-1受体结合后,激活NF-κB通路促进炎症发生[12]。M2型小胶质细胞能诱发一系列的抗氧化反应,上调血红素氧合酶-1(heme oxygenase-1, HO-1)表达,抑制缺血后活性氧产生[13]。M2型小胶质细胞还能够通过IL-10发挥负反馈作用,抑制促炎因子IL-1β、IL-6和TNF-α产生,上调神经生长因子(nerve growth factor, NGF)表达,抑制Caspase-3活性,减少神经元死亡[14]。新生神经元的存活易受微环境的影响。小胶质细胞能够通过P2X4R释放BDNF,促进新生神经元存活[15]。Arginase和Ym1能预防细胞外基质降解[16]。M2型小胶质细胞能够去除异常的突触,促进功能性突触形成而发挥神经保护作用[17]。
我们课题组在前期研究中已经成功建立Beagle犬展神经损伤的动物模型,通过颞底入路,术后试验动物生存较满意,无严重感染、癫痫等危重并发症,除展神经损伤所致的眼球运动障碍外,未观察到合并其它神经功能障碍表现[18]。建模成功后用电针刺激展神经,术后4 w开始Beagle犬的瞳孔中心至外眦内侧缘距离明显缩小,外直肌功能开始恢复,认为电针刺激可以明显促进损伤的展神经恢复[19],我们猜测4 w是展神经小胶质细胞从M1型转化为M2型进行活化的关键时刻。通过Western Blot检测,我们发现C组M1型标志分子iNOS和IL-1β的表达较B组显著降低,表明电针刺激能够抑制小胶质细胞活化为M1型。而C组Arginase和BDNF表达较B组增多,电针刺激能够显著升高M2型转化。
综上所述,我们的研究从切断展神经轴突作为损伤因素,通过观察电针刺激后其对小胶质细胞表型的影响。但是试验中我们保持神经鞘膜完性,保留了神经电活动的传导连续性,而小胶质细胞的活化状态是受多种因素综合影响的,包括应激因素的种类、程度、时间等,包括活化过程依赖的细胞种类,接受神经元损伤程度的信号程度等,值得我们继续深入研究。