甲状旁腺切除联合自体移植对尿毒症继发性甲状旁腺功能亢进患者左心室肥厚及血清Fetuin-A的影响*
张曼丽,李卫东
(河北省沧州市人民医院 甲状腺乳腺外科,河北 沧州 061000)
继发性甲状旁腺功能亢进(secondary hyperparathyroidism, SHPT)是一种尿毒症常见并发症,病因是矿物质和骨代谢异常,可导致心血管钙化。临床超过75%的尿毒症患者左心室肥厚[1],血管钙化与左心室肥厚会促进尿毒症相关心血管疾病。胎球蛋白A(Fetuin-A)参与骨代谢,其水平与心脏瓣膜钙化相关[2];同时有文献报道炎症水平与心脏瓣膜钙化相关[3]。(chronic kidney disease-mineral and bone disorder, CKD-MBD)指南提出:对药物控制无效的患者建议进行甲状旁腺切除联合自体移植(tPTX+AT)术。本文的目的是研究tPTX+AT对SHPT尿毒症患者的左心室肥厚、炎症水平及血清胎球蛋白A的影响,旨在为临床治疗提供依据。
1 资料与方法
1.1 一般资料
选取2012年1月—2016年1月在沧州市人民医院接受长期透析的74例合并SHPT的尿毒症患者作为本研究对象。按患者是否接受手术分为对照组和观察组,每组37例。本研究经医院伦理委员会批准。
1.2 纳排标准
1.2.1 纳入标准 ①所有患者的临床症状、生化指标符合SHPT诊断标准[4],结合影像学确诊为SHPT;②甲状旁腺激素(immunoreactive parathyroid hormone,iPTH)超过600 pg/ml;③经过超声证实患者存在不止1个甲状旁腺增大,且至少有1个体积超过0.5 cm3;④患者血液透析治疗>3个月,每周透析时间为12 h;⑤持续性高钙(>2.37 mmol/L)、高磷血(>1.78 mmol/L);⑥已获得患者知情同意。
1.2.2 排除标准 ①排除严重心脏功能障碍的患者;②排除患有恶性肿瘤患者;③排除凝血功能异常的患者;④排除严重肝功能障碍疾病患者;⑤排除严重营养不良患者。
1.3 方法
所有患者进行常规血液透析治疗,并根据慢性肾脏疾病实践(kidney disease quality initiative, KDQI)指南,限制患者的磷摄入,应用磷结合剂,给予活性维生素D治疗。观察组患者在此基础进行tPTX+AT术,具体如下:手术前对患者进行全身麻酔,并在患者的颈部正中线储物切开颈前肌群,使甲状腺充分暴露,探查喉返神经,并通过影像辅助检查患者的甲状旁腺并将其完全切除;在切除后取其中较小的腺体,切碎(约1 mm×1 mm×1 mm),取10~30枚碎片移植与非动-静脉内瘘的前壁肌肉中。术后对患者生命体征进行严密监视,并给与静脉补钙。对照组患者未进行手术,当血钙浓度保持在2.37~2.54 mmol/L范围内时可以酌情减少钙的磷结合剂用量,当患者血磷浓度保持在范围1.78~1.94 mmol/L范围内时增加进行碳酸钙空腹口服(Ca:1~2 g/d)。对两组患者进行6个月随访。
1.4 观察指标
1.4.1 常规生化指标检测 分别于治疗前和随访6个月时,采取透析前的上肢静脉血,测量两组患者的iPTH、血清钙浓度、血清磷浓度;其中iPTH采用自动免疫化学发光分析仪(瑞士罗氏公司)测定,血清钙、磷浓度采用全自动生化检测仪(日本日立公司)检测,并计算钙磷乘积。
1.4.2 超声心动图检测 分别于治疗前和随访6个月时对两组患者进行超声心动图检测,仪器使用飞利浦彩色多普勒超声仪,探头频率设置为2.5 MHz,分别测量以下指标:舒张末期室间隔厚度(interventricular septum thickness, IVST)、左心室后壁厚度(left ventricular posterior wall thickness, LVPWT)、左心室射血分数(left ventricular ejection fraction, LVEF);测量患者的身高、体重,计算体表面积=[0.0061×身高+0.0128×体重]×0.1529,并根据Devereu公式计算左心室重量指数(left ventricular mass index, LVMI),LVMI=[(LVED+IVST+LVPWT)3-LVED3-13.6]/体表面积 ;并以男性 LVMI>125 g/m2、女性 LVMI>110 g/m2判定为左心室肥厚。同时观察患者心脏瓣膜钙化情况,以只要有1个及以上瓣膜的回声超过1mm判定为瓣膜钙化,计算钙化率,瓣膜钙化率=钙化的瓣膜数量/总数量。
1.4.3 血清Fetuin-A及炎症因子检测 分别于治疗前和随访6个月时于透析前空腹采集外周静脉血5 ml,离心取上清,采用ELISA法测定血清胎球蛋白、白细胞介素6(IL-6)以及超敏C-反应蛋白(hs-CRP),试剂盒由上海超研生物科技有限公司提供,具体操作严格按照试剂盒说明书进行。
1.5 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,比较采用独立样本t检验或配对t检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者基本资料
两组患者各项基本资料比较差异均无统计学意义(P>0.05),具有可比性。见表1、2。
2.2 两组患者常规生化指标检测结果比较
治疗前,两组患者的血清钙、血清磷、钙磷乘积以及iPTH水平经t检验差异无统计学意义(P>0.05);随访6个月时,对照组差异无统计学意义(P>0.05),上述指标无变化;观察组上述指标与6个月前比较,经t检验差异有统计学意义(P<0.05),其水平均降低。见表3。
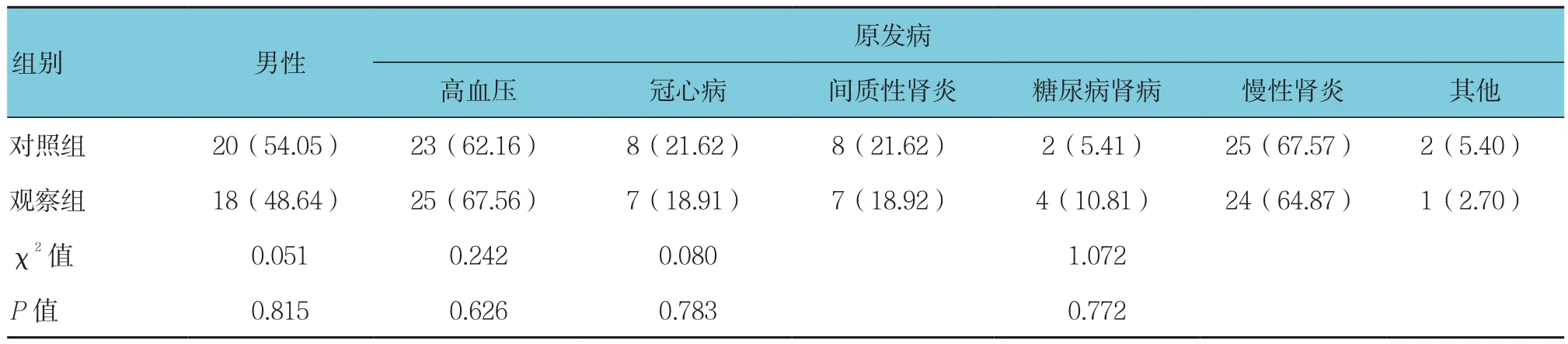
表1 两组患者基本资料的比较 [n =37,例(%)]
表2 两组患者基本资料的比较 (n =37,±s)
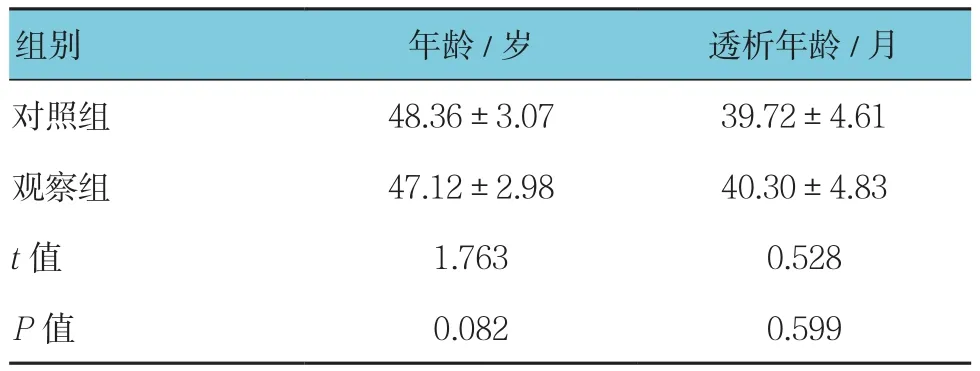
表2 两组患者基本资料的比较 (n =37,±s)
组别 年龄/岁 透析年龄/月对照组 48.36±3.07 39.72±4.61观察组 47.12±2.98 40.30±4.83 t值 1.763 0.528 P值 0.082 0.599
2.3 两组超声心动图检测结果比较
治疗前与随访6个月比较,对照组的IVST、LVMI、LVPWT差异无统计学意义(P>0.05),但钙化率差异有统计学意义(P<0.05),对照组钙化率升高。治疗前与随访6个月比较,除钙化率外,观察组各指标差异有统计学意义(P<0.05),IVST、LVMI、LVPWT均下降,LVEF升高。见表4、5。
表3 两组患者常规生化指标变化 (n =37,±s)
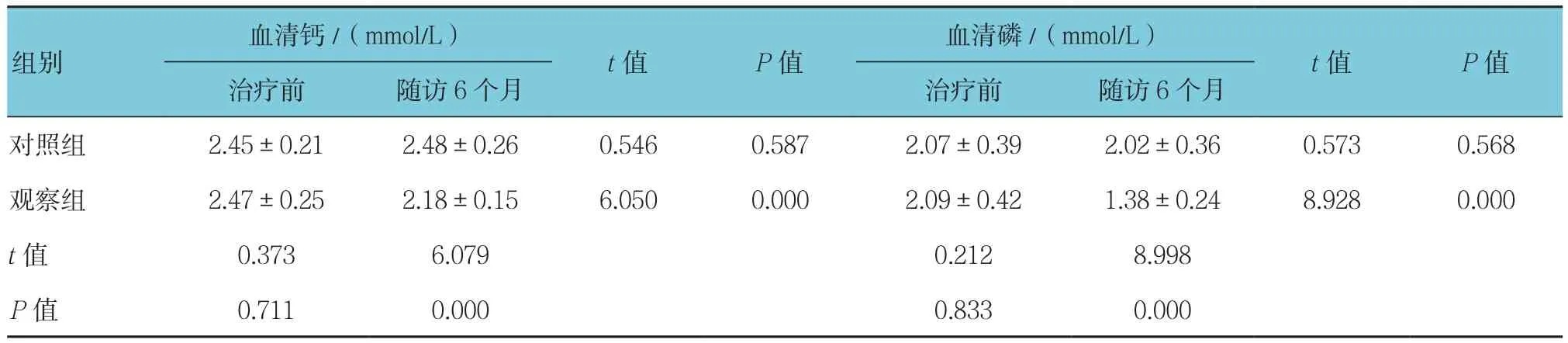
表3 两组患者常规生化指标变化 (n =37,±s)
血清钙/(mmol/L) 血清磷/(mmol/L)组别t值 P值治疗前 随访6个月 治疗前 随访6个月t值 P值对照组 2.45±0.21 2.48±0.26 0.546 0.587 2.07±0.39 2.02±0.36 0.573 0.568观察组 2.47±0.25 2.18±0.15 6.050 0.000 2.09±0.42 1.38±0.24 8.928 0.000 t值 0.373 6.079 0.212 8.998 P值 0.711 0.000 0.833 0.000
2.4 两组血清Fetuin-A及炎症因子比较
治疗前与随访6个月时比较,对照组胎球蛋白A、hs-CRP、IL-6差异无统计学意义(P>0.05);治疗前与随访6个月比较,观察组各项指标差异有统计学意义(P<0.05),胎球蛋白A升高,hs-CRP和IL-6水平下降。见表6。
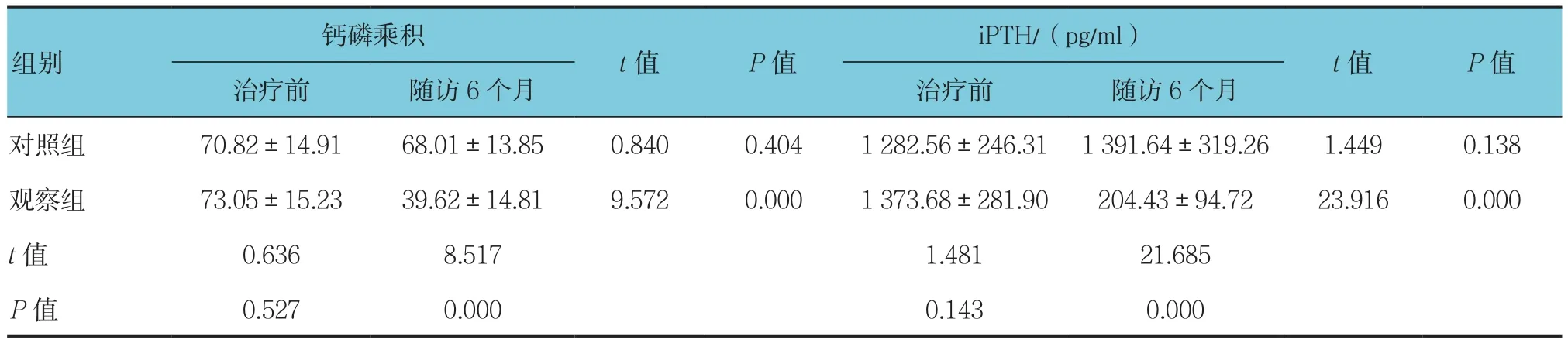
续表3
表4 两组患者超声心动图结果比较 (n =37,±s)
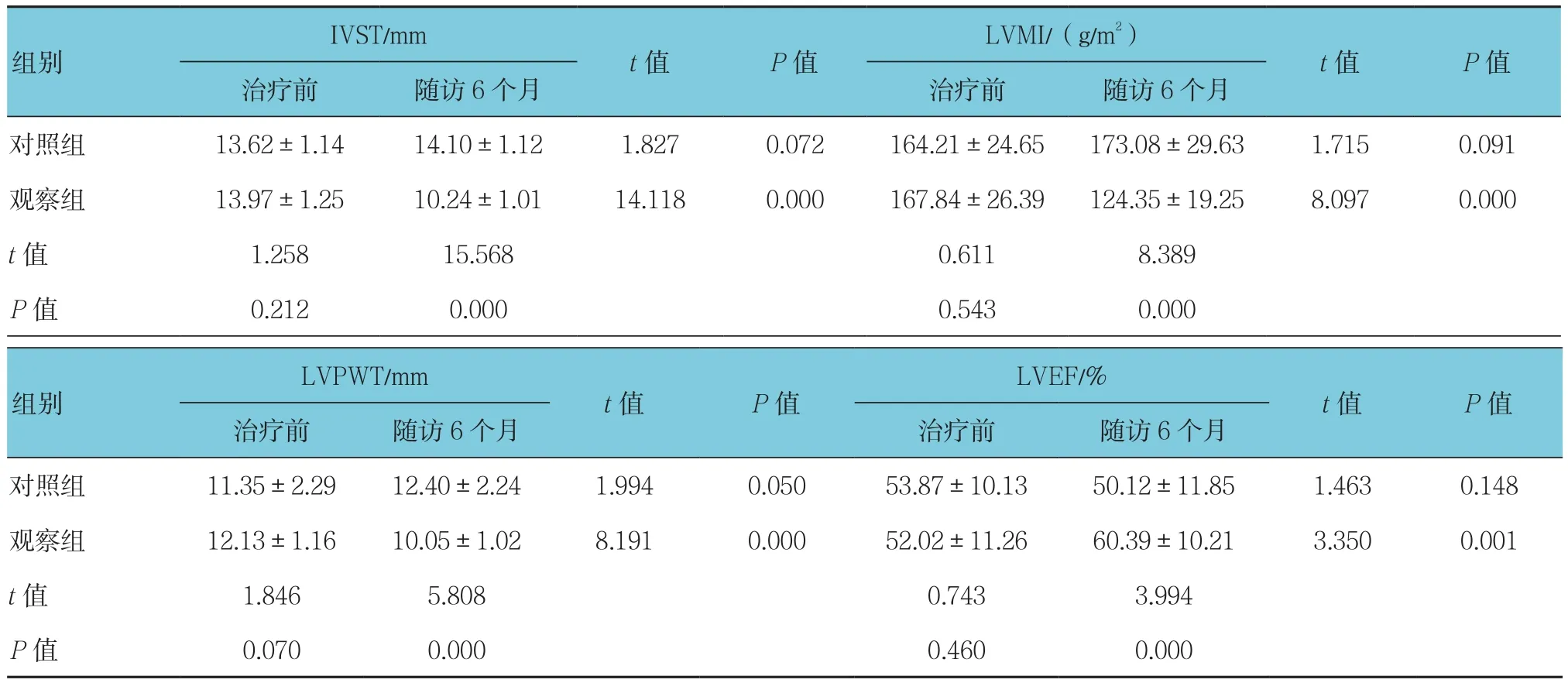
表4 两组患者超声心动图结果比较 (n =37,±s)
IVST/mm LVMI/(g/m2)组别t值 P值治疗前 随访6个月 治疗前 随访6个月t值 P值对照组 13.62±1.14 14.10±1.12 1.827 0.072 164.21±24.65 173.08±29.63 1.715 0.091观察组 13.97±1.25 10.24±1.01 14.118 0.000 167.84±26.39 124.35±19.25 8.097 0.000 t值 1.258 15.568 0.611 8.389 P值 0.212 0.000 0.543 0.000 LVPWT/mm LVEF/%t值 P值治疗前 随访6个月 治疗前 随访6个月对照组 11.35±2.29 12.40±2.24 1.994 0.050 53.87±10.13 50.12±11.85 1.463 0.148观察组 12.13±1.16 10.05±1.02 8.191 0.000 52.02±11.26 60.39±10.21 3.350 0.001 t值 1.846 5.808 0.743 3.994 P值 0.070 0.000 0.460 0.000组别t值 P值
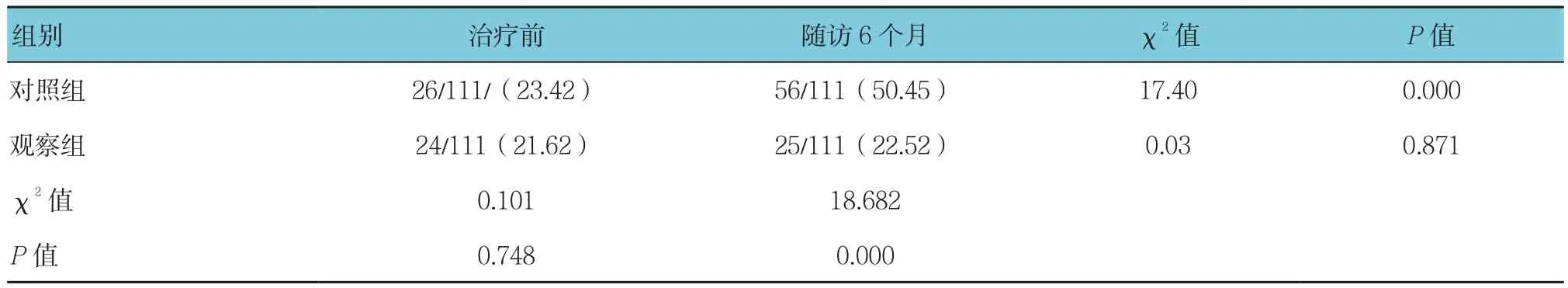
表5 两组患者钙化率比例 例(%)
表6 两组患者血清Fetuin-A及炎症因子比较 (n =37,±s)
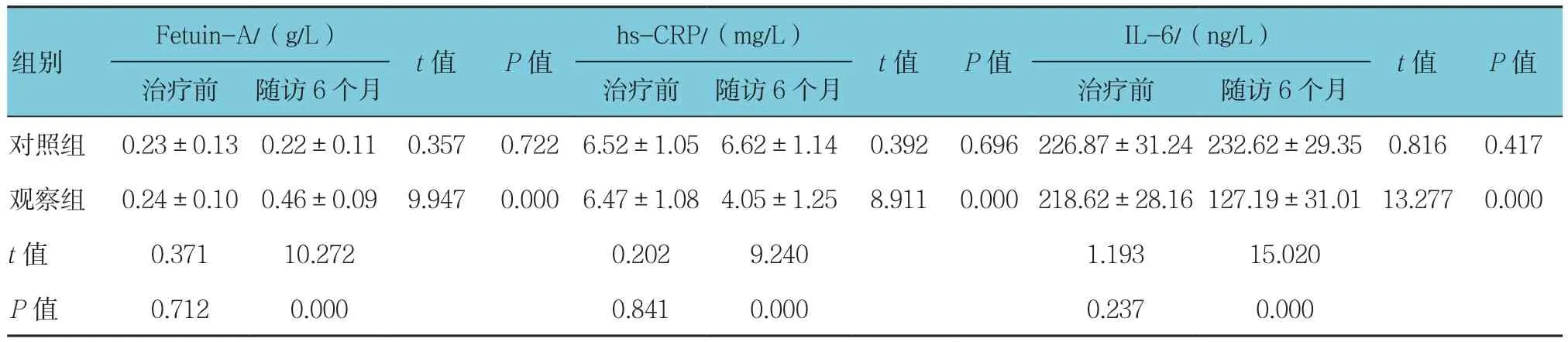
表6 两组患者血清Fetuin-A及炎症因子比较 (n =37,±s)
Fetuin-A/(g/L)hs-CRP/(mg/L)IL-6/(ng/L)组别t值 P值治疗前 随访6个月 治疗前 随访6个月 治疗前 随访6个月t值 P值t值 P值对照组 0.23±0.13 0.22±0.11 0.357 0.722 6.52±1.05 6.62±1.14 0.392 0.696 226.87±31.24 232.62±29.35 0.816 0.417观察组 0.24±0.10 0.46±0.09 9.947 0.000 6.47±1.08 4.05±1.25 8.911 0.000 218.62±28.16 127.19±31.01 13.277 0.000 t值 0.371 10.272 0.202 9.240 1.193 15.020 P值 0.712 0.000 0.841 0.000 0.237 0.000
3 讨论
SHPT是尿毒症患者的一个常见并发症,患者甲状旁腺的增生会持续分泌高浓度PTH,临床表现主要为持续性的高钙血症、高磷血症,高钙磷乘积,这会导致患者发生骨代谢异常,出现心血管钙化以及心脏结构变化,增高死亡风险。临床研究表明,左心室肥厚是SHPT尿毒症患者心脏结构改变中最为常见的一种。同时有文献表明,甲状旁腺激素升高、血管钙化是引起左心室肥厚的重要因素[5]。
严重的SHPT的临床治疗手段主要为甲状旁腺次全切、tPTX和tPTX+AT,有研究报道tPTX+AT的有效率最高,治疗后复发的概率低[6]。本研究采用tPTX+AT治疗合并SHPT的尿毒症患者,结果发现于治疗前比较,随访6个月时观察组血清钙、血清磷、钙磷乘积、iPTH均下降,对照组无变化。说明tPTX+AT术能有效改善患者的高钙血症、高磷血症,降低钙磷乘积,改善临床症状。分析认为尿毒症患者由于长期的低血钙、高血磷刺激甲状旁腺过度分泌PTH作为慢性代偿以提高血钙、降低血磷浓度,通过tPTX+AT术能够纠正这种PTH过度分泌,调整患者的iPTH和血钙、血磷浓度[7]。
合并SHPT的尿毒症患者由于iPTH含量升高、钙磷代谢紊乱等都会导致骨代谢异常、左心室结构和功能变化,其中左心室肥厚和功能变化是尿毒症患者发生心血管疾病并且死亡的重要预测因素[8]。血钙浓度升高会导致血管壁发生钙沉淀,引起心脏瓣膜钙化;钙磷代谢紊乱与心肌重构密切相关,血磷浓度过高是左心室肥厚的危险因素[9]。IVST、LVMI和LVWT是临床评价左心室肥厚的常用指标;LVEF是评价心脏收缩功能障碍的重要指标,同时也是评估心力衰竭的重要指标。心脏瓣膜钙化是一个不可逆的过程,会导致瓣膜狭窄或者关闭不全,加重尿毒症患者的心肌重构,加重心力衰竭。本研究术后6个月随访时,观察组IVST、LVMI、LVPWT均下降,LVEF升高,心脏瓣膜钙化率未发生变化;而对照组IVST、LVMI、LVPWT略有升高,LVEF略有下降,差异无统计学意义,心脏瓣膜钙化率升高。说明tPTX+AT术能有效降低合并SHPT尿毒症患者的IVST、LVMI和LVPWT,提高LVEF,延缓心脏瓣膜钙化。分析认为,钙磷代谢异常会导致成骨细胞和破骨细胞代谢失衡,引起心脏瓣膜钙化;同时由于血磷浓度升高会加速成骨细胞酶的表达,加速血管钙化;有文献报道钙磷乘积>55是导致心脏瓣膜钙化的危险因素,而心脏瓣膜钙化降低又会进一步加重心室肥[10]。除此之外,iPTH浓度过高也会影响患者的心肌细胞的代谢功能,加重心肌纤维化,导致心肌肥厚[11]。心脏瓣膜钙化和心肌肥厚都会增加心脏负荷,使心肌僵硬,心室壁的顺应性降低,左心室收缩功能下降,心搏出量减少,LVEF减少[12]。tPTX+AT术能够通过手术切除调整iPTH的浓度,进而调节血钙和血磷浓度来阻止心脏瓣膜进一步钙化,减轻尿毒症患者的心室肥厚症状,提高患者的心功能。
Fetuin-A由肝脏细胞分泌,通过血液循环存在于各种细胞的细胞液中。其分子结构上拥有多个钙离子的结合位点,N端的氨基酸残基上由拥有磷酸根结合位点。胎球蛋白A与钙离子、磷酸根离子有很高的亲和能力,能与两者形成可溶性的胶状颗粒,具有强大的抑制血钙和血磷沉积作用,是一种重要的钙化抑制蛋白[13]。临床研究已经明确胎球蛋白浓度与心脏瓣膜钙化呈负相关[14]。除了抗钙化外,胎球蛋白A还参与骨代谢调节以及炎症反应等,IL-6和hs-CRP是两种重要的炎症标志物,也是导致尿毒症患者心血管疾病的重要因素[15]。尿毒症患者由于肾功能障碍,无法有效清除体内的炎症因子,常表现为微炎症状态,同时由于水钠潴留会加重心脏负荷,产生氧化应激反应,激活免疫系统,使患者的炎症因子水平升高,IL-6和hs-CRP水平升高。本研究观察组在tPTX+AT术后6个月随访时,血清胎球蛋白浓度升高、IL-6和hs-CRP降低,对照组上述3项指标无变化。说明tPTX+AT术治疗能够有效提高合并SHPT的尿毒症患者的血清球蛋白A浓度,降低炎症因子IL-6和hs-CRP。分析认为,球蛋白A可以直接与钙、磷结合,其可能是通过直接作用于血管钙化、瓣膜钙化来抑制患者的心脏瓣膜钙化加重[16]。有文献报道,IL-6和hs-CRP在心脏瓣膜钙化中有重要作用,可作为心血管钙化的预测因素[17]。同时有学者提出胎球蛋白A反响调节巨噬细胞活性,抑制上述炎症因子的促钙化作用,IL-6和hs-CRP也会影响胎球蛋白A的分泌,在尿毒症患者体内胎球蛋白与IL-6、hs-CRP呈负相关,这3者的共同参与了心脏瓣膜钙化过程[18]。tPTX+AT术可能通过调节血磷血钙浓度上调胎球蛋白A浓度,胎球蛋白A又可以进一步抑制IL-6和hs-CRP浓度,调节尿毒症患者的微炎症状态。
综上所述,tPTX+AT术能有效降低SHPT尿毒症患者的血磷血钙和iPTH浓度,改善临床症状,改善患者的左心室肥厚,延缓心脏瓣膜钙化进展,提高心功能,同时上调Fetuin-A浓度,下调IL-6和hs-CRP浓度。

