火烧对苍山捕食线虫真菌群落结构的影响
周新娟,邓 巍,滕 曼,刘硕然,肖 文,杨晓燕*
(1.大理大学公共卫生学院,云南大理 671000;2.大理大学东喜玛拉雅研究院,云南大理 671003;3.大理大学农学与生物科学学院,云南大理 671003)
捕食线虫真菌是指以营养菌丝特化形成的黏性菌丝、黏性分枝、黏性球、黏性网、非收缩环、收缩环及冠囊体等捕食器官来捕捉线虫的一类真菌,是自然界中线虫种群自然控制的重要因子〔1〕。由于在生防运用上表现出巨大的潜力,这类真菌已受到研究者的广泛关注。捕食线虫真菌作为一种兼性菌,既可营腐生生活,又可主动捕捉线虫来获取营养。在某些干扰因素的影响下,捕食线虫真菌获取营养的方式可能会发生改变。
火是大多数生态系统中独特且重要的环境因子,也是自然界中普遍存在的干扰因素之一。火烧干扰会导致植物群落结构发生变化〔2〕,增加植物群落的物种丰富度和多样性指数〔3〕,火烧发生时燃烧大量的植物凋落物,改变土壤温度、湿度等进而影响土壤的物理和化学性质〔4〕,提高植物根系的生物量〔5〕,而植物根系与土壤微生物共生又能增加植物对土壤养分的吸收,从而影响土壤微生物的种类和数量〔6〕。由于全球变暖及计划烧除等原因使得未来火干扰在生态系统中的作用可能会进一步增强,捕食线虫真菌作为自然界中线虫种群数量的重要平衡因子,必然会受到这一干扰因素直接或间接的影响,但是目前还未见相关的研究报道。故本研究对苍山火烧迹地、近火烧地和非火烧地的捕食线虫真菌资源进行了调查,对比分析不同样地中捕食线虫真菌的种群差异,以初步了解火烧对该类型真菌群落结构的影响。
1 材料与方法
1.1 样品采集采集苍山北部鱼山(25°45′49.80″N,100°07′44.64″E)、中部感通寺(25°39′21.84″N,100°10′57.52″E)和南部江风寺(25°34′48.10″N,100°12′7.56″E)火烧迹地、近火烧地以及苍山中部兰峰(25°40′21.92″N,100°05′19.77″E)非火烧地土壤样品共208份。采集方法:采集时去除表层土壤,取0~20 cm深度的土壤300 g左右,装入自封袋中,详细记录样品信息,所有采集的样品带回实验室后4℃冰箱保存,1周内处理完所有样品。
1.2 培养基采用的培养基主要为玉米琼脂培养基(CMA)和马铃薯葡萄糖琼脂培养基(PDA)〔1〕。
1.3 诱饵线虫的制备线虫的制备分离采用贝尔曼漏斗法〔1〕。
1.4 捕食线虫真菌的分离与鉴定
1.4.1 捕食线虫真菌的分离 采用诱饵平板法,每份土样取 2~3 g〔1〕,均匀成点状撒在直径为 90 mm CMA平板上,土样间留有一定的空隙,并保证样品距培养皿边缘空1 cm左右,这样可以使捕食线虫真菌长至空白处,便于观察且在单孢分离时,可减少污染。每个样品3个重复。在上述的CMA平板中各加入5 000条左右的线虫悬液来诱导捕食线虫真菌孢子的萌发,常温避光培养4~5周。
1.4.2 捕食线虫真菌的捕器诱导 在体视显微镜10~100倍下,利用无菌牙签以无菌操作技术转接捕食线虫真菌单个分生孢子到留有约1 cm×1 cm观察室的直径60 mm CMA平板上,密封后置于26.5℃恒温箱中培养直至菌丝铺满观察室,然后在观察室中加入制备好的线虫悬液200条左右,放置于恒温箱中培养2~4 d,其间需用体视显微镜观察是否产生捕器及捕器类型,并及时记录结果。
1.4.3 捕食线虫真菌的形态学鉴定 采用粘片法,在体视显微镜下黏取分生孢子以及分生孢子梗进行形态观察及大小测定,用透明的胶带粘取捕食线虫真菌的分生孢子及分生孢子梗,置于滴有适量吕氏美兰染液的载玻片上,并盖上盖玻片,制成临时装片,显微镜镜检(40×),确定分生孢子和分生孢子梗的类型,测量分生孢子的大小及分隔数,最后结合捕食器官类型,参照文献〔1〕进行形态鉴定和分类。
1.4.4 捕食线虫真菌的分子生物学鉴定 难以通过形态学鉴定的种,结合分子生物学方法进行鉴定和分类。
通过ITS(internal transcribed spacer region of the ribosomal RNA gene,核糖体RNA上的非转录间隔区)和TUB(β-tubulin gene,微管蛋白编码基因)基因序列同源性分析进行分子生物学鉴定〔7〕。具体方法如下:①采用改良过的CTAB裂解法提取真菌总DNA。②引物合成:ITS基因(预扩增560 bp),引物序列为ITS4:5′-TCCTCCGCTTATTGATATGC-3′,ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′。TUB基因(预扩增570 bp),引物序列为Btla:5′-TTC CCC CGT CTC CAC TTC TTC TTC ATG-3′,Btlb:5′-GAC GAG ATC GTT CAT GTT GAA CTC-3′,引物由上海生物工程有限公司合成。③PCR扩增及检测:94 ℃ 4 min,94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,共35个循环,72℃10 min,琼脂糖凝胶电泳检测PCR扩增产物。④测序及同源性比较:PCR产物直接委托上海铂尚生物技术有限公司进行纯化和序列测定。所测得的DNA序列与GenBank中捕食线虫真菌相应的DNA序列进行同源性比较,同源性达到98%以上的菌株,结合形态学鉴定结果确定种属。
1.4.5 数据处理 物种检出率:OF=(某个种出现的土样数/总的土样数)×100%。
某属出现频率=(某属出现的个体数/所有种的个体数)×100%。
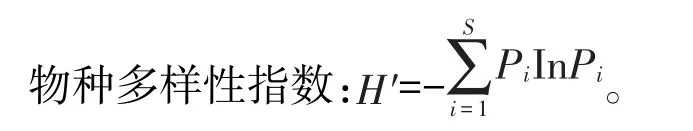
其中,,N为第 种的数量,N为所有种的数ii量,Pi为第i个种占总物种数的比例,S为采样点的物种总数〔8〕。
2 捕食线虫真菌检测结果
从208份土样中共分离出150株捕食线虫真菌,初步鉴定为3属18种(其中待定种1种)。火烧迹地、近火烧地及非火烧地中,Dactylellina属、Drechslerella属和Arthrobotrys属真菌的出现频率依 次为 67.39%、20.65%、11.96%,52.94%、8.82%、38.24%,29.16%、0.00%、70.84%;优势种分别为Dactylellina ellipspspora(OF=36.59%),Dactylellina ellipspspora(OF=16.36%)和Dactylellina drechsleri(OF=16.36%),Arthrobotrys oligospora(OF=30.00%);多样性指数H′分别为2.05、2.35、1.82。见表1。
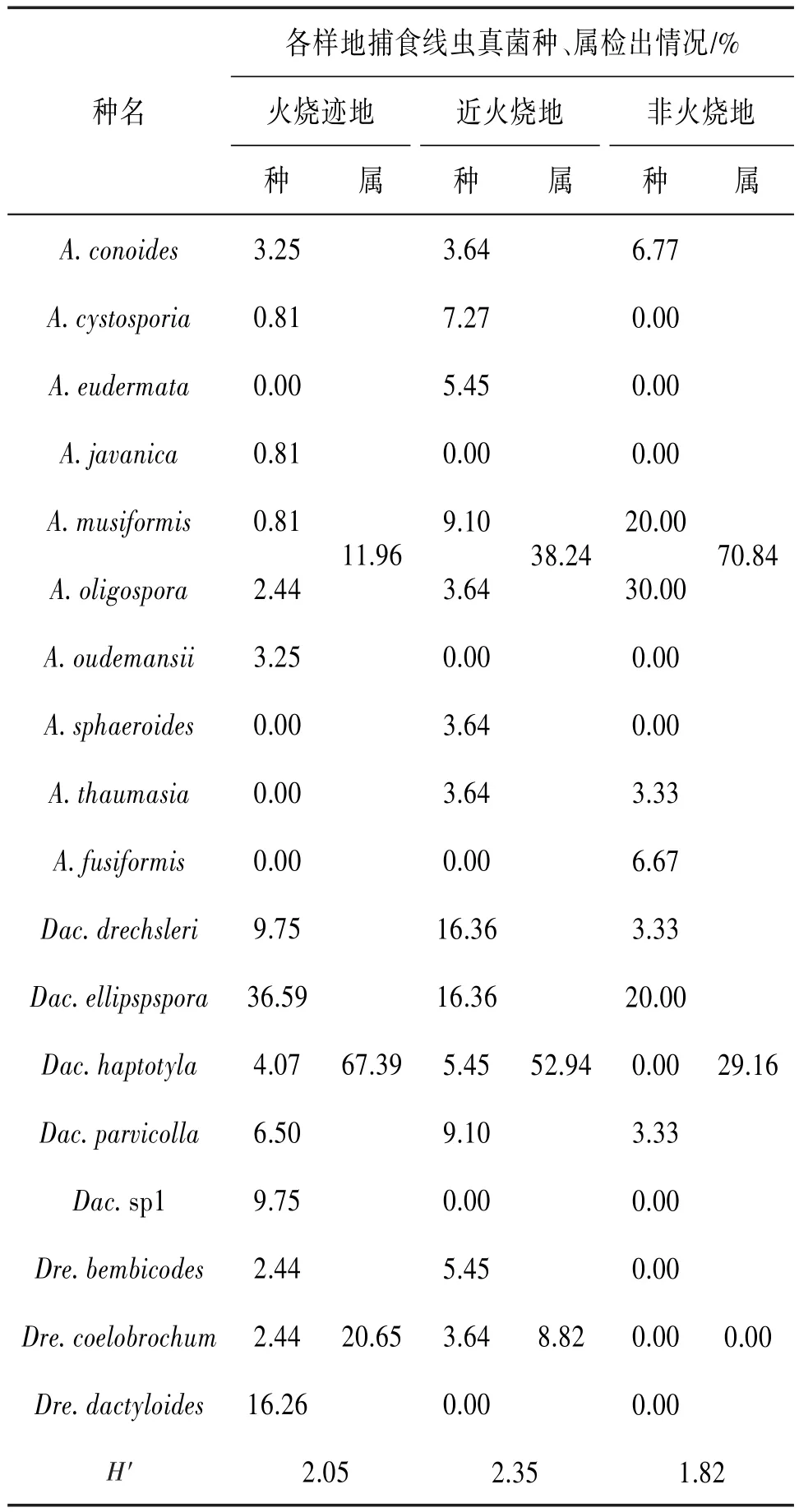
表1 各样地捕食线虫真菌的多样性
3 分析与讨论
3.1 火烧对捕食线虫真菌群落结构的影响目前普遍认为捕食线虫真菌广布于全球各种类型的生境中,Arthrobotrys属真菌也因生长快、所需营养少、腐生能力强的特点被认为是不同生境土壤中的优势种群,之后,不同学者对不同生境中捕食线虫真菌资源的调查研究也都证实了以黏性菌网捕捉线虫的Arthrobotrys属真菌的优势地位〔9〕。本研究结果也显示产生黏性菌网的Arthrobotrys属真菌是非火烧地中的优势种群(70.84%),但在近火烧地中Arthrobotrys属的检出率明显下降,产生黏性球、黏性分枝和非收缩环等捕食器官的Dactylellina属以及产生收缩环的Drechslerella属真菌的检出率上升,Dactylellina属(52.94%)取代Arthrobotrys属(38.24%)成为近火烧地的优势属;火烧迹地中Dactylellina属真菌出现频率上升为67.39%,种群优势明显,表明火烧影响了土壤中捕食线虫真菌的群落结构,从非火烧地到近火烧地再到火烧迹地,土壤中的捕食线虫真菌从以Arthrobotrys属真菌为优势的群落向以Dactylellina属真菌为优势的群落演替。
Gray和Bailey〔10〕对林地落叶土壤中捕食线虫真菌的研究发现,林地上层落物和腐殖质层会限制产收缩环、黏性分枝以及黏性球的捕食线虫真菌种群的活动,而产黏性菌网的真菌不受该限制。因此产生黏性菌网的捕食线虫真菌在未受到火烧影响的土壤中成为优势种群。火烧影响了林地上层落物和腐殖质的厚度,限制收缩环、黏性分枝以及黏性球生成的因素被削弱,为火烧迹地中Dactylellina属和Drechslerella属真菌的生长创造了条件。林火在烧去上层落物和腐殖质层的同时,改变了土壤各项理化性质和结构〔11〕,影响了线虫等土壤动物的数量和多样性〔12〕,此时,火烧迹地中腐生能力和捕食能力不同的捕食线虫真菌会受到土壤理化性质的影响,被迫发生演替。近火烧地没有受到地表火烧的直接影响,但火烧产生的高温和烟尘可能会对近火烧地造成影响,近火烧地中捕食线虫真菌向着以Dactylellina属真菌为优势的群落演替。
3.2 火烧对捕食线虫真菌多样性的影响火烧会对森林土壤生态系统产生重要影响,微生物作为土壤生态系统中的重要类群,火烧对其多样性影响很大〔13〕。本研究结果显示苍山近火烧地捕食线虫真菌多样性最高,火烧迹地次之,非火烧地最低,表明火烧增加了土壤中捕食线虫真菌的多样性。Hart等〔13〕发现林火发生后土壤中真菌的多样性增加,这与本研究结果相符。林火发生后,土壤在较小空间内会产生较高的结构异质性,这种异质性为微生物提供了多个异质的微生境,从而增加了土壤的物种容纳量〔14〕,这可能是近火烧地和火烧迹地捕食线虫真菌多样性增加的原因之一。此外,非火烧地中腐生能力较强的Arthrobotrys属真菌占据较多的生态位,从而抑制了腐生能力相对较弱的Dactylellina属和Drechslerella属真菌,而火烧对土壤生境的急剧改变使前者的生长繁殖受到了影响,种群数量下降,减少了Dactylellina和Drechslerella属真菌生长繁殖的竞争压力,同时,火烧还快速减少了环境中的抑制因子〔10〕,使Dactylellina和Drechslerella属真菌种群数量增加,多样性随之发生改变。近火烧地多样性高于另外两个样地的土壤,可能是火烧释放的热量、烟尘等间接地影响了近火烧地的生境,从而影响了捕食线虫真菌的多样性,具体原因仍有待开展进一步的研究。
3.3 捕食线虫真菌捕食器官类型的进化捕食器官的形成和分化被认为是捕食线虫真菌适应生存环境的结果,但在各捕食器官的进化地位上,尚存在较大分歧,甚至同一捕食器官的进化地位完全相反〔1,15-18〕。各捕食器官的捕食效率高低常被作为判断其进化地位的依据之一,产生黏性菌网的捕食线虫真菌,因其是目前已经调查过的绝大多数生境的优势种群,黏性菌网通常也被认为是捕食效率较高的捕食器官〔15-16,19〕。但林慧彪等〔9〕定量测定了产生不同捕食器官的捕食线虫真菌的捕食效率后发现产生黏性菌网的种捕食效率普遍不高,且同种不同株的菌株间捕食效率也存在较大差异,因此认为将捕食器官作为判断捕食线虫真菌进化地位的依据还有待更系统的研究。本研究结果显示,非火烧地中产生黏性菌网的Arthrobotrys属真菌具有明显的种群优势,而在火烧迹地和近火烧地中这种种群优势被产生黏性球、黏性分枝和非收缩环等捕食器官的Dactylellina属真菌代替。而来自火烧迹地的产生黏性球的捕食线虫真菌菌株,其捕食率和自发生成黏性球的数量都显著高于来自其他生境的同一种菌〔20〕,显示在火烧这种急剧变化的生境压力下,Dactylellina属真菌表达捕食器官的基因会更活跃,使其适应火烧环境的能力增强。相对Arthrobotrys属真菌种群数量的快速减少,火烧迹地和近火烧地产收缩环的Drechslerella属真菌检出率增加,说明Drechslerella属真菌应对急剧环境变化的能力也较Arthrobotrys属真菌强。产不同捕食器官的捕食线虫真菌的群落演替规律及不同生境中优势种群的检测结果〔15-19〕说明对捕食线虫真菌这个类群的真菌来说,不同生境下的种群优势度与捕食线虫真菌的进化地位高低并无直接的对应关系。因此,只通过分子系统发育分析和捕食率高低来探究捕食器官的进化地位似乎还不够全面。探究如火烧等剧烈环境变化下捕食线虫真菌捕食器官形成机制和群落演替规律可能是理解捕食器官进化的思路之一。

